2022-05-23 東京医科歯科大学,日本医療研究開発機構
ポイント
- 研究グループが開発した新たな核酸医薬「DNA/RNA ヘテロ2本鎖核酸(HDO)」の全身投与によって後根神経節(DRG)内にある感覚神経細胞の遺伝子の効率的な制御に成功し、このHDOが糖尿病の高頻度な合併症である神経障害(糖尿病性末梢神経障害)の治療法開発に有用であることがわかりました。
- 糖尿病性末梢神経障害マウスモデル※1において、長鎖ノンコーディングRNA※2の一つであるMALAT1※3をノックダウンすることにより、感覚神経細胞内の遺伝子転写に必要な核内構造体(核スペックル※4)が失われ、神経変性がより悪化することがわかり、MALAT1が末梢神経障害の進行抑制に不可欠な神経保護作用をもっている可能性をつきとめました。
- HDOは、後根神経節のさまざまな遺伝子をターゲットとすることができる実験系の確立によって、がんに伴った難治性疼痛など「痛み」の病態解明及び新規治療法開発に今後さらに役立つ成果をもたらすと期待できます。
概要
東京医科歯科大学大学院 医歯学総合研究科 脳神経病態学分野(脳神経内科)横田隆徳教授、永田哲也プロジェクト准教授、小林正樹非常勤講師、宮下彰子大学院生は、糖尿病マウスにヘテロ核酸を投与することで糖尿病性末梢神経障害における後根神経節のノンコーディングRNAを制御できることを示し、神経障害の表現型が増悪することを発見しました。この結果は、MALAT1が糖尿病性末梢神経障害において神経保護の重要な役割を果たしていることを示唆しています。また、本研究の結果は、今後糖尿病性末梢神経障害の治療の標的として有望な後根神経節の遺伝子制御といった治療法の開発を促進する可能性があります。この研究は日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業(課題名「第3世代ヘテロ核酸の開発」)、慢性の痛み解明研究事業(課題名「慢性疼痛に対する画期的核酸医薬の開発」)、先端的バイオ創薬等基盤技術開発事業(課題名「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的分子標的治療とブレインイメージング」 、いずれも研究代表者:横田 隆徳)などの支援のもとで行われたもので、その研究成果は、国際科学誌、Diabetes誌に、2022年5月20日午後3時(米国東部夏時間)にオンライン版で発表されました。
研究の背景
糖尿病は、さまざまな組織・臓器を障害し合併症を起こしますが、末梢神経障害は、網膜症、腎症と並んで三大合併症として知られています。糖尿病性末梢神経障害は、体中に張り巡らされている電線のような神経に起きる病気であり、神経の中でも感覚神経が強く障害されることが多く、患者さんに痛みなどの苦痛をもたらし生活の質(QOL)に影響します(図A)。糖尿病性末梢神経障害は、神経の末端から始まることが特徴で、手足がピリピリ、ジンジン痺れ、やけどのようにヒリヒリ痛んだりなどの異常感覚や疼痛を生じ、不眠になるなど睡眠にも影響します。治療せずに神経障害が進行すると、感覚が鈍くなり、足の怪我ややけどにも気づかず壊疽をおこし切断が必要なほど重大な合併症を生じてしまうこともあります。治療は、糖尿病として血糖値のコントロールが基本ですが、それだけでは不十分で神経障害の進行抑制や再生を促進することが必要です。しかしながら、その病態は複雑で未だ明らかではなく、有効な治療法の開発に至っていません。したがって、私たちの研究室では、糖尿病によって後根神経節(DRG)にある感覚神経細胞がターゲットとされ、壊れて変性してしまうこと(感覚神経の変性)が病態の中核であることに着眼し、その感覚神経細胞でおきている遺伝子発現を制御することを治療法開発の戦略としました(図A)。
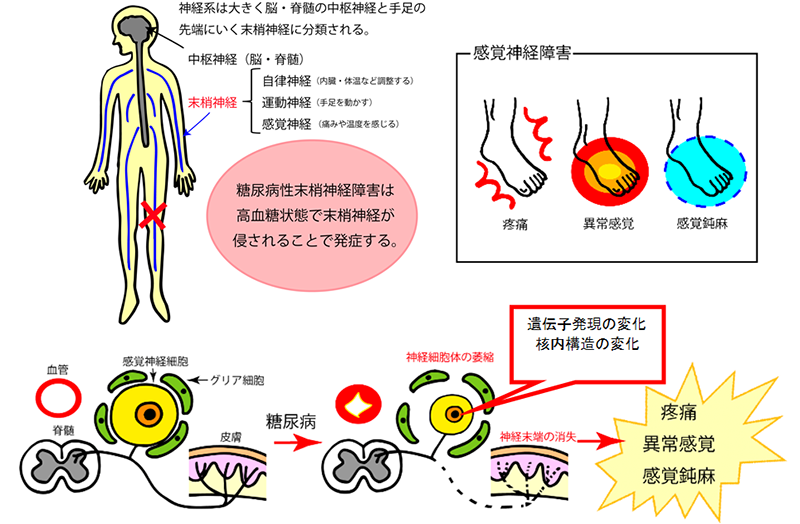 図A 糖尿病性末梢神経障害の症状とその病態:手足に様々な感覚障害(疼痛、感覚鈍麻、異常感覚など)をおこすことが特徴。その病態は、高血糖状態の後根神経節感覚神経細胞において細胞死/保護に関連する遺伝子発現の変化と核内構造の変化が見られ、神経細胞体の萎縮・神経終末の消失(感覚神経の変性)が生じると考えられる。
図A 糖尿病性末梢神経障害の症状とその病態:手足に様々な感覚障害(疼痛、感覚鈍麻、異常感覚など)をおこすことが特徴。その病態は、高血糖状態の後根神経節感覚神経細胞において細胞死/保護に関連する遺伝子発現の変化と核内構造の変化が見られ、神経細胞体の萎縮・神経終末の消失(感覚神経の変性)が生じると考えられる。
昨今タンパク質をコードしないRNA(ノンコーディングRNA)が様々な疾患の病態に関与していることが解明されつつあり、長鎖ノンコーディングRNAの一つである MALAT1は糖尿病性網膜症や腎症といった糖尿病合併症の発症と進行に極めて重要な役割を果たすことが注目されていますが、末梢神経障害におけるMALAT1の役割は報告されていませんでした。本研究ではMALAT1が、糖尿病性末梢神経障害の病態形成にどのような役割を果たしているかを明らかにしようと試みました。我々の研究室ではアンチセンス核酸(ASO)の送達効率を改善させたHDOの開発をしていますが、今回DRG への効率的な送達が見込まれるビタミンE(トコフェロール)を結合したヘテロ核酸(Toc-HDO)(図B)(2015年8月11日東京医科歯科大学プレスリリース)を用いてMALAT1 をノックダウンし、糖尿病マウスの末梢神経系にどのような影響が出るかを検討しました。
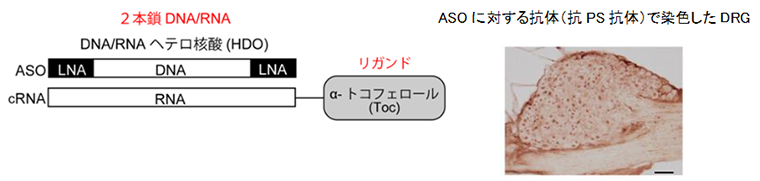
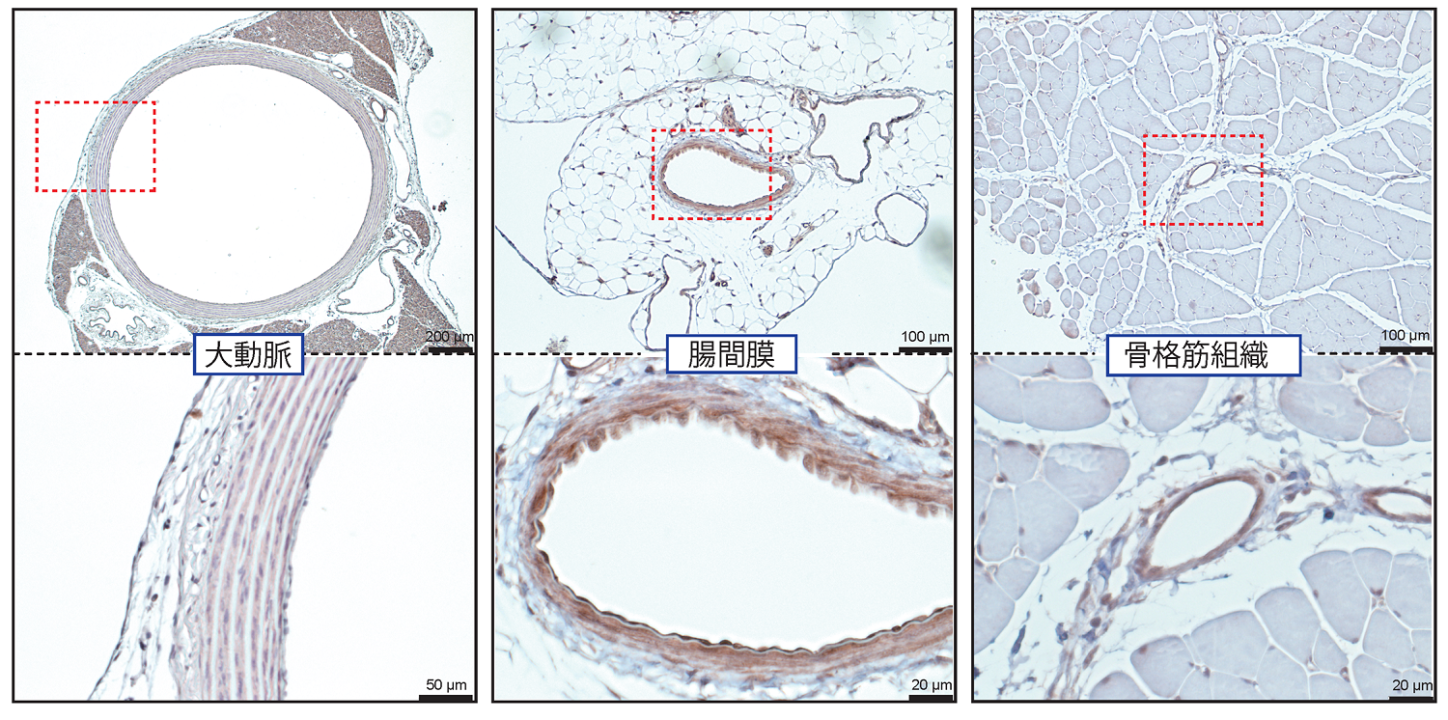
図B ヘテロ核酸の構造:ヘテロ核酸はDNAから構成されるアンチセンス核酸(ASO)鎖とそれに相補的なRNA鎖からなる。天然ビタミンEであるα-トコフェロール(Toc)を相補鎖に結合したヘテロ核酸(Toc-HDO)は細胞膜の透過性を亢進させ、効率的に標的RNAを抑制することが可能である。ASO(左図の赤色矢印)に対する抗体でToc-HDOを投与したマウスのDRGを染めると主に核が染色される(右写真)。
本研究では、健常マウスに糖尿病を導入(ストレプトゾトシン誘発糖尿病マウス)するとDRG感覚神経細胞のMALAT1の発現が有意に上昇することがわかり、Toc-HDOの静脈内投与することにより、その発現を効果的に抑制(ノックダウン)することに成功しました(図C)。MALAT1ノックダウンによる糖尿病マウスの表現型の変化として、熱及び機械的刺激に対する侵害閾値の上昇、坐骨神経の伝導遅延といった感覚神経の機能悪化がみられ(図D)、同時に病理学的に核スペックル※4と呼ばれる核内構造体(遺伝子転写に重要)の損失(図E)に伴って感覚神経の細胞体の萎縮と軸索末端の変性(dying-back型変性)の促進がみられました(図E)。この結果は、MALAT1が糖尿病ストレスを防御するために神経保護作用を有しているという重要な証拠を提示しています。加えて、本研究で実行したHDOによるDRGを標的とした遺伝子制御法が糖尿病性末梢神経障害の有効な治療法開発の重要な端緒となると期待されます。
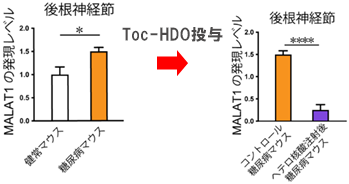
図C ストレプトゾトシン誘発糖尿病マウスの後根神経節で長鎖ノンコーディングRNAのMALAT1の発現が上昇しており、ヘテロ核酸を静脈注射するとその発現を効果的に抑制することができた。
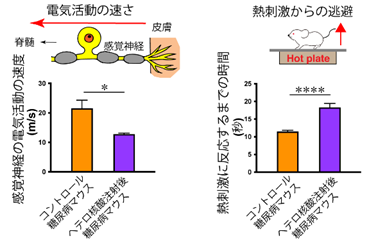
図D 糖尿病マウスのMALAT1ノックダウンによる感覚機能の変化:坐骨神経の伝導遅延、熱刺激に対する侵害閾値の上昇といった感覚神経機能の悪化を認めた。
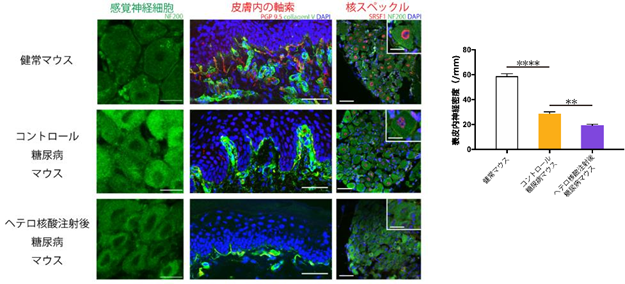
図E 糖尿病マウスの感覚神経細胞は健常マウスに比較して萎縮していたが、MALAT1の発現を抑制することによりさらに萎縮していた。足底の皮膚内の感覚神経(赤)の密度は糖尿病により減少していたが、MALAT1の発現を抑制することによりさらに減少していた。正常では感覚神経細胞の核に認める構造体である核スペックル(赤)は糖尿病により減少し、MALAT1の発現を抑制することによりさらに減少していた。
研究成果の意義
糖尿病性末梢神経障害で生じる神経変性に対する防御機能として、MALAT1が神経保護作用するという重要な役割を解明しました(図F)。さらに、後根神経節神経細胞の遺伝子発現をヘテロ核酸のターゲットとしノックアウトした表現型を検討することが、糖尿病性末梢神経障害の病態解明に有効であった動物実験例をはじめて報告しました。糖尿病の発症率は年々増加しており、その合併症の一つである糖尿病性末梢神経障害では手足の痛みなどの辛い症状がでるにもかかわらず対症療法以外に確立した薬は開発されてきませんでした。HDOによる後根神経節を標的とした遺伝子制御法によって、近い将来に糖尿病性末梢神経障害を効果的に治療できるようになることが期待されます。
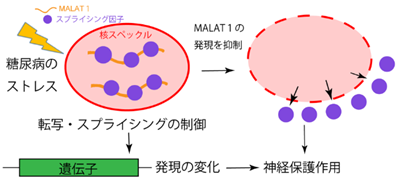
図F 糖尿病性末梢神経障害におけるMALAT1の役割: MALAT1は核スペックル内のスプライシング因子と相互作用し、転写を制御して特定の遺伝子発現に影響を及ぼすことが知られている。本研究において感覚神経細胞のMALAT1の発現を抑制すると核スペックルが消失し、神経保護作用に関わる遺伝子のスプライシングができなくなり、感覚神経が変性してしまう可能性がある。
用語解説
- ※1糖尿病性末梢神経障害モデルマウス
- 健常マウスの腹腔内に、膵毒性のあるストレプトゾトシンを注射し、持続的な高血糖を4ヶ月以上引き起こした。これを慢性期の糖尿病モデルマウスとして本研究で使用した。ストレプトゾトシン投与によりインスリン欠乏、高血糖、多飲、多尿を呈し、これらはすべてヒトの1型糖尿病に特徴的なものである。
- ※2ノンコーディングRNA
- タンパク質へ翻訳されずに機能するRNAの総称である。人のゲノムにおいてタンパク質をコードする遺伝子は2%に満たず、98%以上がノンコーディング領域となる。大きくは200塩基以下の小分子RNAと200塩基以上の長さの長鎖ノンコーディングRNAに分類される。その機能は転写、翻訳、エピジェネティクスなど生体内の多様である。
- ※3 MALAT1(metastasis associated in lung adenocarcinoma transcript-1)
- 長鎖ノンコーディングRNAの1つであり、転写や選択的スプライシングを制御している。多くの疾患、特に肺癌をはじめとして多くの癌と関連することが知られており、腫瘍細胞の増殖、移動、浸潤、アポトーシスに影響を及ぼすことが明らかにされている。
- ※4 核スペックル
- 核内の構造体で1細胞あたり25~50個程度存在し,主としてスプライシング因子群の貯蔵・会合・修飾の場と考えられている。
論文情報
- 掲載誌
- Diabetes
- 論文タイトル
- The role of long non-coding RNA MALAT1 in diabetic polyneuropathy and the impact of its silencing in the dorsal root ganglion by a DNA/RNA heteroduplex oligonucleotide
研究者プロフィール
横田 隆徳(ヨコタ タカノリ)Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科)教授
- 研究領域:神経内科学、核酸医薬
永田 哲也(ナガタ テツヤ)Tetsuya Nagata
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科)プロジェクト准教授
- 研究領域:神経内科学、核酸医薬
小林 正樹(コバヤシ マサキ)Masaki Kobayashi
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 非常勤講師
- 研究領域:神経内科学
宮下 彰子(ミヤシタ アキコ)Akiko Miyashita
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
お問い合わせ先
研究に関すること
横田 隆徳 (ヨコタ タカノリ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED 事業に関すること
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当