「ゲートキーパー」変異がキナーゼと呼ばれる酵素を不活性型に不安定化させ、より活性化することを発見、より攻撃的ながんの再発を説明できるかもしれない Study finds that “gatekeeper” mutations make enzymes called kinases more active by destabilizing them in their inactive form, which may explain more aggressive cancer recurrence
2023-02-13 ニューヨーク大学 (NYU)
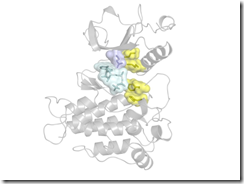
Structure of the FGFR kinase showing the locations of the gatekeeper residue in blue, hydrophobic spine in yellow, and ATP in cyan. Most drugs bind to the kinase in the same pocket as ATP. Credit: Traaseth Lab/NYU
◆米国科学アカデミー紀要に発表されたニューヨーク大学の研究者らの新しい研究は、がんがキナーゼ阻害剤に反応しなくなるだけでなく、より強く再発する理由を説明している。この発見は、腫瘍医が第一選択治療として用いる薬剤に情報を与える可能性がある。
◆キナーゼ阻害剤が効かなくなる薬剤耐性の主な原因は、遺伝子変異の出現であり、特にキナーゼの「ゲートキーパー」残基と呼ばれる部位に変異が生じることである。ゲートキーパーはキナーゼに深く埋め込まれ、さらに深い疎水性(水をはじく)ポケットへのアクセスを可能にしたり妨げたりする。
◆キナーゼ阻害剤はこの疎水性ポケットに結合して作用するため、ゲートキーパー残基に変異があると、薬物へのアクセスが阻害され、その効果が減少する。しかし、NYUの研究者らによれば、ゲートキーパー変異は、それ以上に重要な働きもするのだという。
◆彼らの研究で、研究者達は、肺がんや血液がんを含む様々ながんで頻繁に変異するキナーゼファミリーの線維芽細胞成長因子受容体(FGFR)に着目しています。FGFR関連がんの治療には、疎水性ポケットに結合して受容体をブロックする受容体チロシンキナーゼ阻害剤が用いられるが、これはがんを効果的に治療できるかもしれないが、薬剤耐性のゲートキーパー変異を生み出す可能性がある。
◆研究チームは、実験(キナーゼ活性測定、核磁気共鳴(NMR)分光法)およびコンピューターシミュレーションなどの多角的なアプローチにより、2種類の異なるゲートキーパー変異を有するFGFRキナーゼを研究し、ゲートキーパー変異によってキナーゼがどのように活性化されるかを明らかにした。
◆キナーゼが機能するためには、不活性状態から活性状態に変換する必要がある。先行研究では、ゲートキーパー変異は、キナーゼの異なる領域をつなぐ4つの残基からなるネットワーク、いわゆる「疎水性スパイン」を強化し安定化することでキナーゼの活性状態に影響を与えると考えられていた。しかし、実験とシミュレーションの結果、研究者らは、FGFRキナーゼのゲートキーパー変異が、実際にはキナーゼの不活性状態に影響を与え、疎水性スパインを弱めることで不安定化し、キナーゼが活性型に移行するのを許していることを突き止めたのである。
<関連情報>
- https://www.nyu.edu/about/news-publications/news/2023/february/kinase-blocking-drugs-pnas.html
- https://www.pnas.org/doi/10.1073/pnas.2213090120
ゲートキーパー変異は、自己抑制状態を不安定にすることでFGF受容体チロシンキナーゼを活性化する Gatekeeper mutations activate FGF receptor tyrosine kinases by destabilizing the autoinhibited state
Alida Besch,William M. Marsiglia,Moosa Mohammadi ,Yingkai Zhang,Nathaniel J. Traaseth
Proceedings of the National Academy of Sciences Published:February 15, 2023
DOI:https://doi.org/10.1073/pnas.2213090120
Significance
Anticancer drugs inhibiting the kinase domain of receptor tyrosine kinases block downstream phosphorylation necessary for cellular signaling and growth. However, a major impediment to successful cancer therapy is the emergence of drug resistance mutations at a residue situated at the kinase hinge region between the N- and C-lobes, which provides fitness advantages for tumor growth. In this work, we used kinase assays, NMR spectroscopy, and MD simulations to determine the mechanism of kinase activation from drug-resistant gatekeeper mutations. We found that these mutations destabilize the autoinhibited conformation of the kinase by weakening the hydrophobic spine and modulating the conformation of the conserved DFG motif, thereby leading to the conclusion that gatekeeper mutations increase in the population of the active state.
Abstract
Many types of human cancers are being treated with small molecule ATP-competitive inhibitors targeting the kinase domain of receptor tyrosine kinases. Despite initial successful remission, long-term treatment almost inevitably leads to the emergence of drug resistance mutations at the gatekeeper residue hindering the access of the inhibitor to a hydrophobic pocket at the back of the ATP-binding cleft. In addition to reducing drug efficacy, gatekeeper mutations elevate the intrinsic activity of the tyrosine kinase domain leading to more aggressive types of cancer. However, the mechanism of gain-of-function by gatekeeper mutations is poorly understood. Here, we characterized fibroblast growth factor receptor (FGFR) tyrosine kinases harboring two distinct gatekeeper mutations using kinase activity assays, NMR spectroscopy, bioinformatic analyses, and MD simulations. Our data show that gatekeeper mutations destabilize the autoinhibitory conformation of the DFG motif locally and of the kinase globally, suggesting they impart gain-of-function by facilitating the kinase’s ability to populate the active state.