2020-11-13 長岡工業高等専門学校,東京大学,東京工業大学,理化学研究所,株式会社リガク,日本医療研究開発機構
ポイント
- 環状ペプチド医薬品であるダルババンシンと血漿タンパク質であるヒト血清アルブミンの複合体結晶構造を解明。
- 結晶構造と溶液状態での解析を組み合わせ、溶液中での結合状態を解明。
- 環状ペプチド医薬品の最適化に貢献することが期待される。
概要
長岡工業高等専門学校電気電子システム工学科の和久井直樹助教、東京大学大学院工学系研究科化学生命工学専攻博士課程の妹尾暁暢氏、東京大学大学院工学系研究科バイオエンジニアリング専攻/化学生命工学専攻の津本浩平教授、東京大学医科学研究所/東京大学大学院工学系研究科バイオエンジニアリング専攻の長門石曉特任准教授、東京工業大学情報理工学院情報工学系の大上雅史助教、理化学研究所放射光科学研究センターの山本雅貴グループディレクター、株式会社リガクらの研究グループは、環状ペプチド医薬品*1であるダルババンシン*2と血漿タンパク質であるヒト血清アルブミンの複合体結晶構造を解明しました。
低分子医薬品、抗体医薬品につぐ第3の医薬品として環状ペプチド医薬品が近年注目を集めています。しかし、環状ペプチド医薬品は腎排泄*3などの影響から投与後の体内安定性が低いことが問題として知られています。環状ペプチド医薬品の体内安定性を向上させるためには、血漿タンパク質であるヒト血清アルブミンとの結合が非常に重要になります。しかし、これまでに環状ペプチドとヒト血清アルブミンの複合体構造は報告されておらず、環状ペプチドがどのようにヒト血清アルブミンに結合しているかは未解明でした。
本研究グループは、大型放射光施設「SPring-8*4」のビームライン(BL26B2、BL32XU)を用いたX線結晶構造解析*5、実験室系X線装置を用いたX線小角散乱法*6(Small-angle X-ray scattering, SAXS)、等温滴定型カロリメーター*7(Isothermal titration calorimetry, ITC)、分子動力学(Molecular dynamics, MD)シミュレーション*8を組み合わせることで、ダルババンシンのヒト血清アルブミンに対する結合様式を明らかにしました。今後、複合体結晶構造から明らかになった相互作用に基づく環状ペプチドの設計などが期待されます。
本研究成果は、日本標準時2020年11月13日(金)17時(グリニッジ標準時2020年11月13日(金)8時)公開のJournal of Medicinal Chemistry誌に掲載されます。
背景
ヒト血清アルブミンは、血漿タンパク質の60~70%を占め、血漿中で最も豊富なタンパク質であり、血中において多くの物質の輸送等を担っています。
環状ペプチド医薬品は、核酸医薬品と共に、低分子医薬品、抗体医薬品につぐ第3の医薬品として近年注目を集めていますが、腎排泄などの影響から、投与後の体内安定性が低いことが問題として上げられています。環状ペプチド医薬品の体内安定性を向上させるためには、血漿タンパク質であるヒト血清アルブミンとの結合が非常に重要になります。しかし、これまでに環状ペプチドとヒト血清アルブミンの複合体構造は報告されておらず、環状ペプチドがどのようにヒト血清アルブミンに結合しているかは未解明でした。
研究手法
研究グループは、ヒト血清アルブミンと既に上市されている環状ペプチド医薬品であるダルババンシンの結合様式を詳細に理解することを目的とし、大型放射光施設「SPring-8」のビームライン(BL26B2、BL32XU)を用いてX線結晶構造解析を実施し、原子分解能でのヒト血清アルブミンとダルババンシンとの結合様式の解析を行いました。さらに、生体中の環境に近い、溶液中での結合状態を解析するため、実験室系X線装置を用いたX線小角散乱法(Small-angle X-ray scattering, SAXS)、等温滴定型カロリメーター(Isothermal titration calorimetry, ITC)、分子動力学(Molecular dynamics, MD)シミュレーションを行いました。
研究成果
結晶構造解析の結果から、環状ペプチド医薬品であるダルババンシンは、ヒト血清アルブミンの一般的な化合物結合サイトとは異なる部位に結合していることがわかりました。また、結晶構造中では、1分子のヒト血清アルブミンに対して、2分子のダルババンシンが結合していました(図1)。しかしながら、ヒト血清アルブミンに結合していた2分子のダルババンシンのうち、一方は、結晶中で隣り合って位置しているヒト血清アルブミンの影響を大きく受けており、結晶中と溶液中とでダルババンシンとヒト血清アルブミンの構造が異なることが示唆されました。そこで、SAXSおよびITCを用いて溶液状態での解析を行い、溶液中ではダルババンシンが結晶中で観測された2箇所の結合サイトのうち、片方のみにしか結合しないことを明らかにしました。結晶構造解析、SAXSおよびITCから明らかになったダルババンシン結合部位において、ダルババンシンの疎水性領域である炭化水素鎖は、ヒト血清アルブミンの疎水性ポケットに深く挿さるように結合していました。一方で、ダルババンシンの環状領域は、ヒト血清アルブミンの表面を覆うように結合し、相互作用面積を増加させつつ、かつ多くの水素結合を形成することで、ヒト血清アルブミンに強く結合していました(図2)。さらに、結晶構造解析と分子動力学シミュレーションの結果から、ダルババンシンはヒト血清アルブミンにinduced-fit*9と呼ばれる様式で結合することを示しました。
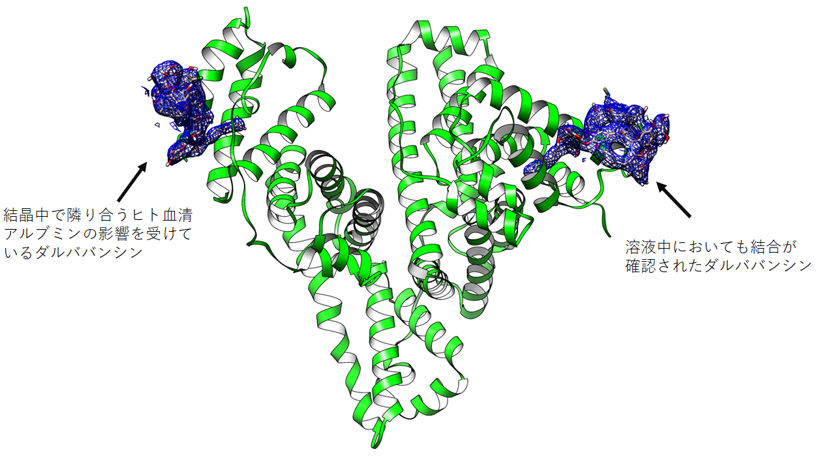 図1 結晶構造解析の結果明らかになったダルババンシンとヒト血清アルブミンの複合体構造。図中の青いメッシュで示した2つの分子がダルババンシン。図中の緑色で示した分子がヒト血清アルブミン。
図1 結晶構造解析の結果明らかになったダルババンシンとヒト血清アルブミンの複合体構造。図中の青いメッシュで示した2つの分子がダルババンシン。図中の緑色で示した分子がヒト血清アルブミン。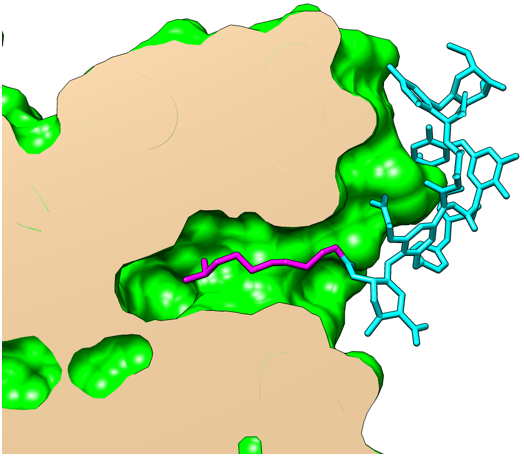
図2 ダルババンシン結合部位を拡大した断面図。マゼンタおよびシアンで示した部分が、それぞれダルババンシンの疎水性、親水性領域。ダルババンシンの疎水性領域は、ヒト血清アルブミンの疎水性ポケットにアクセスしていました。一方でダルババンシンの親水性領域はヒト血清アルブミンを覆うように結合することで、ヒト血清アルブミンとの親水性相互作用を強めていることが明らかになりました。
今後への期待
本研究で明らかになった構造情報に基づき、ヒト血清アルブミンとより適切に相互作用する環状ペプチドをデザインすることで、体内安定性が向上した環状ペプチドの開発が期待されます。
謝辞
本研究は日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化)(JP20am0101070)」、「リード創製を指向した物理化学的品質評価技術の開発と支援(JP20am0101094)」および日本学術振興会(JSPS)から交付を受けた科研費(20K19926)の助成を受けて実施されました。
用語解説
- *1 環状ペプチド医薬品
- タンパク質の構成成分であるアミノ酸が数個から数十個程度、環状につながり出来た物質を環状ペプチドと呼ぶ。環状ペプチド骨格を有する医薬品の総称。低分子医薬品と抗体医薬品の問題点を解決する可能性を秘めているとして注目を集めている。
- *2 ダルババンシン
- 環状ペプチド骨格を有する抗生物質。皮膚感染症の治療などに用いられている。
- *3 腎排泄
- 腎臓の濾過機能によって薬などが体外へ排泄されること。一般的にペプチドは腎臓の濾過機能によって体外に排出されることが知られているため、体内に安定して存在することが難しいと言われている。ペプチドは血漿タンパク質であるヒト血清アルブミンと結合することで、腎臓の濾過機能による体外への排出を回避することができ、体内安定性を向上させることが出来る。
- *4 SPring-8
- 理化学研究所が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
- *5 X線結晶構造解析
- タンパク質の結晶にX線を照射して得られる回折データから、タンパク質の立体構造を決定する分析法。
- *6 X線小角散乱法
- タンパク質溶液にX線を照射して得られる散乱を測定、解析しタンパク質の巨視的構造を決定する分析法。
- *7 等温滴定型カロリメーター
- 結合分子を標的タンパク質に滴下した際の熱量を測定することによって結合分子と標的タンパク質の分子間相互作用を検出する分析法。
- *8 分子動力学シミュレーション
- コンピュータ上に仮想のタンパク質を配置し、原子間の相互作用を仮定して、タンパク質がどのような構造をとるか、どのように運動するかを計算で予測すること。
- *9 induced-fit
- 結合相手となる化合物との相互作用が最適になるように、タンパク質が自身の構造を変化させて化合物と結合する様式。
論文情報
- 論文名
- Structural basis for binding mechanism of human serum albumin complexed with cyclic peptide dalbavancin
- (環状ペプチド医薬品ダルババンシンのアルブミンへの結合に関する構造基盤)
- 著者名
- 1,2伊藤翔、3妹尾暁暢、4長門石曉、5大上雅史、2,6山本雅貴、3,4津本浩平、7和久井直樹
1 株式会社リガク、2 兵庫県立大学生命理学研究科、3 東京大学大学院工学系研究科、4 東京大学医科学研究所、5 東京工業大学情報理工学院、6 理化学研究所放射光科学研究センター、7 長岡工業高等専門学校 - 雑誌名
- Journal of Medicinal Chemistry(創薬全般の専門誌)
- DOI
- 10.1021/10.1021/acs.jmedchem.0c01578
- 公表日
- 日本標準時2020年11月13日(金)17時(グリニッジ標準時2020年11月13日(金)8時)
お問い合わせ先
研究内容に関すること
長岡工業高等専門学校 電気電子システム工学科
助教 和久井直樹(わくいなおき)
株式会社リガク 応用技術センター 単結晶構造解析グループ
伊藤翔(いとうしょう)
長岡工業高等専門学校に関すること
長岡工業高等専門学校 総務課 広報企画担当
東京大学工学系研究科に関すること
東京大学 大学院工学系研究科 広報室
東京工業大学に関すること
東京工業大学 総務部 広報課
理化学研究所に関すること
理化学研究所 広報室 報道担当
AMED事業に関すること
日本医療研究開発機構(AMED) 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)