2022-05-24 福岡大学,日本医療研究開発機構
本研究成果のポイント
- 糖尿病の根治治療として膵β細胞(膵島)の移植医療が簡便で安全な治療法として実施されている。現状では拒絶反応を防ぐために移植後生涯に渡って免疫抑制剤による治療が必須であるが、免疫力低下による感染症や腫瘍発症などの副作用があり、免疫抑制剤を必要としない拒絶反応制御法の開発が切望されている。特に小児において免疫抑制剤は発育障害をもたらす副作用があり使用できず、従って現状では小児1型糖尿病に対して膵β細胞移植医療は行われていない。今回開発した免疫抑制剤を用いない新規拒絶反応制御法により将来、膵島細胞移植は成人のみならず、小児I型糖尿病の新たな治療手段となる可能性を示している。
- 新規拒絶反応制御法は糖尿病の再生医療である iPS細胞、ES細胞から創生された膵β細胞移植医療にも応用可能な拒絶反応制御法で今後の糖尿病再生医療の発展に大きく貢献することが期待される。
概要
福岡大学(朔啓二郎学長)は、膵島(※1)細胞移植における画期的な免疫抑制剤を用いない拒絶反応制御法を開発しました。日本医療研究開発機構(AMED)からの研究費支援を受けた福岡大学基盤研究機関膵島研究所(安波洋一名誉教授他)による成果です。
国内約2000万人の糖尿病患者のうち、生涯インスリンを注射し続けなければならない重症患者は約10ー20万人です。インスリン注射から解放される方法の一つとして注目されているのが、インスリンを作る膵島細胞(図1)を糖尿病患者に移植する膵島細胞移植です。しかしながら移植細胞が移植後に生着し、治療効果を発揮するためには、移植細胞に対する拒絶反応を防ぐ必要があり、その為には現在では免疫抑制剤が用いられており、移植後糖尿病レシピエントは生涯に渡り服用しなければなりません。一方で免疫抑制剤による免疫力の低下は感染症や悪性腫瘍を誘発する副作用があり、理想的には免疫抑制剤を用いない拒絶反応制御法の開発が切望されます。特に小児I型糖尿病では免疫抑制剤による発達障害の副作用があるために、使用できず現状では膵島移植は小児1型糖尿病には実施されていませんが、免疫抑制剤を用いない拒絶反応制御法が開発されれば治療を受けることができるようになります。更に最近研究が進められているiPS/ES細胞から創生した膵β細胞移植による糖尿病の再生医療においても画期的成果をもたらす可能性があります。
この移植治療では従来、移植部位として肝臓が用いられてきましたが肝臓特有の(早期)拒絶反応などの課題があり、それらを解決する新しい移植法(移植部位)が求められていました。先に研究グループはそれらを全て解決する肝臓に代わる新しい皮下脂肪組織内膵島移植法を見出し、報告しています。(Transplantation2018*)。今回、この新たな皮下脂肪組織内膵島移植法を用いて、免疫抑制剤を用いない拒絶反応制御法を開発しました。具体的には移植部位である皮下脂肪組織を前処置により拒絶反応が発現しない局所環境を創生しその部位に膵島細胞を移植することにより拒絶反応が回避できることを見出しました。その機序として前処置により皮下脂肪組織内に免疫抑制因子であるTGFβを産生する間葉系幹細胞(図2)が誘導され、拒絶制御に必須の役割を担っていることを明らかにしました。
本研究成果は、米国糖尿病学会誌『Diabetes』(5月24日付け電子版)に掲載されました。
背景
国内の糖尿病患者数は約2000万人以上(平成28年度国民栄養・健康調査報告)とも言われています。このうち、重症糖尿病患者約10-20万人は、生涯にわたってインスリンを注射し続けなければなりません。このような重症糖尿病患者をインスリン注射から解放させる究極の治療法は、インスリンを作る膵島細胞(図1)を糖尿病患者の肝臓内に移植し、永久に生着させ、糖尿病を完治させるという方法です。しかしながら移植細胞が移植後に生着し、治療効果を発揮するためには、移植細胞に対する拒絶反応を防ぐ必要があり、その為には免疫抑制剤の使用が必須で、移植後糖尿病レシピエントは生涯に渡り服用しなければなりません。一方で免疫抑制剤による免疫力の低下は感染症や悪性腫瘍を誘発する副作用があり、理想的には免疫抑制剤を用いない拒絶反応制御法の開発が望まれます。特に小児I型糖尿病では免疫抑制剤による発達障害の副作用があり、使用できず現状では膵島移植は小児1型糖尿病には実施されていませんが、免疫抑制剤を用いない拒絶反応制御法が開発されればその治療を受けることができるようになります。更に最近研究が進められているiPS/ES細胞から創生した膵β細胞移植による糖尿病の再生医療において免疫抑制剤を用いない拒絶反応制御法開発は重要な課題であり実現すれば画期的成果となり糖尿病再生医療の発展に大きく貢献することとなります。
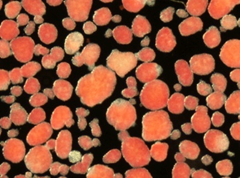
図1.単離膵島類円形を示す赤色の塊が個々の膵島、大きさは約0.2mm(直径)で約2000ー3000の細胞集塊である。インスリンに含有される亜鉛が赤色に染色されている。この移植治療では従来、移植部位として肝臓が用いられてきましたが肝臓特有の(早期)拒絶反応などの課題があり、それらを解決する新しい移植法(移植部位)が求められていました。先に研究グループはそれらを全て解決する肝臓に代わる新しい皮下脂肪組織内膵島移植法を見出し、報告しています(Transplantation 2018*)。今回、この新たな皮下脂肪組織内膵島移植法を用いて、免疫抑制剤を用いない拒絶反応制御法を開発しました。
研究手法と成果
今回の研究ではマウス膵島移植の実験系を用いています。白マウス(BALB/c)から分離した膵島を糖尿病黒マウス(C57BL/6)の鼠径部皮下脂肪組織内に移植すると糖尿病レシピエントの高血糖(400mg/dl)は移植膵島から分泌されるインスリンにより一旦は正常化(<200mg/dl)しますが移植後10日前後までに拒絶反応により移植膵島は破壊され、その結果インスリンは枯渇しレシピエントは再度高血糖になります。この実験系でレシピエント皮下脂肪組織を移植前に薬剤(bFGF**)で前処置し、その部位に膵島を移植すると糖尿病マウス血糖は移植後高血糖とならずに長期間(>1年)に渡り正常血糖でした。移植後1年で移植した膵島を含む皮下脂肪組織を摘出するとレシピエントは高血糖となりました。この結果は、レシピエントの正常血糖は移植膵島から分泌されたインスリンによってもたらされていたということを示しています。摘出した組織の顕微鏡観察で正常の移植膵島を認め、移植膵島が免疫抑制剤なしで1年以上拒絶されずに生着したことの証明となりました。マウス寿命は約1年余で今回開発した拒絶制御法で移植膵島が1年以上生着したということはこの手法により生涯にわたり免疫抑制なしで拒絶を制御できたことになります。重要な知見としてこの拒絶制御の機序に関し、前処置により皮下脂肪組織内に免疫抑制因子であるTGFβを産生する間葉系幹細胞が大量に誘導され(図2)、加えて別の実験として前処置により皮下脂肪組織内に誘導された間葉系幹細胞を単離し、分離膵島と一緒に糖尿病マウスに移植(図3上段)すると免疫抑制剤なしで移植膵島は生着することが分かりました(図3下段)。一緒に移植したTGFβを産生する間葉系幹細胞が移植局所にとどまり、長期に渡って拒絶反応を制御していることが判明しました。
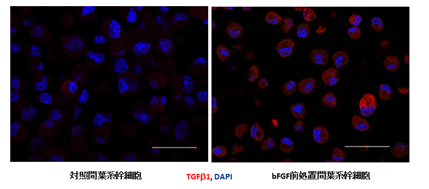
図2.bFGF前処置による皮下脂肪組織内間葉系幹細胞のTGFβ産生誘導左:対照群間葉系幹細胞
右:bFGFにより誘導されたTGFβ産生間葉系幹細胞(赤色)
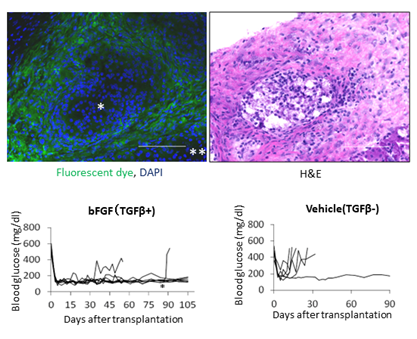
図3.TGFβ産生間葉系幹細胞と膵島との共移植による拒絶反応制御(上段左):腎被膜下移植膵島(*印)が共移植した間葉系幹細胞(緑色蛍光色素で標識された)に取り囲まれている。
(上段右):HE染色。
(下段左):bFGF処置によりTGFβ産生能を有する間葉系幹細胞との共移植による移植膵島生着。*;移植膵島摘出。
(下段右):対照群でTGFβ産生しない間葉系幹細胞との共移植では拒絶が発現。
今後の展開
従来、免疫抑制剤を用いない拒絶反応制御法は免疫隔離膜を装着した装置内(デバイス)に膵島を封入し、皮下や腹腔内に移植する手法が主体で開発が進められてきました。移植膵島が生着するにはレシピエントから移植膵島への新生血管創生が必須でそれにより酸素や栄養素の供給がなされ、移植膵島は生存、生着できます。しかしながらデバイスを用いた手法では移植膵島への新生血管は免疫隔離膜により遮断され、移植膵島への酸素、栄養素は免疫隔離膜を介した拡散によってのみ供給されることになりますがそれだけでは不十分で、大半の移植膵島は死滅し、十分量のインスリンを分泌できずに移植後糖尿病レシピエントの血糖を下げる治療効果を発揮できないていないのが現状です。今回、我々が見出した免疫抑制剤を用いない局所拒絶反応制御法は従来の物理的免疫隔離膜に対し免疫抑制因子TGFβを産生する間葉系幹細胞を用いた“生物学的免疫隔離膜”ともいえるもので物理的免疫隔離膜の課題である新生血管の遮断による移植膵島生着率低下を克服する全く新しい手法といえます。今回の研究成果はI型糖尿病の根治治療としての膵島移植のみならず、iPS/ES細胞より創生した膵β細胞の移植による糖尿病再生医療の発展への多大な貢献が期待できる画期的成果です。
特記事項
本研究は、日本医療研究開発機構(AMED)・再生医療実現拠点ネットワークプログラム技術開発個別課題<基盤技術(移植免疫)>の支援によって行われました。
論文情報
- 英文タイトル
- Acceptance of murine islet allografts without immunosuppression in the inguinal subcutaneous white adipose tissue pretreated with bFGF
- タイトル和訳
- マウス鼠径部皮下脂肪組織のbFGF前処置による免疫抑制剤を用いない同種移植膵島拒絶反応の制御
- 著者名
- Yuki Nakafusa, Naoyoshi Nitta, Kazunari Ishii, Naoto Shirasu, Takahiro Iwamoto, Takayuki Nemoto, Masafumi Nakamura, Masafumi Goto, Hiroo Iwata, Masaru Taniguchi, Yohichi Yasunami
- 掲載誌
- Diabetes
- DOI
- 10.2337/db21-0684
補足説明
- *
- Yasunami Y, Nakafusa Y, Nitta N, Nakamura M, Goto M, Ono J, Taniguchi M. A novel subcutaneous site of islet transplantation superior to the liver. Transplantation 102 (6): 945-952, 2018
- **
- 血管再生因子として褥瘡の治療に用いられている薬剤
- ※1 膵島
- 膵臓の中に細胞塊として散在し、インスリンを産生するβ細胞を含有します(図1)。β細胞は血糖値の上昇に反応して血液中へインスリンを放出(分泌)します。
お問い合わせ先
本発表資料のお問い合わせ先
安波洋一
福岡大学名誉教授
本リリースの配信元
福岡大学企画総務部広報課
AMED事業に関するお問い合わせ先
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部再生医療研究開発課