2022-06-07 金沢大学,北海道大学,日本医療研究開発機構
金沢大学ナノ生命科学研究所の奥田覚准教授と北海道大学電子科学研究所の佐藤勝彦准教授の共同研究グループは、立体組織中において細胞がクラスターを作りながら動く物理的な仕組みを解明しました。
人の身体を構成する細胞の一部は、自ら推進力を生み出すことで身体の組織中を移動することができます。しかし、これまでの研究は、培養皿上の平面的な移動や関連する遺伝子についての研究に限られており、立体組織中を細胞が動く仕組みは未解明なままでした。そこで本研究グループは、細胞が動く物理的な仕組みに着目し、独自の科学計算技術を開発することで、立体組織中を細胞が動く仕組みを明らかにしました。まず、「一つ一つの細胞で偏った界面張力(※1)が細胞や細胞塊(クラスター)の移動を引き起こす」という仮説を立てました。そして、独自の科学計算技術を使ってコンピュータシミュレーションを行い、この仮説の妥当性を確かめました。その結果、細胞の偏った界面張力は、細胞と周囲との界面に一方向的な流れを生じることで、細胞や細胞塊(クラスター)が動くための推進力を生み出すことが分かりました。加えて、このコンピュータシミュレーションにより、がん浸潤や胚発生にみられる複数の異なる動きのパターンが再現され、各パターンが生じる物理的な条件が特定されました。
これらの発見は、細胞の動きに対する物理的な理解の重要性を示しており、基礎的な生物学のみならず、がん疾患に対する新しい理解を提供し、次世代の治療薬の開発にも役立つと期待されます。
本研究成果は、2022年5月6日正午(米国東部時間)に米国科学誌『Biophysical Journal』のオンライン版に掲載されました。
研究の背景
人の身体を構成する細胞の一部は、自ら推進力を生み出すことで立体的な組織の中を移動することができます。例えば、がん疾患では、変異した細胞が組織の中を移動することによって他の臓器へ転移します。したがって、立体組織中を細胞が動く仕組みを理解することは、基礎生物学のみならず、がん疾患の理解にも重要な課題でした。
細胞の動きに関わる研究では、疾患や細胞機能に関連する遺伝子の研究が重視されてきました。しかしながら、がん疾患や胚発生にみられる細胞の動きは、多くの異なる遺伝子によって引き起こされます。また、細胞が動く物理的な仕組みに着目した研究では、培養皿上の平面的な移動に関する研究が中心でした。しかし、細胞移動の多くは人の身体を構成する立体的な組織の中で生じます。そのため、立体組織中における細胞移動には、個々の遺伝子によらない物理的な仕組みがあると考えられてきましたが、その仕組みは未解明なままでした。
研究成果の概要
細胞移動の多くは、細胞や細胞外基質(※2)が密に詰まった立体的な組織の内部で生じます。本研究グループは、このような三次元的な細胞移動の仕組みを理解するため、コンピュータを使って多数の細胞の三次元的な動きを予測する、新しいシミュレーション技術を開発しました。このシミュレーション技術により、コンピュータ内のバーチャルな世界で細胞の動きを再現し、その仕組みを予測できるようになりました(図1)。さらに、このコンピュータ内のバーチャルな世界で仮想的な実験を繰り返すことによって、未知であった細胞が動く仕組みを解明しました。
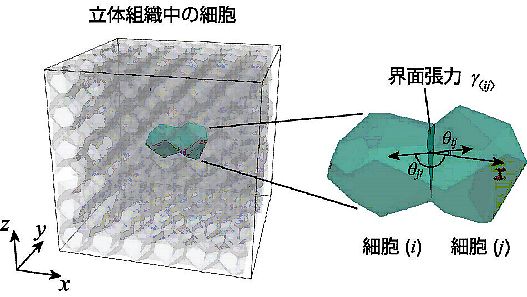
図1 独自開発したシミュレーション技術と数理モデリング
研究の結果、一つ一つの細胞で偏った界面張力が細胞や細胞塊(クラスター)の移動を引き起こすことが分かりました(図2)。また、この細胞移動の過程では、一つ一つの細胞で偏った界面張力は、細胞と周囲との界面に一方向的な流れを生じることで、細胞やクラスターの推進力を生み出していました(図3)。さらに、クラスターが移動する際には、クラスター内部の細胞の相対的な位置が保たれていることが分かりました。
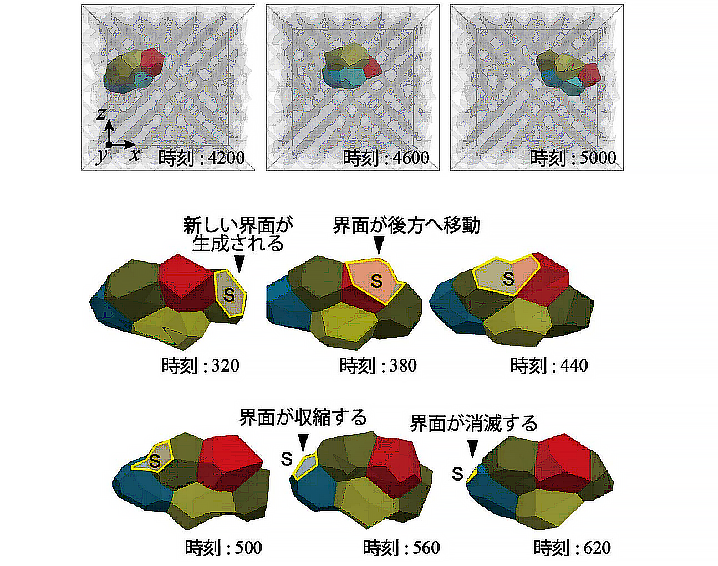
図2 シミュレーションで再現された細胞の動き
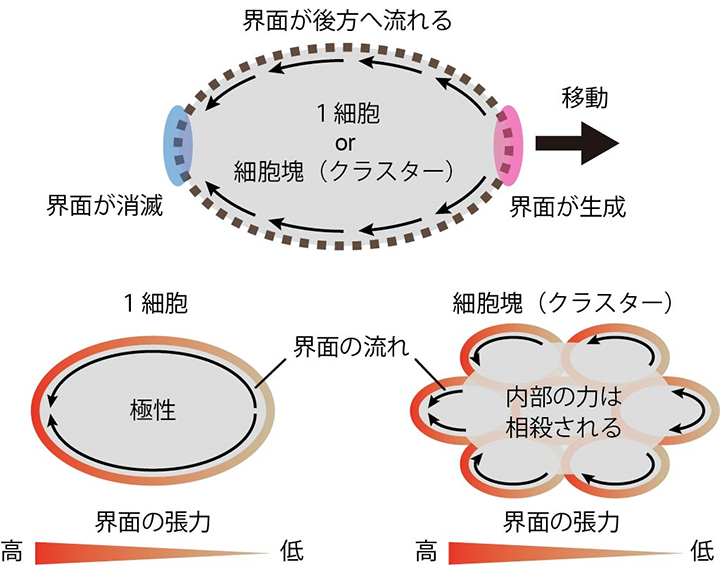
図3 立体組織中における細胞や細胞集団の運動の仕組み
本研究グループが行ったコンピュータシミュレーションにより、がん浸潤や胚発生にみられる複数の異なる動きのパターンが再現され、各パターンが生じる物理的な条件が特定されました(図4)。例えば、複数の細胞がバラバラに移動するパターン、クラスターとなって移動するパターン、数珠状に連なって移動するパターンです。特に、数珠状の移動スピードは、クラスター状のものよりも大きくなっており、がん浸潤の悪性度の高さとも対応します。
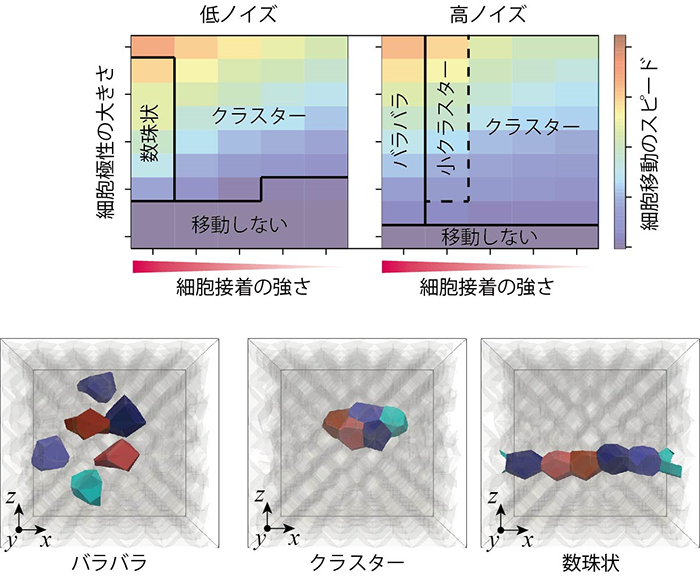
図4 再現された複数の細胞運動パターンとその条件
今後の展開
本研究グループで発見した細胞が動く仕組みは、さまざまな組織や器官の形作りにも共通する可能性があり、基礎生物学における多様な器官の形作りの理解や再生医療の基盤となる器官再生技術の発展につながることが期待されます。さらに、この仕組みは、がん細胞の浸潤過程にも適用できる可能性があり、がん疾患の根本的な理解や新薬の開発にも役立つと考えられます。今後は、発見した細胞が動く仕組みの理解をより深めることで、胚発生やがん浸潤を網羅した体系的な理解を目指します。さらに、独自開発した計算技術と実験技術を組み合わせることにより、胚発生やがん疾患の定量的な理解に挑戦します。
研究支援
本研究は、科学技術振興機構(JST:CREST 研究課題名「力学場と生化学場の相互作用の計測・操作と予測」、研究課題番号JPMJCR1921)、日本医療研究開発機構(AMED:再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)研究課題名「立体組織の形成過程を最適化するモデルベース培養法の開発」、研究課題番号21bm0704065h0001)、日本学術振興会(科研費:21H01209、 20K20958、 20K03871、 18H01135)、北海道大学ソフトマターグローバルステーション、物質・デバイス領域共同研究拠点ダイナミック・アライアンス、上原記念生命科学財団、ブレインサイエンス研究振興財団、文部科学省世界トップレベル研究拠点プログラム(WPI)の一環として行われました。
掲載論文
- 雑誌名
- Biophysical Journal
- 論文名
- Polarized interfacial tension induces collective migration of cells, as a cluster, in a 3D tissue(偏った界面張力は立体組織内で細胞クラスターの集団運動を引き起こす)
- 著者名
- Satoru Okuda,Katsuhiko Sato
(奥田覚、佐藤勝彦) - 掲載日時
- 2022年5月6日正午(米国東部時間)にオンライン版に掲載
- DOI
- 10.1016/j.bpj.2022.04.018
用語解説
- ※1 界面張力
- 二つの相が接する境界面の表面積を減少させようとする力。本研究では細胞とその周囲にある他の細胞や細胞外基質との境界面に働く力。細胞はさまざまな分子の働きによって自身を縮める収縮力や周囲の物質と接着させる接着力を生み出す重要な能力をもつ。特に、運動する細胞は収縮力や接着力を空間的に偏らせることが知られている。この細胞の収縮力や接着力の偏りは界面張力の偏りによって表現できる。
- ※2 細胞外基質
- 組織や臓器の中で細胞外にある線維状の構造物。細胞の物理的な足場となったり、細胞の動きや機能を変えたりする。
本件に関するお問い合わせ先
研究内容に関すること
金沢大学ナノ生命科学研究所 准教授
奥田 覚(おくだ さとる)
北海道大学電子科学研究所 准教授
佐藤 勝彦(さとう かつひこ)
金沢大学ナノ生命科学研究所事務室
米田 洋恵(よねだ ひろえ)
北海道大学社会共創部 広報課
広報・渉外担当
AMED事業に関すること
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム