2022-06-27 大阪公立大学,日本医療研究開発機構
本研究のポイント
- 高脂肪食の長期摂取で腸管バリアが脆弱化し、肝臓に移行・蓄積したグラム陽性腸内細菌叢の細胞壁成分であるリポタイコ酸が肝臓に移行・蓄積。
- 肝臓に蓄積したリポタイコ酸のトル様受容体を介した刺激により、老化肝星細胞※1中のタンパク質・ガスダーミンDが酵素切断され、生じたN末端側の部分が集合して細胞膜上に小孔を形成、その小孔からがんを促進する物質(IL-1β、IL-33を含むSASP因子)が細胞外に放出。
- 放出されたSASP因子のIL-33が、がん細胞に対する免疫を抑制する制御性T細胞※2(Treg細胞)を活性化し、がんの増殖をより促進。
概要
大阪公立大学大学院医学研究科・病態生理学の大谷直子教授、山岸良多助教を中心とするグループは、同肝胆膵病態内科学の河田則文教授、慶應義塾大学先端生命科学研究所の福田真嗣特任教授、広島大学大学院・統合生命科学研究科の中江進教授らと共同で、肝臓に移行した腸内細菌叢の成分であるリポタイコ酸が、肝がん微小環境を変化させてがんの増殖進展を促進するSASP(Senescence-associated secretory phenotype、細胞老化随伴分泌現象)因子を老化肝星細胞から放出させるメカニズムを明らかにしました(概要図参照)。
がんの組織はがん細胞そのものだけでなく、線維芽細胞や免疫細胞など、様々な種類の細胞種が集まって「がん微小環境」を構成しています。進行したがん組織の微小環境ではがん細胞周囲の細胞ががんの増殖を助長していると考えられています。本グループは、脂肪肝を素地とする肝がん微小環境では、肝星細胞と呼ばれる線維芽細胞が細胞老化を引き起こしており、「細胞老化随伴分泌現象(SASP)」という様々な分泌因子を放出する現象が生じ、その分泌因子(SASP因子)ががんの増殖を促進することを以前から見出していました。しかしこれまでにSASP因子の放出メカニズムについては明らかにされていませんでした。
本研究では高脂肪食摂取による肥満誘導性肝がんのマウスモデルを用い、老化肝星細胞の細胞膜上にガスダーミンDというタンパク質が酵素切断されて生じたN末端側の部分(以降GSDMD-Nと略記)が集合して形成される小孔を介して、SASP因子に含まれるサイトカインIL-1βとIL-33が細胞の外部に放出されることを明らかにしました。また、高脂肪食摂取マウスでは、腸管バリアが脆弱化しており、肝臓にグラム陽性腸内細菌の細胞壁成分であるリポタイコ酸が蓄積していました。さらに、蓄積したリポタイコ酸は老化肝星細胞にトル様受容体2(TLR2)を介した刺激を入れ続け、酵素切断で生じたGSDMD-Nによる細胞膜上の小孔形成とそれに続くIL-33やIL-1βの放出を促進していることもわかりました。老化肝星細胞から放出されたIL-33は、その受容体ST2が陽性の制御性T細胞(Treg細胞)に作用し、がんの増殖を促進させることがわかりました。また、GSDMD-NはヒトのNASH(Non-alcoholic steatohepatitis)肝がんの腫瘍部にある肝星細胞でもその存在が認められました。これらの結果から、ガスダーミンDによる小孔形成を阻害する薬剤は肝がんの予防や治療につながる可能性があります。
本研究成果の詳細は、2022年6月25日(土)午前3時(日本時間)に米国科学誌『Science Immunology』(IF = 17.727)電子版に掲載されました。
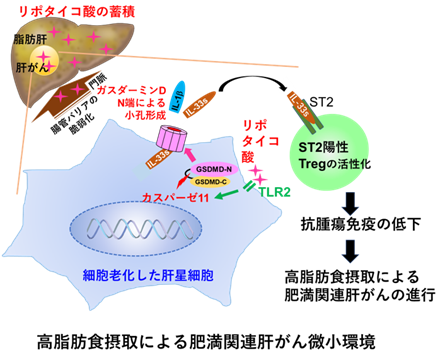
概要図 肝臓に蓄積したリポタイコ酸の肝星細胞膜上のトル様受容体2(TLR2)を介した刺激により、発現したカスパーゼ11がガスダーミンDを切断。生じたGSDMD-Nが集まって細胞膜上に小孔を形成し、その小孔からSASP因子のIL-1βやIL-33が放出される。放出されたIL-33は、その受容体ST2を発現するTreg細胞を活性化する。その結果、抗腫瘍免疫が抑制され、高脂肪食摂取によるNASH肝がんが進行する。
掲載誌情報
- 雑誌名
- Science Immunology(IF = 17.727)
- 論文名
- Gasdermin D-mediated release of IL-33 from senescent hepatic stellate cells promotes obesity-associated hepatocellular carcinoma
- 著者
- Ryota Yamagishi1,23, Fumitaka Kamachi1,2,23, Masaru Nakamura2, Shota Yamazaki2, Tomonori Kamiya1, Masaki Takasugi1, Yi Cheng1, Yoshiki Nonaka3, Yoshimi Yukawa-Muto1,4, Le Thi Thanh Thuy4, Yohsuke Harada5, Tatsuya Arai2, Tze Mun Loo2,6, Shin Yoshimoto6, Tatsuya Ando2, Masahiro Nakajima2, Hayao Taguchi2, Takamasa Ishikawa7, Hisaya Akiba8, Sachiko Miyake8, Masato Kubo9,10, Yoichiro Iwakura11,Shinji Fukuda7,12,13, Wei-Yu Chen14,15, Norifumi Kawada4, Alexander Rudensky16, Susumu Nakae17,18, Eiji Hara19,20,21, and Naoko Ohtani 1,2,22,*
- 所属
-
- 大阪公立大学大学院医学研究科・病態生理学
- 東京理科大学・理工学部・応用生物科学科
- 大阪市立大学大学院医学研究科・病態生理学
- 大阪公立大学大学院医学研究科・病態生理学大阪公立大学大学院医学研究科・肝胆膵病態内科学
- 東京理科大学・薬学部・生命創薬科学科
- 公益財団法人・がん研究会・がん研究所
- 慶應義塾大学・先端生命科学研究所
- 順天堂大学・医学部・免疫学講座
- 東京理科大学・研究推進機構・生命医科学研究所・分子病態学研究部門
- 理化学研究所・生命医科学研究センター・サイトカイン制御研究チーム
- 東京理科大学・研究推進機構・生命医科学研究所・実験動物学研究部門
- 地方独立行政法人・神奈川県立産業技術総合研究所, 腸内環境デザイングループ
- 筑波大学・トランスボーダー 医学研究センター
- Institute for Translational Research in Biomedicine, Kaohsiung Chang Gung Memorial Hospital, Kaohsiung, Taiwan
- Department of Biochemistry and Molecular Biology, College of Medicine, National Cheng Kung University, Tainan, Taiwan.
- Howard Hughes Medical Institute and Immunology Program, Memorial Sloan Kettering Cancer Center, New York, NY, USA
- 広島大学大学院・統合生命科学研究科
- 戦略的創造研究推進事業・さきがけ・生体における微粒子の機能と制御
- 大阪大学・微生物病研究所・遺伝子生物学分野
- 大阪大学免疫学フロンティア研究センター
- 大阪大学感染症総合教育研究拠点
- 革新的先端研究開発支援事業(AMED-CREST)
- equal contributions
- *責任著者
- DOI番号
- 10.1126/sciimmunol.abl7209
研究の背景
がんの組織はがん細胞そのものだけでなく、線維芽細胞や免疫細胞など、様々な種類の細胞種が集まって「がん微小環境」を構成しています。進行したがん組織の微小環境ではがん細胞周囲の細胞が、がんの促進を助長していると考えられています。脂肪肝を素地とする肝がん微小環境では、肝星細胞と呼ばれる線維芽細胞が細胞老化を引き起こしており、「細胞老化随伴分泌現象(senescence-associated secretory phenotype, SASP)」という様々な分泌因子を放出する現象が見られ、その分泌因子(SASP因子)が、がん細胞の増殖を促進することを、研究グループは以前から見出していました(Yoshimoto et al. Nature 2013, Loo et al. Cancer Discovery 2017)。しかしこれまで、SASP因子がどのように放出されるのかは不明であり、放出されたSASP因子がどのようにがんの進行に作用するのかは十分には明らかにされていませんでした。本研究では、近年増加傾向にある脂肪肝を素地とする肝がん(NASH肝がん)のマウスモデルを用いて、老化肝星細胞からのSASP因子の放出メカニズムとSASP因子による抗腫瘍免疫抑制により、がん増殖を進展させるメカニズムについて研究を行いました。
研究の内容
まず、肝がん組織においてどのようなサイトカインが産生されているのか、網羅的遺伝子発現解析により調べたところ、非腫瘍部と比較して腫瘍部ではIL-33が最も高い発現を示し、がん微小環境における老化肝星細胞にIL-33の発現が認められました。IL-33ノックアウトマウスでは肝腫瘍形成が抑制され、野生型マウスにIL-33を投与すると肝腫瘍形成が促進されたことから、肝がん微小環境で高発現するIL-33は肝がんの増殖を促進する作用があると考えられました。またIL-33は同じく老化肝星細胞で発現が上昇するSASP因子、IL-1βに依存して著しく発現が誘導され、CELA-1というエラスターゼで切断され活性化型になることを明らかにしました。
次に、SASP因子であるIL-1βやIL-33が老化肝星細胞からどのように放出されるのか解析を進めました。高脂肪食摂取による肥満マウスの腸内では、グラム陽性腸内細菌が増加しており、肝臓においてはグラム陽性腸内細菌の細胞壁成分であるリポタイコ酸が多く蓄積していることがわかりました(図1)。
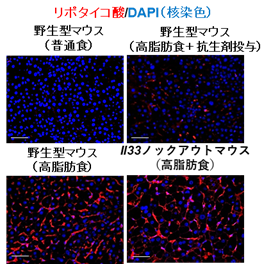
図1 肝臓におけるリポタイコ酸の蓄積。高脂肪食摂取マウスの肝臓に蓄積している。
そこで、この脂肪肝の状態を培養レベルで再現するため、肝臓から単離した老化肝星細胞にリポタイコ酸を添加したところ、SASP因子であるサイトカインIL-1βとIL-33が、細胞外に放出されることがわかりました。また、肝腫瘍部から単離した老化肝星細胞では、ガスダーミンDというタンパク質が高発現しており、リポタイコ酸の添加によりカスパーゼ11により切断されたガスダーミンDの切断体、GSDMD-Nが検出されました。このGSDMD-Nは、細胞膜上に小孔を形成することが知られていますが、ガスダーミンDの発現をノックダウンしたところ、リポタイコ酸によるIL-1βとIL-33の細胞外への放出が抑制されました。このことからSASP因子は、GSDMD-Nで形成される小孔を介して、老化肝星細胞から細胞の外部に放出されることが明らかになりました。GSDMD-Nによる小孔が形成されると、マクロファージなど他の細胞種では、細胞死の一種であるパイロトーシスが促進されることが知られていました。しかし、老化した肝星細胞では、細胞膜上で小孔が形成されても、パイロトーシスはなかなか生じないことがわかりました(図2)。老化肝星細胞でパイロトーシスが生じにくいことは、老化細胞からのSASP因子の放出が続くことを示唆しており、SASP因子の作用が持続するメカニズムのひとつと考えられます。
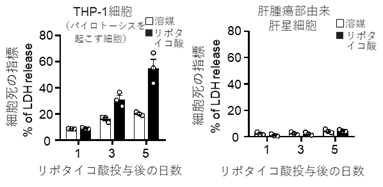
図2 腫瘍部から単離した老化肝星細胞はリポタイコ酸による刺激によってもパイロトーシス(細胞死)をおこしにくい。
また、老化肝星細胞から放出されたIL-33は、その受容体ST2が陽性のTreg細胞に作用して抗腫瘍免疫を抑制し肝がんを進展させることがわかりました。
さらに、ヒトのNASH肝がんの腫瘍部に存在する肝星細胞において、GSDMD-Nの存在がその特異的抗体を用いた組織染色により確認できました。このことから、マウスモデルを用いて得られたこれらの新知見は、ヒトのNASH肝がんの一部においても同様に認められる可能性が示唆されました。最後に、ガスダーミンDによる小孔形成を阻害する薬剤をこの高脂肪食誘導性肝がんモデルマウスに投与したところ、肝腫瘍形成が有意に抑制されました。これらの結果から、ガスダーミンDによる小孔形成を阻害する薬剤は肝がんの予防や治療につながる可能性があります。
今後の展開
上記のポイントで述べたように、以下の3点が本研究の重要な発見です。それぞれのポイントをコントロールすることが脂肪肝を素地とする肝がん進行の抑制につながる可能性があります。
(1)高脂肪食の長期摂取による腸管バリアの脆弱化により、肝臓に移行・蓄積したグラム陽性腸内細菌の細胞壁成分、リポタイコ酸の刺激により、がん微小環境をがん促進の方向性に変化させることが明らかになりました。したがって、腸管バリア機能を改善することが肝がんの予防にもつながる可能性があります。
(2)肝臓に蓄積したリポタイコ酸の刺激により、ガスダーミンDが酵素切断されて生じたGSDMD-Nにより細胞膜上に小孔が形成され、その小孔からSASP因子のIL-1βやIL-33が細胞外に放出されることが明らかになりました。したがって、この小孔形成の阻害は、肝がんの進行を予防できる可能性があります。
(3)肝星細胞から放出されたIL-33はその受容体ST2を発現するTreg細胞に作用し、がんの増殖を促進することが明らかになりました。したがって、ST2受容体の阻害剤や阻害抗体は、肝がんの進行を予防できる可能性があります。
資金情報
本研究は、以下の支援を受けて実施されました。
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明」領域における研究開発課題「腸肝軸を介した腸内細菌叢が関わる肝疾患発症メカニズムの解明とその制御(研究開発代表者:大谷直子)」、
AMED革新的がん医療実用化研究事業「がん微小環境における細胞間ネットワークの制御による新規がん予防・治療法の開発(研究開発代表者:大谷直子)」、
公益財団法人高松宮妃癌研究基金(研究代表者:大谷直子)
公益財団法人武田科学振興財団(研究代表者:大谷直子)
公益財団法人ヤクルト・バイオサイエンス研究財団(研究代表者:大谷直子)
補足説明
- ※1老化肝星細胞
- 肝臓の類洞という血管の壁と肝実質細胞の間に存在する線維芽細胞のこと。強いDNA損傷など様々なストレスが細胞に加わった場合に、不可逆的に細胞周期が停止します。その状態を「細胞老化」と呼びます。この場合は、細胞老化が生じた肝星細胞を老化肝星細胞と表現しました。細胞老化状態になると、しばしば、様々な分泌因子を産生するようになり、この現象を「細胞老化随伴分泌現象」と呼びます。
- ※2制御性T細胞
- 免疫細胞の中でも、免疫反応の司令を出すと言われるヘルパーT細胞の一種。主に胸腺や消化管で発生し、免疫を抑える作用を担っています。過剰な炎症の抑制に必要な細胞ですが、がん組織においては、がん細胞に対する抗腫瘍免疫を抑制し、がん細胞の増殖を促してしまいます。英語では Regulatory T cell の頭文字をとって Treg(Tレグ)細胞とも呼ばれます。
お問い合わせ先
研究内容に関する問い合わせ先
大阪公立大学大学院医学研究科 病態生理学
担当:教授 大谷 直子
報道に関する問い合わせ先
大阪公立大学 広報課
担当:上嶋(かみしま) 健太
AMED事業に関する問い合わせ先
日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課