2022-08-12 国立情報学研究所
一般社団法人 日本病理学会(理事長 小田義直)と大学共同利用機関法人 情報・システム研究機構 国立情報学研究所(NII) (所長 喜連川優)は、日本医療研究開発機構(AMED)の支援の下、東京大学(総長 藤井輝夫)と連携し、胃生検の病理診断を支援する病理診断支援AIを開発しました。これは顕微鏡による超高解像度デジタル画像から異常を検出する画像認識AIで、深層学習の新規開発手法(multi-stage semantic segmentation for pathology 法、MSP法)を採用しました。これにより効果的に腫瘍の有無を判定し、画像上で存在部位を特定することが可能となりました。全国10施設の病理画像を用いた検証の結果、病理医の診断とAI予測の一致率は90~97%に達しました。このAIを病理診断(*1)のダブルチェック(*2)に用いることで、慢性的不足による過重負担の病理医を支援し、さらに遠隔病理診断ネットワーク(*3)に組み入れることでがん医療の均てん化が期待されます。
本研究成果は2022年8月12日に日本癌学会の国際誌「Cancer Science」に掲載されます。
ポイント
- デジタル画像技術、画像認識機械学習を用いて、胃生検(*4)の病理組織画像から腫瘍の有無を判定し、腫瘍の領域を検出する『病理診断支援AI』を開発しました。
- がんの診断確定には病理医による顕微鏡での病理診断が必須ですが、深層学習における新規開発手法を採用したこのAIの診断は、病理医との診断一致率90~97%の精度を達成しました。
- これにより、慢性的に不足する病理医の支援、および遠隔病理診断ネットワークへの活用によってがん医療均てん化(全国どこでも等しく高度な医療を受けられること)の推進が期待されます。
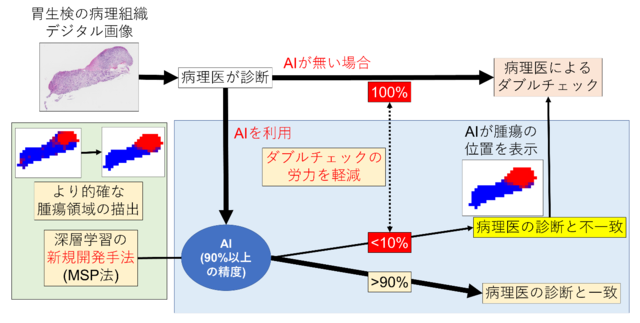
<図1> 病理診断AIの効果
研究の背景
がんの診断確定には病理医による「顕微鏡での病理診断」が必須ですが、日本では病理医が不足し、常勤病理医のいる約700の病院のうち、約300施設では常勤病理医が1名のみです (いわゆる一人病理医)。このような状況下で勤務する病理医は、診断のダブルチェックが困難で、癌の見落とし(あるいは過剰診断)のリスクを抱えながら働いています。
一方、近年のAI技術の進歩は著しく、深層学習、特に畳み込みニューラルネットワーク(*5)は画像識別に優れた能力を発揮し、放射線画像や内視鏡画像等の医用画像分野への応用も進んでいます。ただし、病理診断に用いる顕微鏡画像は高解像度で、病理組織デジタル画像の情報量は桁違いの大きさです。日本病理学会は、AMEDの委託事業としてJapan Pathology AI Diagnostics Project [JP-AID]と名付けた研究開発事業を2017年から開始しました。同年より、NIIもAMED委託事業として医療ビッグデータ利活用を促進するクラウド基盤を整備運用する医療ビッグデータ研究センター(RCMB)を設置しました。そして病理学会とNII RCMBは共同で、東京大学と連携し、日常病理診断で最も頻度の高い検体である胃生検を対象に、病理診断のダブルチェックを行うAIの開発に取り組んできました。このようなAIを開発できれば、一人病理医など過重な業務にあたる病理医の負担軽減、診断向上に役立ち、また遠隔病理診断ネットワークに組み入れることでがん医療の均てん化を促進できると考えたためです。病理医とAIの診断が不一致となり、病理医が再度見直して判断する症例の数を全症例の10%未満に抑えるため、一致率90%以上を開発の目標としました。
研究の内容
開発の出発点として、一つの施設から収集した4605個の胃生検組織片の高倍率顕微鏡画像を、プレパラートの上をレンズが動きながら連続的に撮影する特殊なスキャナーでデジタル化しました。この病理組織デジタル画像を用い、病理医が個々の組織片に対して腫瘍・非腫瘍の範囲を特定して囲んだ学習データを作成し、開発した病理診断AIに学習させました。まず、学習データとは異なる2534個の組織片 (内部データセット) を用い、病理診断AIの性能を確認しました。次に、病理標本の染色の色合いやデジタル化に用いるスキャナーの種類は医療機関ごとに異なるため、全国10施設から計3450個の組織片の病理画像を収集し、外部データセットとしてAIの性能の施設間較差を検証しました。本研究開発に利用したデジタルデータの格納、およびAIの開発に必要な計算処理はRCMBが運用するクラウド基盤で行われました。
病理画像はフルカラーかつ超高解像度であり、胃生検のような数mm程度の小さな組織片であっても画像データ容量は大きいため、組織片の画像そのものを多数、機械学習に用いるとコンピュータの処理能力を容易に越えてしまいます。そこで通常、画像を細かい正方形のパッチ(一辺256ピクセル、116 µm)に分割し、AIモデルの学習や評価に用います。この際、細かいパッチに分割してがんか否かの判定を行うアルゴリズムを使うと、画像全体のうち1か所でも偽陽性のパッチがあると組織片全体が「陽性」と判定されてしまい不安定です。そこで今回、東京大学 先端科学技術研究センター 教授(NII客員教授)の原田達也の研究室が新たに機械学習手法”Multi-stage semantic segmentation for pathology WSI (MSP)”法を開発しました。MSP法では個々のパッチ画像から特徴量を抽出し、元の病理画像における特徴量の分布も学習するため、病理画像を大幅に圧縮した形で、画像全体におけるパッチの位置情報を失うことなく機械学習を行うことができます。あたかも病理医が顕微鏡の低倍率での俯瞰的把握と、高倍率での詳細な観察を組み合わせて病理診断を下すことを模倣しているかのような方法です。MSP法を用いた場合、従来法で偽陽性を示すパッチが散在する非癌症例であっても、正しく全体を非癌と判定することができました(図2)。
<図2> 新規開発手法(MSP法)による偽陽性の削減
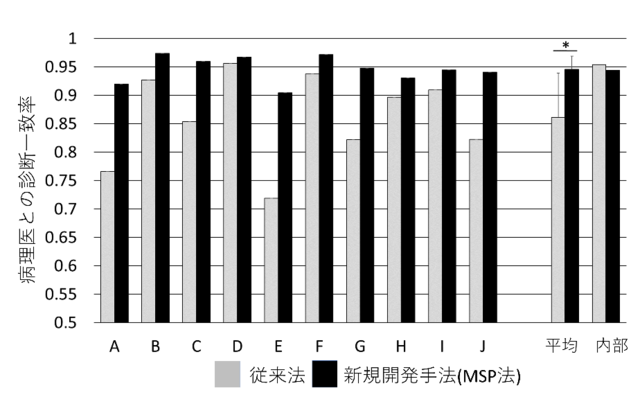
癌と非腫瘍の判定で、MSP法は病理医の診断との一致率94.8%(内部データセット)を達成しました。また10施設の外部データセットでも94.6%±2.3% (最小90.4%、最大97.4%)となり、従来法より優れた成績が得られました(図3)。MSP法は多施設に適用した場合に施設間較差の影響を受けにくく、安定した手法であることが実証されました。
<図3> 多施設検証における病理診断とAI判定の一致率
社会的意義
今回開発されたAIを病理診断の現場で用いることにより、病理診断のダブルチェックを支援し、一人病理医を初めとする多忙な病理医の負担軽減に繋がり、がん医療を確実なものにすることができます。さらに遠隔病理診断ネットワークに組み入れることでがん医療均てん化の推進が期待されます。
今後の方向性
医療現場に病理診断支援AIを導入するため、プログラム医療機器としての薬事承認取得を目指しています。同時に胃生検以外の病理診断支援AIも開発中です。また、JP-AID事業で収集された種々の臓器の病理組織デジタル画像をAI開発に用いることができるように、「日本病理学会デジタル画像データベース」として公開する準備を進めています。
研究参加病理診断科施設(大学・医療機関名)
東京大学、秋田大学、金沢医科大学、浜松医科大学、奈良県立医科大学、京都大学、大阪警察病院、徳島大学、広島大学、産業医科大学、熊本医療センター
研究費
本研究は、日本医療研究開発機構(AMED) 臨床研究等ICT基盤構築・人工知能実装研究事業「AI等の利活用を見据えた病理組織デジタル画像(WSI)の収集基盤整備と病理支援システム開発」(課題番号:JP16lk1010022)(研究代表者:深山正久),日本医療研究開発機構(AMED) 臨床研究等ICT基盤構築・人工知能実装研究事業「病理診断支援のための人工知能(病理診断支援AI)開発と統合的『AI医療画像知』の創出」(課題番号:JP18lk1010027)(研究代表者:北川昌伸) 、日本医療研究開発機構(AMED) 臨床研究等ICT基盤構築・人工知能実装研究事業「医療ビッグデータ利活用を促進するクラウド基盤・AI 画像解析に関する研究」(課題番号:JP18lk1010028・JP19lk1010036)(研究代表者:合田憲人)の支援を受けました。
論文情報
掲載誌:Cancer Science
論文タイトル:Development and multi-institutional validation of an artificial intelligence-based diagnostic system for gastric biopsy
著者:Abe H, Kurose Y, Takahama S, Kume A, Nishida S, Fukasawa M, Yasunaga Y, Ushiku T, Ninomiya Y, Yoshizawa A, Murao K, Sato S, Kitsuregawa M, Harada T, Kitagawa M, Fukayama M, Japan Pathology AI Diagnostics/ National Institution of Informatics (JP-AID/NII) Study Group for gastric biopsy pathology
発表日:2022年8月12日(予定)
DOI: https://doi.org/10.1111/cas.15514
(*1) 病理診断:手術や生検などで採取した組織を薄く切り、染色した後に顕微鏡で観察し、細胞や組織の形態から病気を診断する医療行為。病理医が行い、これによってがんであるかどうかの診断が確定する。
(*2) 病理診断のダブルチェック:病理医が行った診断について、他の病理医が診断に誤りがないかどうか再度顕微鏡でチェックし確認すること。
(*3) 遠隔病理診断ネットワーク:病理医が勤務していない医療機関の病理標本を、特殊なスキャナーでデジタル画像化し、インターネットを介して病理医が勤務する医療機関に送信することで、病理診断を受ける仕組み
(*4) 胃生検:内視鏡で胃の中を観察し、病変が疑われる部分の粘膜から数mmの大きさの組織を採取すること。
(*5) 畳み込みニューラルネットワーク:AI開発に用いられる深層学習の手法の一種で、画像認識に優れた性能を発揮する。