2022-08-22 量子科学技術研究開発機構
発表のポイント
- ゲノム編集技術1)によってヒトの遺伝性乳がんの原因遺伝子(BRCA12))の変異を導入したラットを作製した。
- このラットでは、高線量の放射線によってDNA損傷を増加させると、遺伝子変異が無いラットに比べて乳がんが出やすくなった。
- ヒトに近い病態を示すこのラットを用いることにより、遺伝性乳がんが発症しやすくなる仕組みの解明、及び予防法の開発に繋がることが期待される。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門 放射線医学研究所 放射線影響研究部の今岡達彦グループリーダーらは、東京大学医科学研究所先進動物ゲノム研究分野の真下知士教授、東京都立大学大学院人間健康科学研究科 井上一雅教授、順天堂大学大学院医学研究科臨床遺伝学 新井正美教授、乳腺腫瘍学 齊藤 光江教授らとの共同研究で、遺伝性乳がんの新しい動物モデルの作製に成功しました。
乳がん全体のうち5~10%は、遺伝性乳がん・卵巣がん症候群3)によるものとされています。この症候群に関わる遺伝子の一つが、BRCA1です。この遺伝子は、細胞内のDNAに生じたDNA二重鎖切断4)の修復を担い、両親のどちらかから変異を受け継いでいる人は数百人に1人という頻度で存在します。この遺伝子の変異があると、変異が無い場合に比べ、乳がんや卵巣がんを発症するリスクが若年から高くなり、生涯の発症確率も非常に高くなります。
この症候群の予防法を研究するためには、ヒトの病態を再現する動物モデルが必要です。これまで、この遺伝子に変異を持つマウスのモデルの作製が多く試みられてきました。しかし、乳がんになりやすい性質を再現するためには、この遺伝子に加えて他の遺伝子に変異を併せ持たせるか、両親から受け継いだBRCA1遺伝子を両方とも破壊することが必要でした。このように、これらのモデルは、ヒトの遺伝性乳がんとは異なる点がありました。
本研究グループは、放射線被ばくによる乳がんリスクの研究のために、何の処理をしなくても自然にある程度乳がんを発症する、特定の系統のラットを用いていました。これはヒトの状況と近いことから、このラットを用いることにより遺伝性乳がんを再現できるのではないかとの着想を得ました。
そこでゲノム編集技術を用いて、ラットにおける同じ遺伝子に、日本人に比較的多いタイプの変異を導入しました。こうして作製したラットに対して、高線量の放射線を照射した場合、乳がんの発生が、変異を持たないラットよりも有意に増加することが明らかになりました。誘発される乳がんには卵巣ホルモン受容体5)が少なく、これは、この遺伝子に変異を持つ乳がん患者に見られる特徴と類似していました。このようにヒトに近い病態を示す遺伝性乳がんモデルの作製に、世界で初めて成功しました。
これまでのモデルよりもヒトに近い病態を示す本モデルラットを用いて、遺伝性乳がんの発生の仕組みを解明することにより、遺伝性乳がんの予防法の開発に繋がることが期待されます。
この成果は、がん研究分野の論文が数多く発表されている日本癌学会の国際誌「Cancer Science」に2022年8月22日(月)午前10時(日本時間)にオンライン掲載されます。本研究は、JSPS科研費(JP26550036, JP15H02824, JP21H03601)の助成を一部受けています。
研究開発の背景と目的
BRCA1遺伝子の変異を両親のどちらかから受け継ぐことは、遺伝性乳がん・卵巣がん症候群の原因となります。この変異があると、変異が無い場合に比べて、乳がんや卵巣がんを発症するリスクが若年から高くなり、生涯の発症確率も非常に高くなります。たとえば乳がんの発症確率は、日本人女性では通常40歳以降から上昇し始め、85歳までに9%程度の女性が発症しますが、BRCA1変異があると発症確率は20代から上昇し、85歳までに70%以上の女性が発症するという推計があります(JAMA Oncol 2022; 8(6): 871–878)。
BRCA1は、DNA二重鎖切断の相同組換え修復と呼ばれる修復機構に関与するタンパク質をコードしています。DNAの切断を正確に直すことができないと、様々な遺伝子変異が生じて、がんにつながる可能性があります。放射線はDNA二重鎖切断を誘発することが知られており、過去に、BRCA1等の変異を有する女性を対象として、診断用の低線量放射線(胸部X線、マンモグラフィーなど)と乳がんリスクの関連が調査されています。診断用放射線を受けたことがあると報告した人ほど乳がんリスクが高かったという結果もありますが、別の報告では異なる結果が示されており、決着は付いていません。
この病気の予防法を研究するためには、ヒトの病態を再現する動物モデルが必要です。そのため、BRCA1に相当するマウスの遺伝子(マウスやラットではBrca1と表記されます)に変異を導入したモデルは、これまでに世界で10種類以上開発されています。
しかし、変異を両親のどちらかから受け継いだマウス(Brca1+/-)は、ヒトとは異なり、乳がんを発生しやすい性質を示しません。この性質を再現するためには、さらに別の遺伝子(具体的にはTrp53遺伝子。細胞のDNAが損傷されると活性化して、修復遺伝子を誘導したり、修復しきれない場合は細胞死を誘導したりする)にも変異を持たせることが必要です。また、Brca1変異を両親から受け継がせたマウス(Brca1-/-)は胎児期に死んでしまい生まれてくることができませんが、乳腺に含まれる細胞でのみ両親からのBrca1を破壊すると、マウスは生まれてくることができ、乳がんを発生しやすい性質を示します。
このようにしてBrca1遺伝子に変異を導入したマウスが開発され、Brca1変異による遺伝性乳がんのモデルとして使用されています。しかし、これらのモデルは、BRCA1に一つの変異をもつ(BRCA1+/-)状態から発生するヒトの遺伝性乳がんの初期段階を再現していない可能性があります。そこで研究グループでは、ヒトの場合と同様に、Brca1+/-の状態で乳がんを発生しやすくなる動物モデルの作製を試みました(図1)。
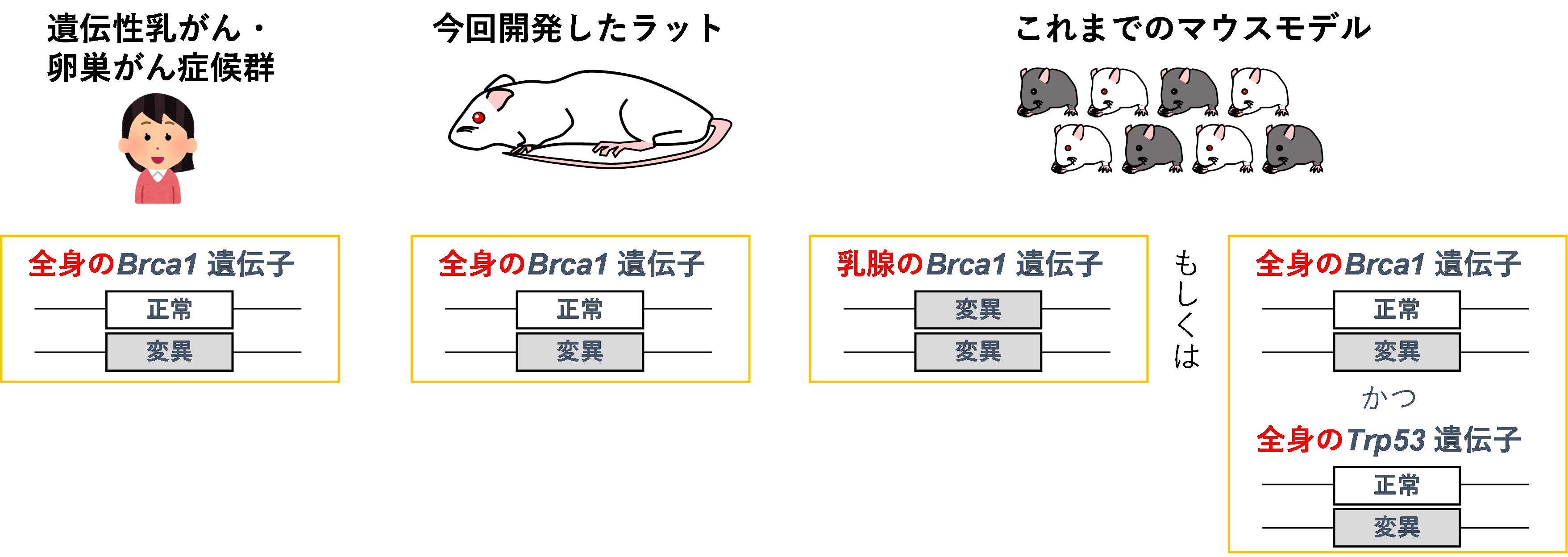
図1 遺伝性乳がん・卵巣がん症候群のヒトと、これまでのマウスモデルの遺伝子の比較
研究の手法と成果
研究グループは、放射線が乳がんリスクに及ぼす影響を調べる研究に特定の系統のラットを用いてきました。その理由は、このラットには、乳がんを発生しやすい性質があり、高線量の放射線を照射するとそれが顕著に促進されるためです。一方、遺伝子改変マウスの作製によく用いられるマウス系統は、必ずしも乳がんを発生しやすい性質を持っていません。また、このラットの乳がんは、組織の形態がマウスのものよりも、ヒトのものに近いことが知られています。
そこで、ゲノム編集技術を使用して、Brca1遺伝子に変異を導入したBrca1+/-ラットを作製しました。導入した変異は、日本人の遺伝性乳がんにおいて、比較的多く見られるL63X変異(第63コドンのロイシンから終止コドンへの変異)と同じ変異です。
その結果、Brca1+/-の個体は、乳がんの発生率も含め、一見すると正常に発生することがわかりました(図2左)。そこで、Brca1+/-ラットとBrca1が正常なラットに対して、(DNA二重鎖切断を発生させる刺激の代表である)放射線(ガンマ線)を照射する実験と、(DNA二重鎖切断以外の機構でDNAを損傷させる刺激の代表として)メチルニトロソ尿素6)という化学物質を投与する実験を行いました。
メチルニトロソ尿素(25mg/kg)を投与した場合、Brca1+/-ラットとBrca1が正常なラットでは乳がんの出やすさに有意な差はありませんでした(図2中央)。高線量(2グレイ7))の放射線を照射した場合、Brca1+/-ラットはBrca1が正常なラットに比べて乳がんの発症が増加しました(図2右)。また、無処理あるいは高線量の放射線を照射したBrca1+/-ラットに発生した乳がんでは、BRCA1+/-の女性に発生する乳がんに多いタイプと同じように、卵巣ホルモン受容体が少ないという特徴が見られました。このように、動物種としてラットを選んだこととDNA損傷刺激として放射線を用いたことにより、これまでよりもヒトの病態に近いモデルを作製することに成功しました。
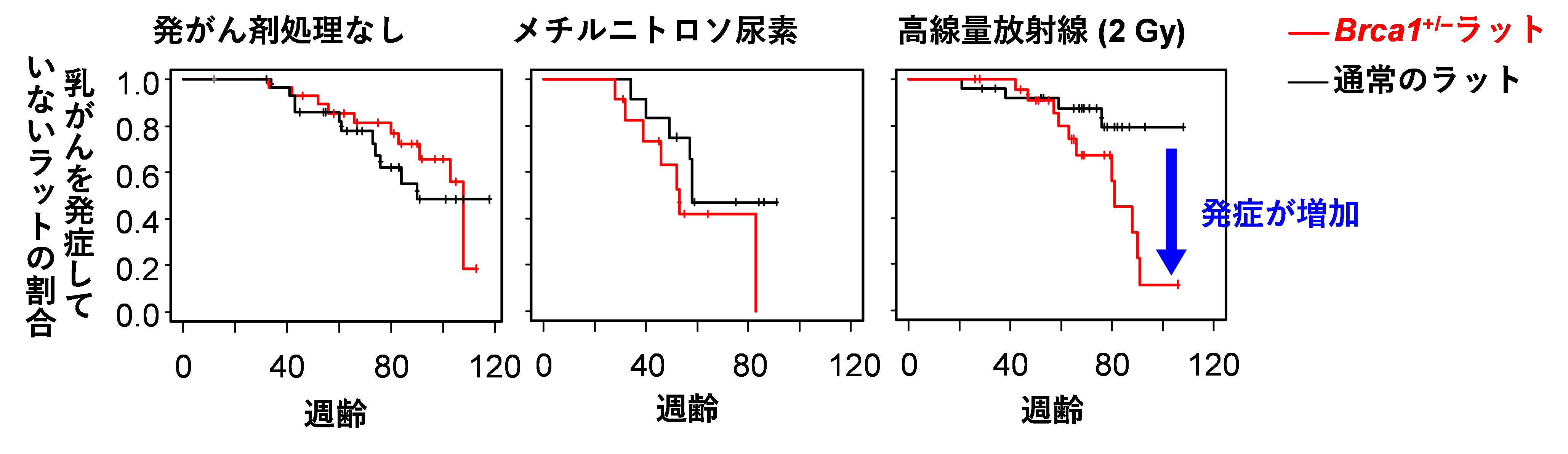
図2 発がん剤処理を行わないあるいは行ったBrca1+/-ラット及び通常のラットにおける乳がん発生の経過
Brca1+/-ラットでは、高線量の放射線を照射しない場合は乳がんが発生しやすくはなりませんでした。このことから、ヒトにおいては何らかの要因によってたくさんのDNA二重鎖切断が生じており、変異を持たない場合はDNAが修復できますが、BRCA1変異を持つとDNAがうまく修復できないため、遺伝性乳がんの発生が促進される可能性が示唆されます。
本研究では、0.1グレイという低線量の放射線を照射した場合についても実験を行いましたが、Brca1+/-ラットとBrca1が正常なラットとで、乳がんの出やすさは有意には違いませんでした。この結果からは、低線量の被ばくでも、BRCA1変異をもっていると乳がんのリスクが高くなるという疫学研究の結果を注意深く受け止める必要があると考えられます。
注)0.1グレイの被ばくは100ミリシーベルトに相当します。
今後の展開
本成果は、BRCA1変異によって乳がんの発生率が高くなる仕組みの解明に役立つことが期待されます。我々の今後の目標は、この動物モデルを用いて、BRCA1変異により乳がんの発生率が高まる仕組みを理解することです。その仕組みに介入することによって、BRCA1変異による乳がんの発生を予防する方法の開発を目指します。
用語解説
1)ゲノム編集技術
生物のゲノム上の特定の塩基配列を狙った通りに変化させる技術。本研究では(クリスパー・キャスナイン)と呼ばれる方法を用いました。
2)BRCA1(マウスやラットではBrca1と表記)
BRCA1タンパク質は、細胞内でDNAに生じた切断を修復することに関わっている中心的タンパク質の一つ。このタンパク質をコードする遺伝子の変異が、家族性乳がんの家系において乳がんの原因となっていることがわかったことから、乳がん(breast cancer)にちなんでこのように命名されました。BRCA1を両親から受け継いだ場合、その受精卵は発生できないため、BRCA1-/-の人は基本的にはいません。Brca1-/-のラットやマウスも同様です。
3)遺伝性乳がん・卵巣がん症候群
BRCA1 あるいはBRCA2 の変異を受け継いだことによって乳がん、卵巣がんをはじめとするがんに罹患しやすくなる症候群。
4)DNA二重鎖切断
二本鎖が完全に分断されること。は二本の鎖でできており、片方が損傷されても残りを元に完全に修復することができる。しかし、二重鎖切断は両方の鎖が損傷されており、完全に修復できるとは限らない。
5)卵巣ホルモン受容体
正常な乳腺細胞の増殖は、エストロゲン等の卵巣ホルモンによって調節されています。乳がんには、卵巣ホルモンの受容体を強く発現して、これらのホルモンに依存して増殖するものと、卵巣ホルモンの受容体をあまり持たず、これらのホルモンとは関係なく増殖するものがあります。遺伝子に変異をもつ乳がん患者では、後者である場合が多いことが知られています。
6)メチルニトロソ尿素
メチルニトロソ尿素は、の塩基にメチル基を付加することで変異を起こす物質。実験動物を用いたがん研究でよく使用されます。
7)グレイ
物に吸収される放射線の量を表す物理的な量。1グレイ(Gy)=1000ミリグレイ(mGy)。人体のガンマ線全身均等被ばくの場合は、1グレイは1シーベルトと同じです。シーベルトは人体への被ばくの影響の大きさの目安となるように調整された量の単位であり、放射線影響の研究ではグレイを用いるのが普通です。
論文情報
タイトル:Brca1L63X/+ rat is a novel model of human BRCA1 deficiency displaying susceptibility to radiation-induced mammary cancer
著者:Yuzuki Nakamura1,2*, Jo Kubota1,2*, Yukiko Nishimura1, Kento Nagata1, Mayumi Nishimura1, Kazuhiro Daino1, Atsuko Ishikawa1, Takehito Kaneko3,4, Tomoji Mashimo4,5, Toshiaki Kokubo6, Masaru Takabatake1,2, Kazumasa Inoue2, Masahiro Fukushi2, Masami Arai7, Mitsue Saito8, Yoshiya Shimada1,2, Shizuko Kakinuma1,2, Tatsuhiko Imaoka1,2 (*YNa and JK contributed equally to this work.)
所属:
1. Department of Radiation Effects Research, National Institute of Radiological Sciences, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba, Japan
2. Department of Radiological Sciences, Graduate School of Human Health Sciences, Tokyo Metropolitan University, Tokyo, Japan
3. Division of Fundamental and Applied Sciences, Graduate School of Science and Engineering, Iwate University, Japan
4. Institute of Laboratory Animals, Graduate School of Medicine, Kyoto University, Kyoto, Japan
5. Laboratory Animal Research Center, Institute of Medical Science, The University of Tokyo, Tokyo, Japan
6. Laboratory Animal and Genome Sciences Section, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba, Japan
7. Department of Clinical Genetics, Graduate School of Medicine, Juntendo University, Tokyo, Japan
8. Department of Breast Oncology, Graduate School of Medicine, Juntendo University, Tokyo, Japan
DOI: 10.1111/cas.15485