2022-11-16 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞由来腎前駆細胞注1を培養する際に、適切なiPS細胞のマーカーとしてMIR302CHG 注2を同定した。
- MIR302CHGを用いて、細胞製品中の未分化iPS細胞を高感度に検出する方法を開発した。
- ヒトiPS細胞由来の細胞を用いた治療の安全性をより一層確保できる。
1. 要旨
辻本 啓 共同研究員(京都大学CiRA増殖分化機構研究部門/リジェネフロ株式会社)、長船 健二 教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、大量の腎前駆細胞中にわずかに残存する未分化iPS細胞を検出できる方法を開発しました。
ヒトiPS細胞由来腎前駆細胞を用いた細胞療法は、急性腎障害(acute kidney injury; AKI)を改善すること、また慢性腎臓病(chronic kidney disease; CKD)の病態進行を抑制することが期待されています。細胞療法では、細胞製品中への未分化なiPS細胞の残存による安全性への影響があってはならず、その保証のための検出方法が必要になります。
本研究では、まず最初に、公開されているヒトiPS細胞由来細胞の遺伝子発現データを再解析しました。その結果、iPS細胞を検出するためのマーカーとして既に報告されているLIN28A, ESRG, CNMD, SFRP2はヒトiPS細胞由来の腎前駆細胞や他のいくつかの細胞種の分化過程において発現がみられることから、これらの細胞の分化誘導時には、残存iPS細胞の検出に適したマーカーとならないことがわかりました。
そこで研究グループは、RNAシークエンス解析注3と定量PCR法により、多くのiPS細胞のマーカーの中から、ヒトiPS細胞と腎前駆細胞で極端に発現量の異なる長鎖ノンコーディングRNA注4のMIR302CHGを見いだしました。MIR302CHGを未分化なiPS細胞のマーカーとして、磁気ビーズと磁気カラムによるiPS細胞の濃縮と定量PCRを組み合わせる方法と、デジタルドロップレットPCR注5のみを用いる方法の2つ検査方法を構築し、いずれの方法においても大量の腎前駆細胞中にわずかに残存するiPS細胞を検出できることを示しました。これらのアッセイを用いることでヒトiPS細胞由来の細胞を用いた治療の安全性に寄与することが期待されます。
この研究成果は、2022年11月16日に米科学誌「PLOS ONE」で公開されました。
2. 研究の背景
現在、末期腎不全の患者さんには、腎臓の機能を回復させる腎臓移植が唯一の根治的治療法となっています。しかし、提供される腎臓が不足しているため、再生医療が待ち望まれています。最近、ヒト胎児由来の腎前駆細胞が慢性腎臓病(chronic kidney disease; CKD)の治療に有効であること、ヒトiPS細胞由来の腎前駆細胞がマウスにおけるAKIを改善することが相次いで報告されています。
しかし、iPS細胞は様々な組織に分化する性質に加え、無限に増殖する性質があるため、細胞療法に用いる腎前駆細胞の製品中に、原料である未分化なiPS細胞が残存していた場合、腫瘍を形成するリスクがあります。iPS細胞の混入や残存を避けるには、厳重に管理された細胞製造工程に加えて、微量のiPS細胞を検出するための検査方法が必要です。
また、iPS細胞由来の腎前駆細胞の臨床応用には、多くの量の細胞が必要となるという課題もあります。マウスでの細胞移植実験で得られた結果からヒトの投与量を算定すると、億単位の細胞が必要となります。残存するiPS細胞の割合が少ない場合でも、ヒトに投与する際の細胞の絶対数としては多くなるため、腫瘍形成のリスクが高まります。そのため、未分化なiPS細胞の残存や混入を高感度で検査するための方法が必要となります。
そこで、研究グループは、既知および未知の多数のiPS細胞のマーカーの中から、腎前駆細胞の分化誘導における残存iPS細胞の検出に適したマーカーとしてMIR302CHGを見出し、iPS細胞由来の腎前駆細胞中の微量のiPS細胞を検出できる検査方法を開発しました。
3. 研究結果
1)既知および未知の多くのiPS細胞のマーカーの中から、残存iPS細胞の検出に適したマーカーとしてMIR302CHGを発見した。
研究グループはまず、iPS細胞由来の腎前駆細胞およびiPS細胞それぞれに対してRNAシークエンス解析を行い、残存iPS細胞の検出に適したマーカー候補を選別しました(図1)。
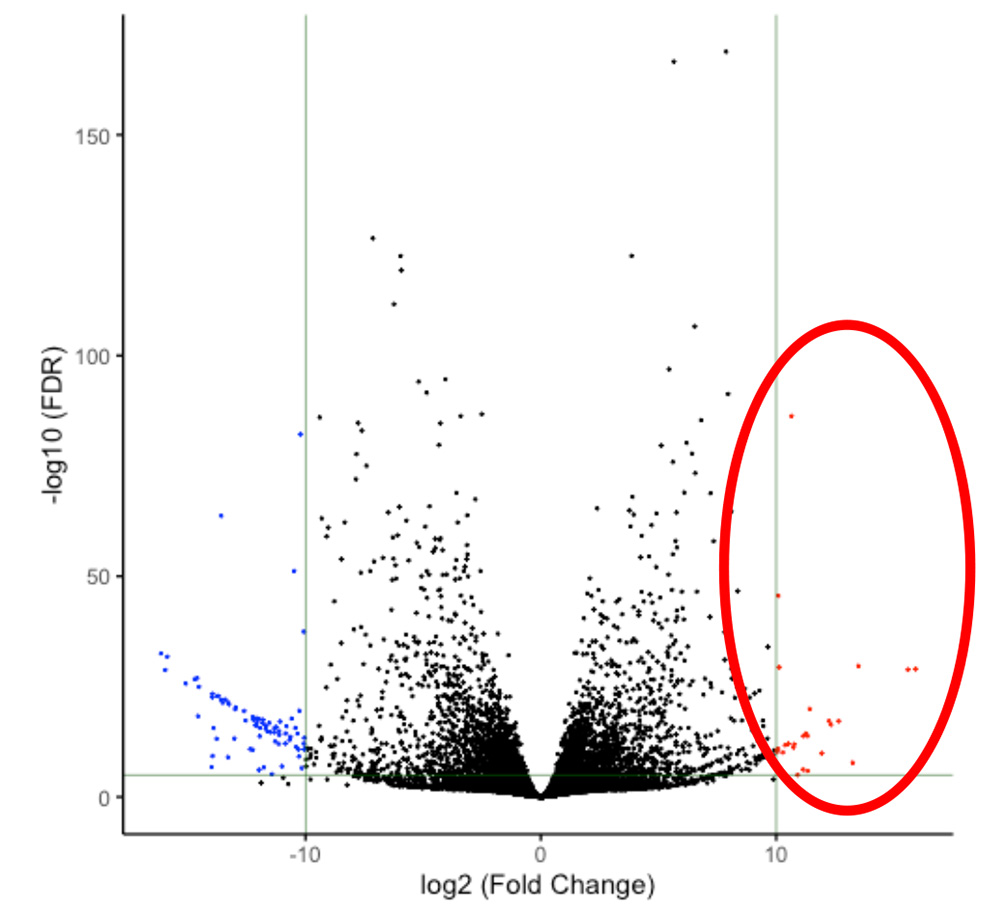
図1 RNAシークエンス解析によりiPS細胞で極端に高い発現値を示す遺伝子候補を選別した。
2)磁気ビーズを用いた濃縮後に定量PCRを行う高感度な検査方法を開発した。
次に、大量の腎前駆細胞と少数のiPS細胞(0.0001%)で構成される細胞混合物(10-4% iPSC)を用意し、iPS細胞に特異的な抗TRA-1-60抗体結合磁気ビーズと磁気カラムを用いてiPS細胞を濃縮し、磁気ビーズの陽性画分(PF)を用いて定量PCR解析を行いました。
その結果、磁気ビーズ処理していない腎前駆細胞単独(NPC)と比較して、MIR302CHGの遺伝子発現をハウスキーピング遺伝子であるTBPの発現で標準化したMIR302CHG/TBPの著しい増加を確認しました(図2)。また、腎前駆細胞を単独で磁気ビーズ処理した場合、陽性画分ではMIR302CHG/TBPの発現値が検出レベル以下になることを確認しました。
この結果から、抗TRA-1-60抗体結合磁気ビーズと磁気カラムを用いた濃縮後のMIR302CHGの定量PCRにより、高感度なiPS細胞の検出(腎前駆細胞中0.0001%のiPS細胞)が可能であることを確認しました。
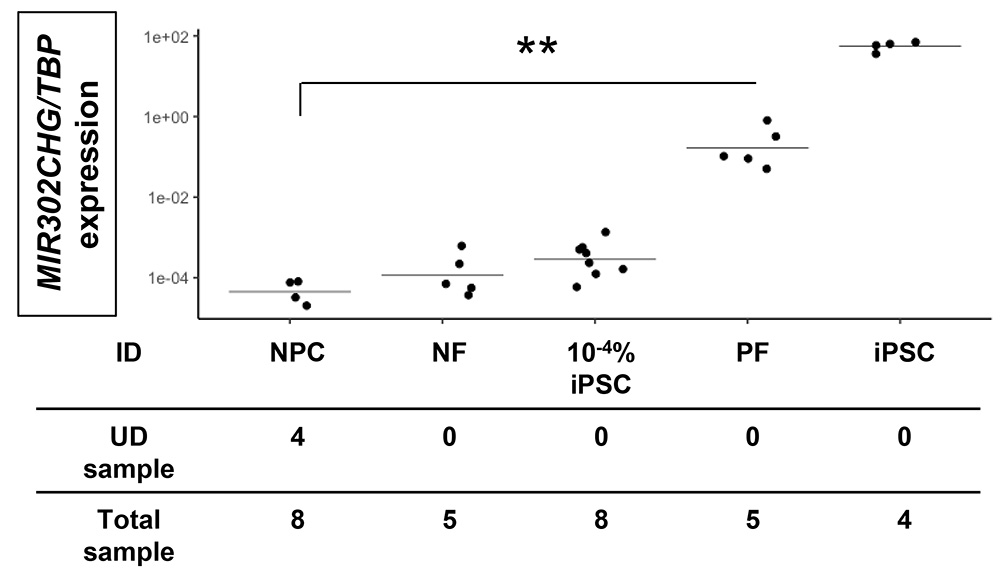
図2 磁気ビーズによる濃縮はごく少量のiPS細胞の定量PCRによる検出を可能にする。
3)MIR302CHGをデジタルドロップレットPCRで定量することで、高感度なアッセイを開発した。
磁気ビーズと磁気カラムによる濃縮は感度が向上する一方で、細胞回収当日に濃縮を行う必要があります。そこで、安定的に凍結保存できるcDNAのみを用いた検査方法も開発しました。研究グループは、高精度のPCR法の一つであるデジタルドロップレットPCR法を検討し、温度や濃度等の条件の最適化を行いました。その結果、磁気ビーズによる濃縮を行わずに、腎前駆細胞とごく少数のiPS細胞(0.001%)の細胞混合物からiPS細胞を検出できる方法の開発に成功しました。
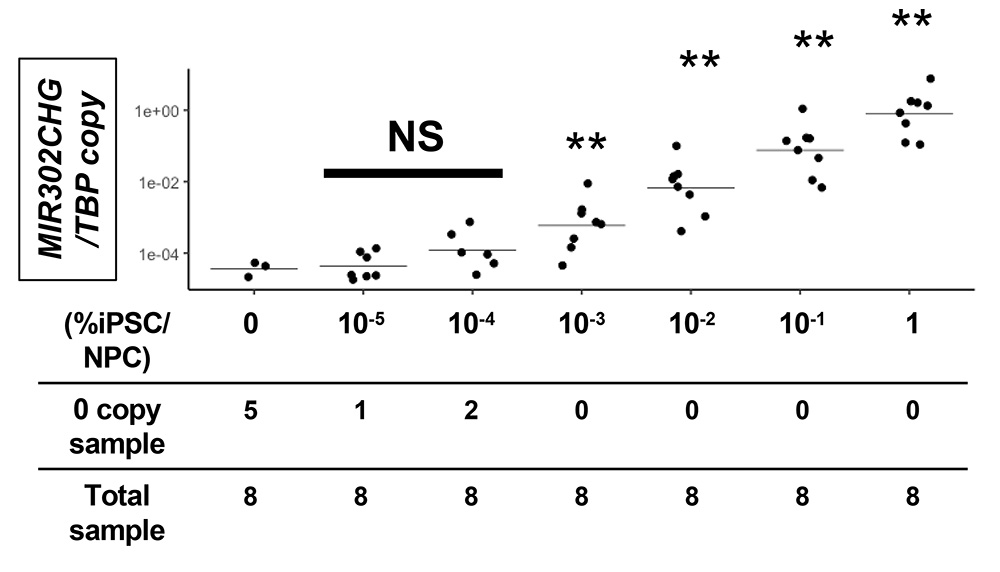
図3 デジタルドロップレットPCRよる高精度な検査はごく少量のiPS細胞の検出を可能にする。
4. まとめ
研究グループは、ヒトiPS細胞由来腎前駆細胞の培養内のヒトiPS細胞を検出するための既知および未知の多くのiPS細胞のマーカーの中から、適切なiPS細胞マーカーとして、MIR302CHGを同定し、残存する未分化なiPS細胞の存在を確認するためにMIR302CHGを用いた高感度な検査方法を開発しました。
これにより、将来、ヒトiPS細胞由来細胞を用いた移植治療のさらなる安全性を確保し、患者さんが安心して受けることのできる治療の実現に繋がることを期待しています。
5. 論文名と著者
- 論文名
In vitro methods to ensure absence of residual undifferentiated human induced pluripotent stem cells intermingled in induced nephron progenitor cells - ジャーナル名
PLOS ONE - 著者
Hiraku Tsujimoto1,2,†, Naoko Katagiri1,2, Yoshihiro Ijiri1,2, Ben Sasaki1, Yoshifumi Kobayashi2, Akira Mima2, Makoto Ryosaka1,2, Kenichiro Furuyama1, Yoshiya Kawaguchi1, Kenji Osafune1,†
† 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- リジェネフロ株式会社
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)の「再生医療実用化研究事業」
- リジェネフロ株式会社
7. 用語説明
注1)腎前駆細胞
ヒトやマウスでは発生期の腎臓にのみ存在し、糸球体と尿細管に分化することによって腎臓の機能の最小単位であるネフロンをつくる前駆細胞のこと。
注2) MIR302CHG
多能性の制御に関与していることが知られているマイクロRNAのグループをコードする長鎖ノンコーディングRNA注4遺伝子。
注3) RNAシーケンシング解析
高速シーケンサーを用いてRNA のシーケンシング(配列情報の決定)を行い、細胞内で発現するトランスクリプトーム(細胞内の全転写産物・全RNA)の定量を行う解析方法。
注4) 長鎖ノンコーディングRNA
タンパク質をコードしないノンコーディングRNAの一種で、一般に約100-200塩基以上のものを指す。生体内の多様なプロセスに関与することが知られている。
注5) デジタルドロップレットPCR
検体サンプルを約2万個のドロップレット区画に分配し、そこで独立してPCR増幅を行い、増幅されたドロップレット区画と、増幅されなかったドロップレット区画を直接カウントすることにより、元の検体サンプル中の低濃度のPCR鋳型のコピー数を高い精度で推定することができる。