2022-11-14 東京大学
- 発表者
- 勝間 進 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 教授)
廣田 加奈子 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 博士課程)
松田 典子 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 特任研究員)
福井 崇弘 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 博士課程)
室 智大 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 博士課程)
西野 耕平 (徳島大学先端酵素学研究所藤井節郎記念医科学センター 特任技術員)
小迫 英尊 (徳島大学先端酵素学研究所藤井節郎記念医科学センター 教授)
庄司 佳祐 (東京大学定量生命科学研究所 助教)
高梨 秀樹 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 助教)
藤井 毅 (摂南大学農学部農業生産学科 講師)
有村 慎一 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 准教授)
木内 隆史 (東京大学大学院農学生命科学研究科生産・環境生物学専攻 准教授)
発表のポイント
- チョウやガに共生する細菌ボルバキアが宿主のオスだけを狙って殺すことができるメカニズムとその原因となるタンパク質を初めて明らかにしました。
- ボルバキアがオスだけを殺すメカニズムが明らかになったことで、オス殺しを誘導するタンパク質を利用したチョウ目昆虫の性操作技術の開発が期待できます。
発表概要
微生物の中には、自己の利益のために宿主を様々な方法で操作するものが存在します。共生細菌であるボルバキア(注1)はその1つであり、宿主の性決定や生殖のシステムを操作することで次世代への感染拡大を図っていると考えられています。チョウやガの仲間(チョウ目昆虫)では、ボルバキアの共生によってオスのみが致死する「オス殺し」現象が知られています。ボルバキアはミトコンドリアと同じように母系で次世代に伝わるため、オス殺しによって集団内の感染メスの割合を増やし、自身の感染拡大につなげていると考えられています。今回、東京大学大学院農学生命科学研究科の勝間進教授らのグループは、チョウ目昆虫においてオス殺しを誘導するボルバキアタンパク質Oscar(オス狩る)を同定し、オス殺しの仕組みを明らかにしました。本研究成果は、微生物がいかにして宿主の性決定システムをハイジャックし、自身の感染拡大を行うのか、そのメカニズムを解明したものです。本研究を足がかりにして、微生物による宿主の性や生殖のコントロールに関する研究の進展やOscarを利用したチョウ目昆虫の性操作技術の開発が期待されます。
発表内容
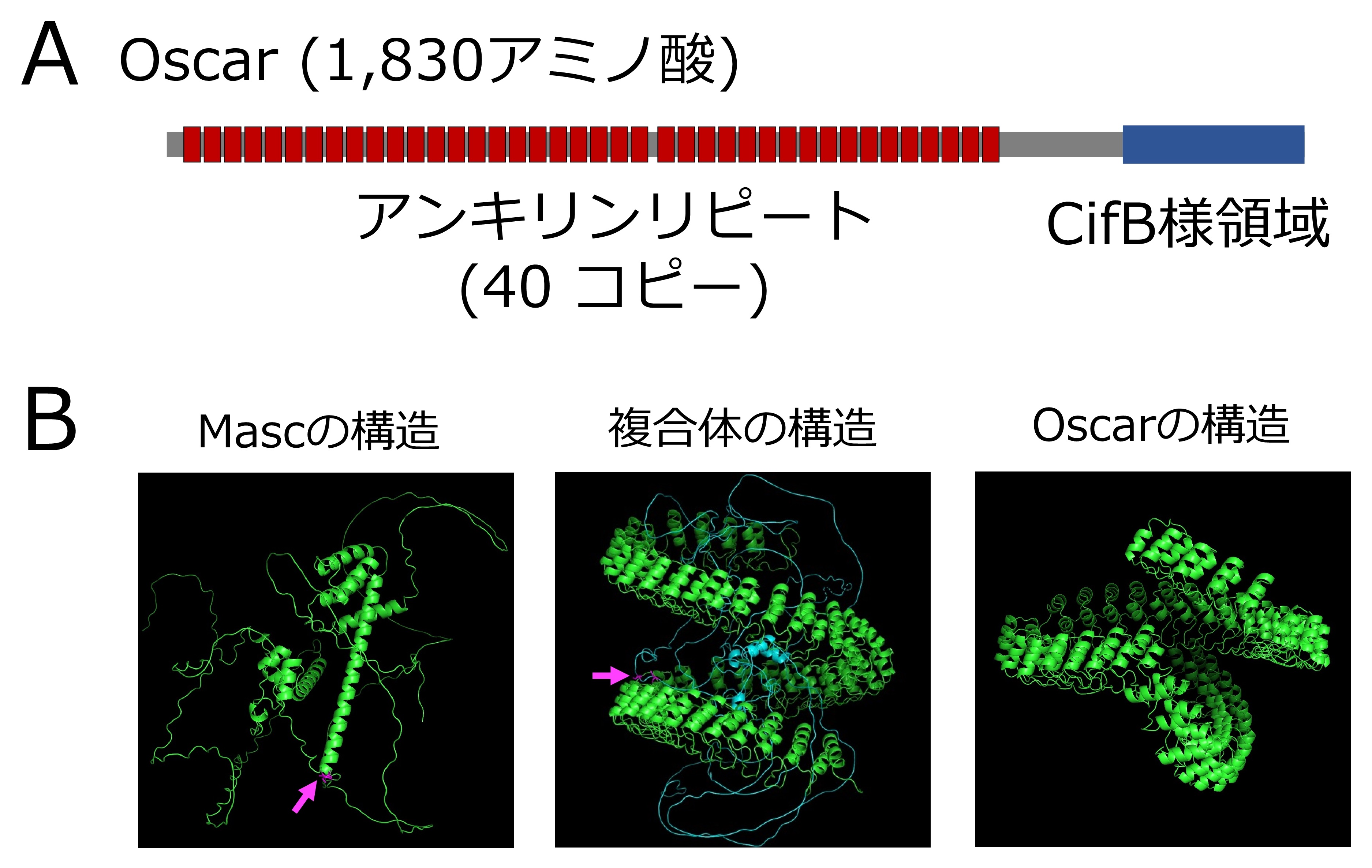
図1. Oscarの構造とAlphaFold2による複合体の構造予測
(A)Oscarの構造
40個のアンキリンリピートと脱ユビキチン化活性を有するCifB様ドメインを持つ。
(B) AlphaFold2によるOscar–Masc複合体の構造予測
Mascは活性に必要なα-helixを持つが(左図)、Oscarのアンキリンリピート(右図)に巻き込まれることでその構造が破壊されることが予測された(中央図)。
(拡大画像↗)
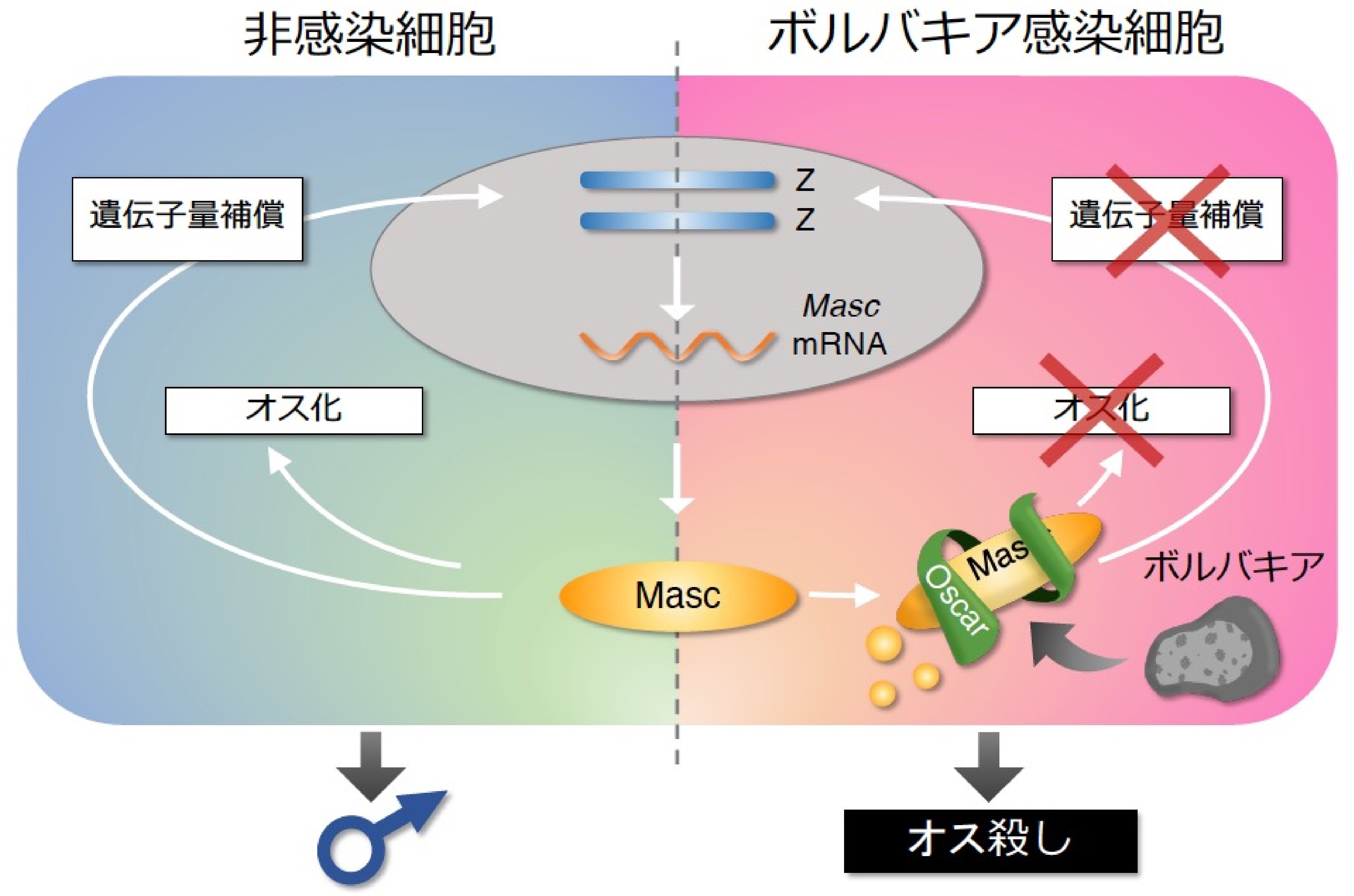
図2. オス殺し因子Oscarの作用機序
非感染オス細胞ではMascがオス化と遺伝子量補償を行う。一方、感染細胞ではボルバキア由来のOscarが細胞質でMascを捕捉し分解系に誘導することで、Mascの2つの機能を無効化し、オス殺しへと導く。
(拡大画像↗)
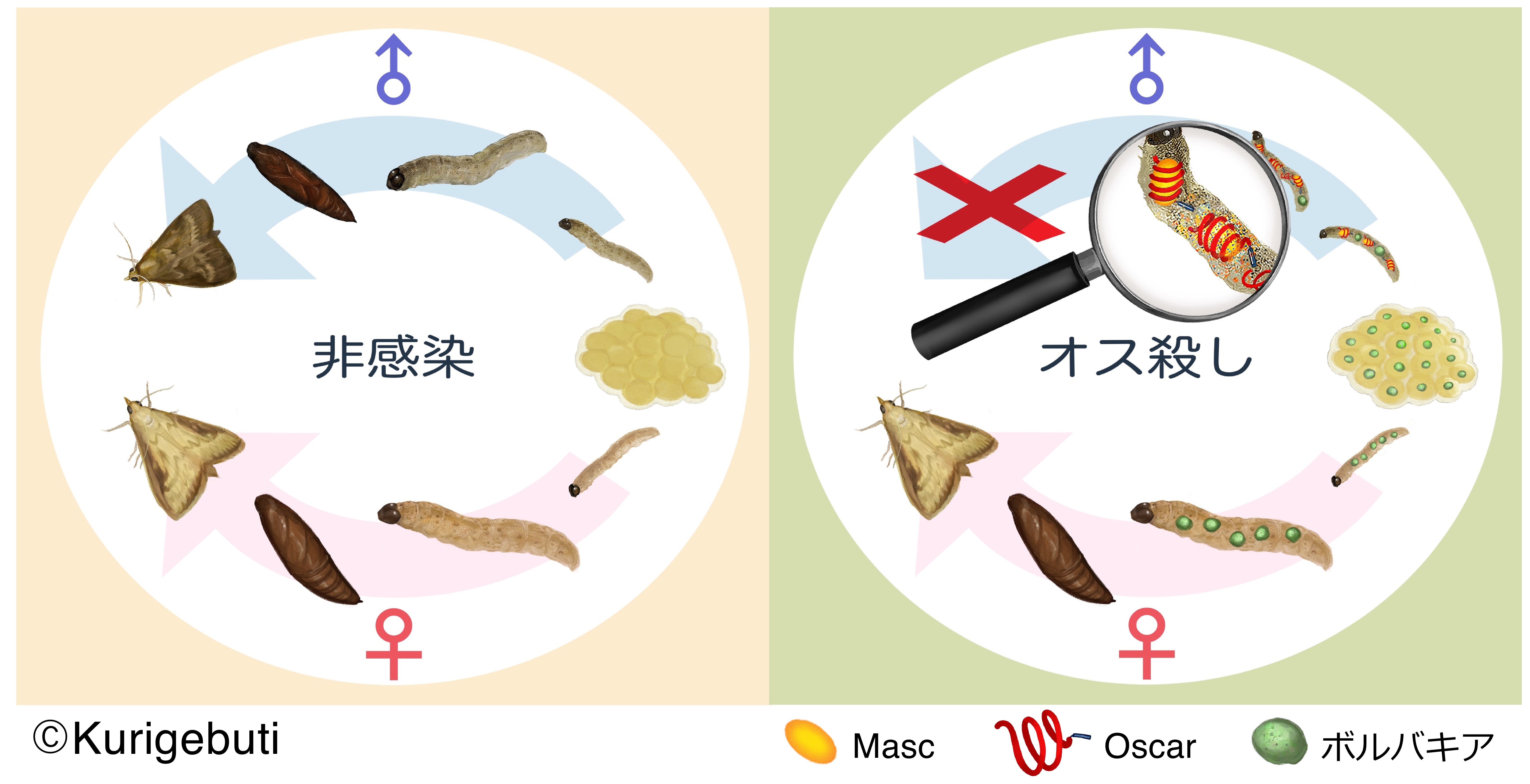
図3. ボルバキアによるアワノメイガのオス殺し
オス殺しボルバキアに感染したアワノメイガでは、MascがOscarによって捕捉され、最終的に分解される。その結果、オスではオス化、および遺伝子量補償経路が破綻し、胚子期、もしくは幼虫期で致死する。一方、メスにおいてはMascは必須ではないため、ボルバキアに感染した状態で成虫になり、ボルバキア感染卵を産み、次世代へ感染を拡大する。
(拡大画像↗)
共生細菌であるボルバキアは昆虫の半数以上に感染しており、その宿主制御の巧みさも相まって「最も成功した寄生者」と言われています。ボルバキアは、オス殺し、遺伝的オスのメス化、単為発生、細胞質不和合という4種類の性・生殖操作を行いますが、これらのうち実行因子とその分子機構が解明されているのは、ショウジョウバエに感染するボルバキアwMelの細胞質不和合だけです(LePage et al., Nature, 2017)。オス殺しに関しては、同じくwMelから同定されたWO-mediated killing(wmk)が有力な候補因子として報告されていますが(Perlmutter et al., PLoS Pathog., 2019)、その作用メカニズムは解明されていない状況です。東京大学大学院農学生命科学研究科の勝間進教授のグループでは長年にわたり、カイコの性決定遺伝子の同定を目指してきましたが、2014年にW染色体上のpiRNA(Fem piRNAと命名)がメス決定因子であることを明らかにすることができました(Kiuchi et al., Nature, 2014)(農学部プレスリリース参照:https://www.a.u-tokyo.ac.jp/topics/2014/20140515-1.html)。また、Fem piRNAのターゲットとなっている遺伝子Masculinizer(Masc)を同定し、その遺伝子産物がチョウ目昆虫においてオス化と遺伝子量補償(注2)を担うことも発見しました。さらに、Mascの胚子での発現をRNA干渉で低下させると、遺伝子量補償が破綻し、人為的にオス殺しを誘導できることを見出しました。トウモロコシの害虫としてよく知られているアワノメイガやその近縁種では、ボルバキア感染によって胚や幼虫のステージでオスだけが致死することが知られています。そこで、アワノメイガとオス殺しボルバキアを用いた研究を開始し、ボルバキアがMascをターゲットとしてオス殺しを引き起こしていることを証明しました(Fukui et al., PLoS Pathog., 2015)(農学部プレスリリース参照:https://www.a.u-tokyo.ac.jp/topics/2015/20150715-1.html)。しかし、ボルバキアがどのような因子(タンパク質)を利用してMascの機能を抑制しているのかは、それから約7年間未解明のままでした。
本研究グループは、ボルバキア「オス殺し因子」を同定するために、オス殺しボルバキア感染胚子から培養細胞を作成し、培養細胞でアワノメイガ個体で起きているオス殺しを再現できるシステムを構築しました。このボルバキア感染培養細胞ではMascを過剰発現させてもMascタンパク質が蓄積せず細胞のオス化が起こりませんでしたが、抗生物質処理によりボルバキアを除去するとMascが蓄積し、細胞がオス化することがわかりました。つまり、この培養細胞ではボルバキア感染胚子と同じようにMasc依存的なオス化が抑制されていることになります。そこで、この感染細胞を用いて、ボルバキア「オス殺し因子」を探索することにしました。Masc変異体を用いた実験によって、ボルバキア由来因子がMascのN末端領域と相互作用していることがわかりました。そこで、MascのN末端領域に結合するボルバキアタンパク質を探索したところ、相互作用するボルバキアタンパク質を一つだけ見つけました。研究グループはこの遺伝子をOscar(オス狩る)と名付けました(Osugoroshi protein containing CifB C-terminus-like domain and many Ankyrin Repeats:“オスを狩る”という意味を込めて、廣田加奈子が命名)。Oscarはその名の通り、40個のアンキリンリピート(注3)とボルバキア細胞質不和合因子CifBの一部を持つ非常にユニークな構造をしています(図1A)。Mascはその活性に必要なαヘリックス構造を持ちますが、AlphaFold2による構造予測からOscarのアンキリンリピートが蛇のように巻きつくことでその構造が破壊されることが予測されました(図1B)。実際に培養細胞を用いて機能を調査したところ、Oscarの発現だけでMascの蓄積が阻害され、Masc依存的なオス化が抑制されることがわかりました(図2)。次にいろいろなチョウ目昆虫由来のMascで Oscarの抑制能を調べたところ、程度に差はあるものの用いたすべてのMascでオス化能の抑制傾向が認められました。そこで、アワノメイガとカイコの胚子を用いてOscarの昆虫個体における機能を調査しました。胚子でOscarを強制発現させると、アワノメイガではオスの半数ほどが胚のステージで致死し、成虫になるまでにはすべてのオスが致死しました。さらにカイコでは、すべてのオスが胚致死しました。以上の結果から、OscarがMascに結合し、Mascの2つの機能、オス化と遺伝子量補償を破綻させることでオス殺しを誘導することがわかりました(図2)。つまり、今回見つけたOscarこそ探し求めたボルバキアのオス殺し因子の実体であると結論づけました(図3)。
今回発見したOscarは、培養細胞では様々なチョウ目昆虫由来のMascの機能を抑制したことから、チョウ目昆虫において普遍的にオス殺しを誘導できる可能性があります。今後、Oscarが様々なチョウ目昆虫をオス殺せるかを調査し、次世代の性操作技術の開発につなげたいと考えています。一方、Oscarはこれまでに報告されている中では最大コピー数のアンキリンリピートをもつタンパク質です。実際にMascとどのような構造で結合しているのかをクライオ電顕等で調査することで、宿主タンパク質から特異的にMascを認識する機構を明らかにできればと考えています。
本研究は、科研費「新学術領域研究(研究領域提案型)(課題番号:17H06431)」、「基盤研究(A)(課題番号:22H00366)」、「挑戦的萌芽研究(課題番号:15K14893)」、「JST次世代研究者挑戦的研究プログラム(課題番号:JPMJSP2108)」の支援により実施されました。長期にわたるオス殺し因子の探索はこれらの支援がなければ継続できませんでした。また、本プロジェクトの初期段階でご協力いただいた川本宗孝氏、疋田弘之博士、鈴木穣教授に感謝いたします。
発表雑誌
- 雑誌名
- Nature Communications
- 論文タイトル
- A Wolbachia factor for male killing in lepidopteran insects
- 著者
- Susumu Katsuma#,*, Kanako Hirota#, Noriko Matsuda-Imai#, Takahiro Fukui, Tomohiro Muro, Kohei Nishino, Hidetaka Kosako, Keisuke Shoji, Hideki Takanashi, Takeshi Fujii, Shin-ichi Arimura, and Takashi Kiuchi (#Equal contribution, *Corresponding author)
- DOI番号
- 10.1038/s41467-022-34488-y
問い合わせ先
東京大学大学院農学生命科学研究科生産・環境生物学専攻 昆虫遺伝研究室
教授 勝間 進(カツマ ススム)
用語解説
注1 ボルバキア
ボルバキアはα-proteobacteriaに属するリケッチアに近縁な細胞内共生微生物であり、昆虫で広く感染が認められています。ボルバキアは卵細胞質を通じた母子感染で伝達され、宿主の性・生殖システムを様々な方法で操作することで次世代への感染拡大を図っていることが知られています。そのうちの1つが「オス殺し」と呼ばれる現象であり、チョウ目昆虫においては、リュウキュウムラサキ、チャハマキ、アワノメイガなどで報告されています。
注2 遺伝子量補償
雌雄における性染色体数の不均等から生じる遺伝子の発現量の差を、雌雄で等しくなるように調節する機構を遺伝子量補償といいます。例えば、ヒトではメスで2本あるX染色体のうちの片方を不活化することでバランスを維持していますが、同じオスXY/メスXXの性染色体構成を持つキイロショウジョウバエでは、オスのX染色体の遺伝子の発現を上昇させるシステムを使用しています。また、チョウ目昆虫の場合、オスにおけるZ染色体の遺伝子発現を抑制することで遺伝子量補償が行われますが、そのシステムの中心にMascが存在していることがわかっています。このように、遺伝子量補償の分子機構は生物によって大きく異なっています。
注3 アンキリンリピート
アンキリンリピートは約33アミノ酸残基の繰り返し配列を持つタンパク質のモチーフの1つです。2つのα-helixが平行に配置する構造をとることが知られています。タンパク質間相互作用に重要であると考えられており、ボルバキアゲノム上にも多数のアンキリンリピート含有タンパク質がコードされています。