2023-01-12 京都大学iPS細胞研究所
ポイント
- 家族性筋萎縮性側索硬化症(amyotrophic lateral sclerosis: ALS)の原因遺伝子の一つである変異型ヒトSOD1遺伝子を導入したブタALSモデルを作り出した。
- ブタALSモデルの脊髄や神経根には異常な折り畳み構造を持つmisfolded SOD1が蓄積していた。
- ブタALSモデルはALSの遺伝子・細胞治療の開発において重要な大型動物を用いた前臨床研究プラットフォームとなる。
1. 要旨
近藤孝之特定拠点講師(京都大学iPS細胞研究所(CiRA)増殖分化機構研究部門特定拠点講師、理化学研究所(理研)バイオリソース研究センター(BRC)iPS創薬基盤開発チーム客員研究員、理研革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム客員研究員)、井上治久教授(CiRA同部門教授、理研BRC同チームチームリーダー、理研AIP同チーム客員主管研究員)、長嶋比呂志(明治大学バイオリソース研究国際インスティテュート)らの研究チームは、ALS注1)を引き起こす原因遺伝子の一つであるスーパーオキシドジスムターゼ 1 (SOD1)遺伝子のプロモーター領域を含む遺伝子変異体をブタに導入することでブタALSモデル注2)を作り出しました。このブタALS モデルの脊髄および神経根注3)内で、異常な折り畳み構造を持つmisfoldedSOD1 (mSOD1)の蓄積と軸索変性を見出しました。 体、特に脊髄のサイズや構造など、ヒトに似た解剖学的特性を有するブタALS モデルは、遺伝子・細胞治療を開発するためのプラットフォームとなります。
この研究成果は2023年1月12日に Laboratory Investigation誌でオンライン公開されました。
2. 研究の背景
ALSは、運動神経細胞の障害により四肢の筋萎縮や球麻痺注4)を引き起こす神経変性疾患であり、嚥下障害や呼吸筋麻痺により死に至ります。現在までに、SOD1遺伝子を含む 30 種類以上の ALS 関連遺伝子が報告されています。 SOD1 は 1993 年に家族性 ALSの原因遺伝子として同定され、マウスなどのモデル動物にヒト変異体 SOD1 (mutant SOD1: mSOD1) を過剰発現させると、運動神経細胞の変性や寿命の短縮などの ALS 様の症状を呈することが知られています。 変異SOD1 を持つ遺伝子改変マウスやラットは、ALS の治療法開発に用いられてきましたが、マウスやラットなどの齧歯類の体のサイズは、ヒトと異なっており、実際のヒトでの遺伝子・細胞治療へとそのまま進む前に、体のサイズや構造など解剖学的特性がよりヒトに近い動物モデルが必要でした。この課題の解決策として、ブタを使用することにより、遺伝子・細胞治療の開発に用いることができる大型実験動物のALSモデルを作り出すことを計画しました。
3. 研究結果
1) 変異型ヒトSOD1遺伝子を導入したブタの作製
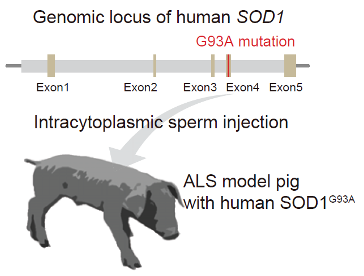
SOD1 タンパク質は、哺乳動物の体全体に広く発現しています。本研究では、ヒト SOD1 プロモーターとともにG93A 変異を持つヒト SOD1 遺伝子座のゲノム構造を、遺伝子工学技術を用いてブタに導入することで、細胞や遺伝子治療などの前臨床研究開発へ適合する生理学的なSOD1の発現をブタ体内で再現することを目指しました(図1)。
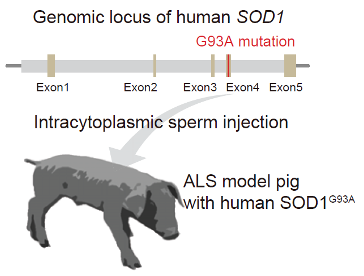
図1:ブタに変異型ヒトSOD1遺伝子を導入する
プロモーター領域を含む変異型ヒトSOD1遺伝子をブタに導入した。
2) SOD1では無症候期間中でもALS病態が見られた
ALS は、上肢および下肢の運動神経細胞の進行性変性を特徴とし、四肢の筋力低下を引き起こします。モデル動物を用いた以前の研究では、ALS の病態は無症候期間中にも進行する可能性があることが示唆されています。そして運動機能の臨床的低下が現れると、神経症状が急速に進行することが知られています。したがって、無症状の段階を含め、より早い段階で治療介入を開始することが重要です。そこで、無症候性段階におけるブタALSモデルで、 ALS 病態が存在するかどうかを調べました。
ブタALSモデル(Tg K193、Tg W368)の脊髄前角の運動神経細胞注5)を、細胞質コリンアセチルトランスフェラーゼ(choline acetyltransferase: ChAT)注6)の免疫染色により野生型のブタ(WT K185、WT W398)と比較すると、細胞体が小さく数も減少傾向が見られました(図2)。これらは、ALS患者でも見られる、運動機能障害につながる変化と考えられます(図2)。
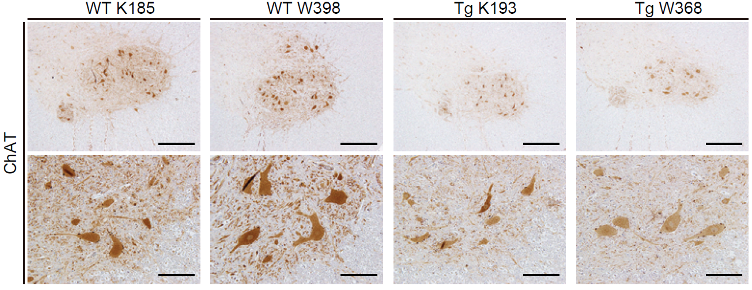
図2:ブタALSモデルは脊髄前角の運動神経細胞における変性傾向を示した
運動機能に重要な脊髄前角運動神経(ChAT抗体で染色)は、野生型と比べて変異SOD1を導入したブタALSモデルで運動神経細胞の細胞体が萎縮変性傾向にあった。
3) Misfolded SOD1の蓄積が見られた
次に、SOD1遺伝子関連性のALS 患者やげっ歯類モデルの脳神経において、 変異型SOD1 タンパク質は異常な折り畳み構造をとったmisfolded SOD1注7)として蓄積することが知られています。Misfolded SOD1は、強い神経細胞毒性につながることが知られており、重要なALS病態であり治療法開発における標的となります。このmisfolded SOD1を特異的に認識する抗体を用いて、ブタALSモデルの脊髄を調べると、脊髄前角の運動細胞内に、misfolded SOD1が蓄積していることがわかりました(図3)。
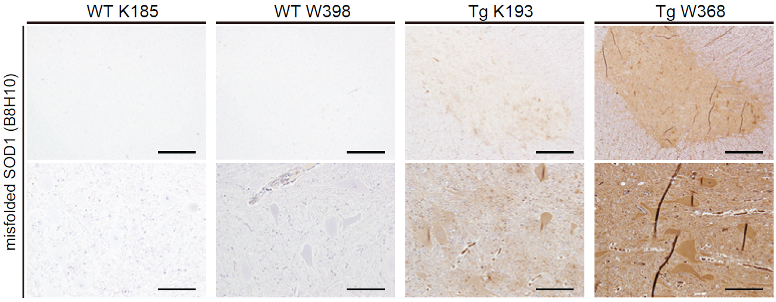
図3:ブタALSモデルの脊髄前角の運動神経細胞にmisfolded SOD1が蓄積した
ブタALSモデルの脊髄前角にある運動神経細胞に、misfolded SOD1を特異的に認識する抗体による強い染色像が見られた。
4) 軸索変性が見られた
さらに、ALS 病理の初期異常の 1 つである軸索変性を分析するために、ブタALSモデルの腹側神経根を取り出し調べました。すると脊髄運動神経細胞の細胞体よりも顕著なmisfolded SOD1の蓄積がみられました(図4)。
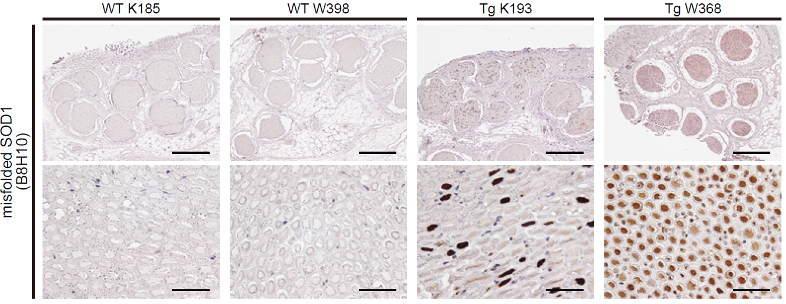
図4:ブタALSモデルの神経根にmisfolded SOD1が蓄積していた
ブタALSモデルの運動神経細胞の軸索が走行する神経根(前根)内に、misfolded SOD1を特異的に認識する抗体による強い染色像が見られた。
そして、運動神経細胞の軸索変性を評価するために、前根に存在するChAT陽性の軸索数を数えました。 ブタALSモデルでは、大口径線維の数が減少していました。これらの結果は脊髄前根の運動神経軸索がmisfolded SOD1の蓄積により変性したことを示しています(図5)。
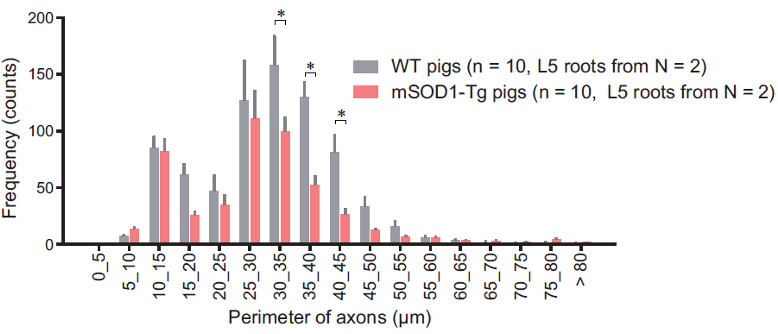
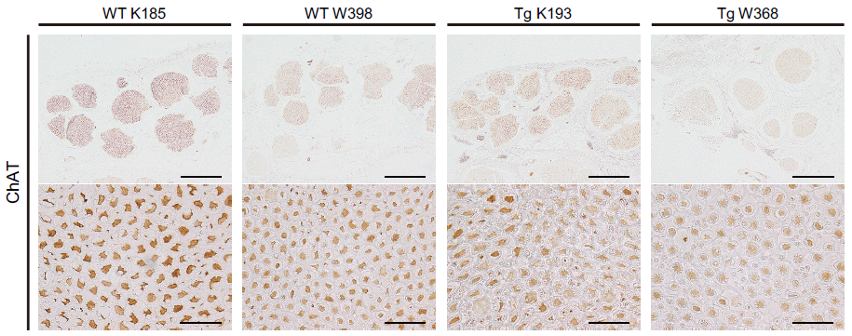
図5 ブタALSモデルの運動神経線維が変性していた。
ブタALSモデルの運動神経細胞の軸索をChAT染色で調べると(図内上染色像)、大口径線維の数が減少していた(図内下のグラフ)。
4. まとめ
今回研究グループは、ブタにヒト変異型SOD1遺伝子を導入することで、ブタALSモデルを作り出しました。このブタALSモデルはヒトに似た解剖学的特性を持つことから、今後、ALSの遺伝子・細胞治療の前臨床研究に適合する大型実験動物として活用され、ALSの遺伝子・細胞治療法開発への道筋となることが期待されます。
5. 論文名と著者
- 論文名
A transgenic pig model with human mutant SOD1 exhibits the early pathology of amyotrophic lateral sclerosis - ジャーナル名
Laboratory Investigation - 著者
Takayuki Kondo1,2,3, Ikuyo Inoue1,2, Kazuhiro Umeyama4,5, Masahito Watanabe4,5, Hitomi Matsunari4,5, Ayuko Uchikura4, Kazuaki Nakano4,5, Kayoko Tsukita1,3, Keiko Imamura1,2,3, Hiroshi Nagashima4*, and Haruhisa Inoue1,2,3*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チーム
- 明治大学 バイオリソース研究国際インスティテュート
- 株式会社ポル・メド・テック
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)(JP22bm0104001, JP22ek0109448, 19gm0010002)
- 日本学術振興会科学研究費補助金(18H02717, 21H02807, 20K16599)
- Meiji University International Institute for Bio-Resource Research
7. 用語説明
注1) 筋萎縮性側索硬化症(Amyotrophic lateral sclerosis:ALS)
筋肉が次第に萎縮し、全身の筋肉が動かなくなる病で、最終的には呼吸筋麻痺で亡くなる方が多い。運動神経細胞に異常が生じることが原因であることがわかっているが、これまでに有効な治療法は確立されておらず、日本では特定疾患に認定されている。およそ90%程度が遺伝性の認められない孤発性である。残りの10%が遺伝性であり、そのうちの2割程度がSOD1(スーパーオキシドジスムターゼ1)という遺伝子に変異があることが知られている。
注2) ブタモデル
ブタは生理学的、解剖学的、および遺伝学的にヒトに比較的近い動物であることから、食肉のみならず大型実験動物としての有用性が注目されている。さらに発生工学技術やゲノム編集技術の発達の結果、単一遺伝子疾患を対象とする疾患モデルブタの開発が可能となった。
注3) 神経根
脊髄から左右に枝分かれする細い神経のこと。
注4) 球麻痺
延髄にある脳神経核が障害され、口・舌・喉の動きが悪くなり、嚥下障害(食べ物の飲み込みが悪い)や構音障害(ろれつが回らない)などが生じる。
注5) 脊髄前角の運動神経細胞
脊髄の腹側部位である前角にあり、筋肉へと電気信号を伝え運動機能を司る細胞。コリン作動性神経細胞の一つであり、アセチルコリンを合成する酵素であるコリンアセチルトランスフェラーゼ(ChAT)で染色される。
注6) コリンアセチルトランスフェラーゼ
アセチルコリンの合成酵素で、コリン作動性神経細胞の細胞質のみに存在する。コリン作動性神経細胞の最良のマーカータンパク質。
注7) misfoldedSOD1
変異型SOD1遺伝子由来のタンパク質は、誤って折り畳まれた構造をとることが知られ、家族性ALS患者やそのヒトiPS細胞由来の神経細胞などに蓄積することが知られている。misfolded SOD1は、過剰な細胞ストレスと細胞死を誘導することが知られ、重要な病態マーカーおよび治療標的と考えられている。