コロンビア工学部の神経科学者は、情報を記憶しやすくするために感情との関連付けを行う、人間の脳の特定の神経メカニズムを特定しました。 Columbia Engineering neuroscientists identify a specific neural mechanism in the human brain that tags information with emotional associations for enhanced memory.
2023-01-24 コロンビア大学
◆RNAシーケンスを用いて単一細胞の分解能で遺伝子発現を測定することは、過去10年間、がん組織を研究するための最も画期的なツールの1つとなっています。個々の細胞のRNAを調べることで、研究者は腫瘍内の細胞の多様性や、これらの腫瘍細胞がどのように成長し、免疫細胞とどのように相互作用するかをよりよく理解することができる。これらは、がんの進行の特徴や治療に対する耐性を理解する上で重要な要素であり、新しいがん治療法の開発にとって鍵となるものである。
◆従来の臨床ワークフローでシングルセルRNAシーケンスを広く採用する上での大きな障壁は、臨床目的で日常的に収集される量よりも大幅に多い新鮮な組織が必要であることでした。また、新鮮な組織が必要であるということは、採取したサンプルを直ちに分析しなければならないことを意味します。このような要件により、患者のサンプルで行える科学的分析が大幅に制限されていた。
◆コロンビア大学の研究チームは、これらの障壁を克服することに焦点を当て、少量の凍結腫瘍標本から最高の結果を得ることができる新しい配列決定法を開発した。通常、臨床試験中に収集され、バイオバンクに保管されているこれらの標本には、稀ながんや、特有の病歴や危険因子を持つ患者の組織が含まれていることがある。この新しい技術によって、このような種類の検体の配列決定が可能になり、科学的分析に利用できる腫瘍サンプルの数と種類が大幅に増加します。
◆IzarおよびAzizi研究所の研修生であるYiping Wang、Joy Fan、Johannes Melmsが率いるこの新しい研究は、単一細胞RNAシーケンス、単一細胞T細胞受容体シーケンス、全ゲノムシーケンス、空間RNAシーケンス(in situで腫瘍構造を保持する革新的なRNAシーケンス手法)–すべて同じサンプルで行われた結果に基づいています。研究者らは、複数の種類のがんデータを組み合わせることで、遺伝子変化、細胞機能、免疫細胞の動態、患者組織の文脈における細胞の空間的な局在を総合的に把握することができた。これらの改善により、がんの進行と耐性のメカニズムに関する理解が大きく広がりました。
<関連情報>
- https://www.engineering.columbia.edu/news/multimodal-sequencing-achieves-high-quality-results-small-volumes-frozen-tumor-specimens
- https://www.nature.com/articles/s41588-022-01268-9
小規模凍結臨床検体のマルチモーダルシングルセルおよびホールゲノムシーケンス Multimodal single-cell and whole-genome sequencing of small, frozen clinical specimens
Yiping Wang,Joy Linyue Fan,Johannes C. Melms,Amit Dipak Amin,Yohanna Georgis,Irving Barrera,Patricia Ho,Somnath Tagore,Gabriel Abril-Rodríguez,Siyu He,Yinuo Jin,Jana Biermann,Matan Hofree,Lindsay Caprio,Simon Berhe,Shaheer A. Khan,Brian S. Henick,Antoni Ribas,Evan Z. Macosko,Fei Chen,Alison M. Taylor,Gary K. Schwartz,Richard D. Carvajal,Elham Azizi & Benjamin Izar
Nature Genetics Published:09 January 2023
DOI:https://doi.org/10.1038/s41588-022-01268-9
Abstract
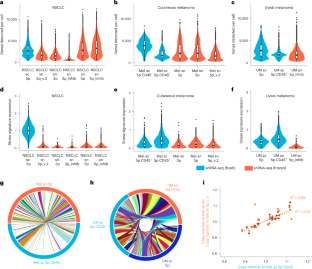
Single-cell genomics enables dissection of tumor heterogeneity and molecular underpinnings of drug response at an unprecedented resolution1,2,3,4,5,6,7,8,9,10,11. However, broad clinical application of these methods remains challenging, due to several practical and preanalytical challenges that are incompatible with typical clinical care workflows, namely the need for relatively large, fresh tissue inputs. In the present study, we show that multimodal, single-nucleus (sn)RNA/T cell receptor (TCR) sequencing, spatial transcriptomics and whole-genome sequencing (WGS) are feasible from small, frozen tissues that approximate routinely collected clinical specimens (for example, core needle biopsies). Compared with data from sample-matched fresh tissue, we find a similar quality in the biological outputs of snRNA/TCR-seq data, while reducing artifactual signals and compositional biases introduced by fresh tissue processing. Profiling sequentially collected melanoma samples from a patient treated in the KEYNOTE-001 trial12, we resolved cellular, genomic, spatial and clonotype dynamics that represent molecular patterns of heterogeneous intralesional evolution during anti-programmed cell death protein 1 therapy. To demonstrate applicability to banked biospecimens of rare diseases13, we generated a single-cell atlas of uveal melanoma liver metastasis with matched WGS data. These results show that single-cell genomics from archival, clinical specimens is feasible and provides a framework for translating these methods more broadly to the clinical arena.