2022-09-06 東京大学
発表者
西村 正宏 (東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 特任研究員)
滝沢 由政 (東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 准教授)
野澤 佳世 (東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 助教 (研究当時))
胡桃坂 仁志 (東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 教授)
発表のポイント
◆がん抑制遺伝子産物p53が、染色体の基盤構造であるヌクレオソームに含まれる標的DNA配列と結合し、遺伝子のスイッチをオンにする仕組みを、クライオ電子顕微鏡によって世界で初めて明らかにした。
◆p53は標的DNA配列と結合することで、染色体中のDNAの構造を大きく変化させることが分かった。
◆p53によるDNA結合の破綻はがん悪性化を引き起こす原因であることから、本成果で得られた知見はがん治療を目指した創薬に重要である。
発表概要
東京大学定量生命科学研究所クロマチン構造機能研究分野の西村正宏 特任研究員、野澤佳世 助教 (研究当時、現東京工業大学生命理工学院准 教授)、滝沢由政 准教授、胡桃坂仁志 教授らの研究グループは、がん抑制に関わる主要な転写因子であるp53が染色体の基盤構造 (ヌクレオソーム) と結合した複合体の立体構造を世界で初めて明らかにしました。
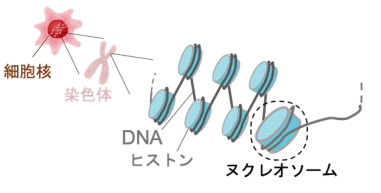
p53遺伝子はおよそ半数のがん患者において突然変異が認められており、細胞が持つがん抑制機構において中心的な働きをすることが知られています。その遺伝子産物となるp53タンパク質は、ゲノムDNA上の特定の配列 (標的DNA配列)と結合し、がん抑制遺伝子群のスイッチをオンにすることで、細胞分裂の停止・DNA修復・プログラム細胞死等を誘導します。そのためp53は”ゲノムの守護神”とも呼ばれており、p53遺伝子の突然変異によってこれらの細胞機能が損なわれることが、がん化の主要な原因の一つであると考えられています。一方、真核生物のゲノムDNAはヒストン複合体に巻き付いた染色体構造を形成しており、p53が染色体中でがん抑制遺伝子のスイッチをオンにするメカニズムは不明でした。この疑問を解決するため当研究グループは、試験管内で再構成したヌクレオソームとp53からなる複合体を高純度に調製し、クライオ電子顕微鏡を用いた立体構造解析をおこないました。その結果、p53が標的DNAと結合することで染色体中のDNAが大きく歪められることが明らかになりました。本成果は、真核生物の染色体中でp53が標的DNA配列と結合する様子を捉えた世界初の立体構造であり、p53ががん抑制遺伝子のスイッチをオンにするメカニズムの一端を解明したものです。それゆえ、p53の異常が原因となる発がんメカニズムの解明や新たな抗がん剤開発のための重要な足掛かりになることが期待されます。
本研究は、国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業(ERATO) 「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)をはじめ、さきがけ 「遺伝子を活性化するDNAルーピング機構の構造基盤の解明」 (代表:野澤佳世、JPMJPR18K9)、日本学術振興会(JSPS) 新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)、特別研究員奨励費「転写因子p53-ヒストン相互作用を介した、転写活性化メカニズムの解明」 (特別研究員:西村正宏、JP19J23094)、基盤研究(C)「革新的なクロマチン基盤膜を用いたクライオ電子顕微鏡3次元構造解析」(代表:滝沢由政、JP19K06522)、研究活動スタート支援「クロマチン構造依存的な転写活性化機構の解明」(代表:野澤佳世、JP19K21175)、基盤研究(C)「新規クロマチンユニットの構造機能解析」(代表:野澤佳世、JP20K06599)、基盤研究(A)「クロマチン上で起こる転写と共役した二重鎖切断修復の分子機構の解明」(代表:胡桃坂仁志、JP20H00449)、学術変革領域研究(B)「動的ゲノム構造をつくるメガダルトン複合体の構造機能解明」 (代表:野澤佳世、JP21H05154)、国立研究開発法人日本医療研究開発機構(AMED) 創薬等ライフサイエンス研究支援基盤事業 (BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代 表:胡桃坂仁志、JP21am0101076)、「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産」(代表:胡桃坂仁志、JP22ama121009)からの支援を受けて実施されました。