2019-06-11 京都大学iPS研究所
ポイント
- 10日間という短期間で、in vitroでの骨形成過程を表す骨様結節(注1)をiPS細胞から誘導する方法を確立した。
- 共焦点顕微鏡(注2)を用いたイメージング、タイムラプスイメージング(注3)を用いて分化過程の観察を行い、骨細胞様細胞が結節表面から内部へ移動する過程を可視化した。
- 遺伝性骨疾患の1つである、骨形成不全症(注4)患者さん由来iPS細胞を用いて、結節形成能の低下及びⅠ型コラーゲンの分布異常という病態を再現した。
1. 要旨
川井俊介 研究員(京都大学CiRA増殖分化機構研究部門/ウイルス・再生医科学研究所)、戸口田淳也 教授(京都大学CiRA同部門/ウイルス・再生医科学研究所/医学研究科)らの研究グループは、in vitroでの骨形成過程を表す骨様結節を、レチノイン酸(注5)シグナルを用いることでヒトiPS細胞から10日間という短期間で誘導する方法を確立しました。誘導された骨様結節は、生体由来の骨芽細胞及び骨細胞と類似した形態を持つ細胞から形成されており、また骨芽細胞を主体とする誘導7日目の細胞塊はin vivoで骨組織を形成する能力を有していました。この誘導系を用いて、遺伝性骨疾患の一つである骨形成不全症(Osteogenesis Imperfecta、OI)の病態再現を行いました。COL1A1遺伝子変異を有するOI患者さん由来のiPS細胞では、標準的iPS細胞及び変異修復iPS細胞と比較して骨様結節形成能の低下、Ⅰ型コラーゲンの分布異常などが認められ、これまで指摘されているOIの病態が再現されました。また、有効性が示唆されているmTOR(注6)阻害剤(mTORi)を用いた実験を行ったところ、病態が部分的に改善されることを確認しました。本研究の成果は、骨形成過程に関わる病態の解析から創薬において、有用なアプローチとなることが期待されます。
この研究成果は2019年6月11日(日本時間)に「Nature Biomedical Engineering」で公開されました。
2. 研究の背景
骨組織は常に骨形成と骨吸収の過程(骨改変)を繰り返す動的組織です。正常な骨改変過程及びその病的状態を理解する上で、遺伝子改変マウスを用いたin vivoでの解析は重要な役割を果たしてきましたが、疾患解析から創薬への応用を考えると、in vitroでの骨改変過程モデルの構築も重要なアプローチです。戸口田淳也教授らの研究グループは骨改変過程の中の骨形成過程に焦点を絞り、ヒトiPS細胞を用いて、in vitroでの再現系の構築を試みました。研究グループは、これまでに進行性骨化性線維異形成症(Fibrodysplasia Ossificans Progressiva、FOP) (注7)患者さん由来iPS細胞の骨様結節の形成が亢進していることを報告しましたが(Matsumoto et al. Orphanet Journal of Rare Diseases 2013)、正常細胞からの誘導では安定した結果が得られていませんでした。疾患研究に有用となる、より簡便で安定した誘導法の開発に向けて研究を進め、この既存の誘導法にレチノイン酸シグナルを加えることで、iPS細胞からの骨分化誘導が促進されることを発見しました。今回、それを応用することで骨形成細胞の分化誘導法(骨様結節形成)を確立し、遺伝性骨疾患の病態再現に成功しました。
3. 研究結果
1. ヒトiPS細胞からのレチノイン酸シグナルを用いた骨様結節の誘導
従来の骨様結節誘導法にレチノイン酸シグナルを加えると、4日目より石灰化結節が認められ、10日目までその数は増加しました。遺伝子発現を解析したところ、iPS細胞から、骨前駆細胞、前骨芽細胞、骨芽細胞、そして骨細胞に特徴的な分化マーカーが、10日間の誘導期間で順を追って発現していることが分かりました。10日目の骨様結節を酵素処理で単離して、細胞形態を確認したところ、立方形の骨芽細胞様細胞と多数の突起を有した骨細胞様の細胞が認められました(図1)。これらにより、iPS細胞から誘導した骨様結節内には骨芽細胞及び骨細胞の特徴を有した細胞が含まれることが分かりました。
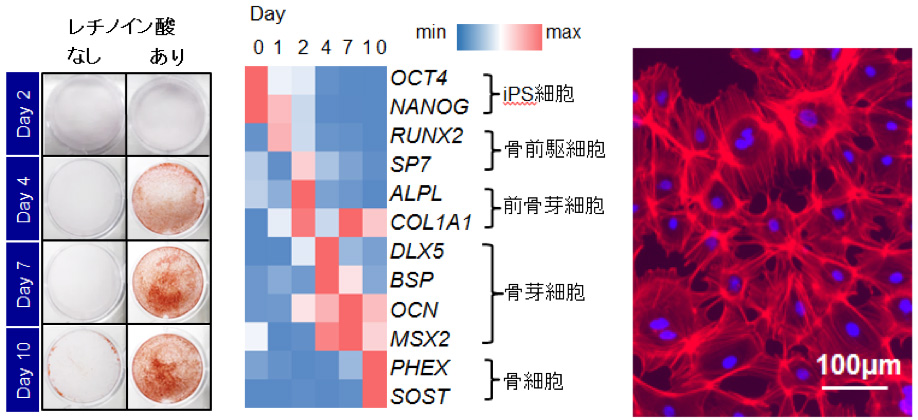
図1:ヒトiPS細胞よりレチノイン酸シグナルを用いて誘導した骨様結節の特徴
左から
- アリザリンレッド染色(石灰化):レチノイン酸シグナルでの石灰化結節形成の亢進
- 分化マーカーの発現(遺伝子発現):分化段階を追ったマーカー発現
- 単離細胞の免疫染色(赤:アクチン、青:DAPI):骨芽細胞、骨細胞に類似した形態
2. 誘導した骨様結節の観察
次に、共焦点レーザー顕微鏡を用いたメージングにより、誘導した骨様結節の詳細を解析しました。その結果、結節表面には骨芽細胞様の立方形細胞が敷石状に分布し、その直下に多数の突起を有した骨細胞様の樹状細胞が、あたかも表面より落ち込んだ様に存在していました(図2 ①)。また結節の底面付近では、結節内部に多くの樹状細胞を認めました(図2 ②)。これらの過程を時空間的に理解するために、タイムラプスイメージングを用いて観察を行いました。その結果、iPS細胞から誘導された骨芽細胞は敷石状となり、徐々に結節を形成し、それに伴い表面の骨芽細胞様細胞の中から、結節内部に細胞が落ち込んで、骨細胞様細胞に変化することが分かり、in vivoでの分化形態(類骨(石灰化前の骨組織)への骨芽細胞の埋没による骨細胞への分化)に類似した点があると考えられました。
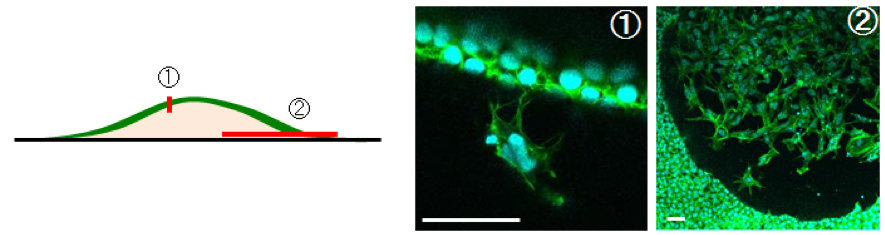
図2:骨様結節の共焦点レーザー顕微鏡によるイメージング
(免疫染色(緑:アクチン、青:DAPI)、スケール:20μm)
①結節頂上付近の垂直断面:骨様結節表面(骨芽細胞様の立方細胞)から、突起を有した骨細胞様細胞の結節内への落ち込み
②結節底面付近の垂直断面:骨様結節内の突起を有した樹状細胞(骨細胞様細胞)の存在
3. 誘導した細胞のin vivoでの骨形成能
骨芽細胞段階である分化誘導7日目の細胞塊を免疫不全マウスの頭蓋骨欠損部へ移植することで、誘導細胞のin vivoでの骨形成能を評価しました。細胞を移植しなかった群では、新たな骨形成は認められませんでしたが、細胞移植群では欠損部に新生骨が認められ(μCT)、組織切片において類骨様組織の形成、またヒト特異的オステオポンチン(hOPN)での染色を確認でき、ヒト由来組織(iPS細胞由来)であることが確認できました。(図3)これらより、誘導細胞はin vivoにおいて骨形成能を有することが分かりました。
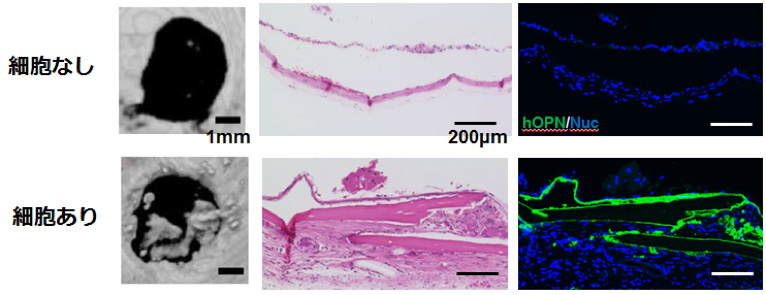
図3:in vivoでの骨形成能(免疫不全マウスの頭蓋骨欠損部への細胞移植)
左から
- μCT:細胞移植群で新たな骨形成を認める。
- 組織切片(HE染色):細胞移植群で新たな骨形成を認める。
- 組織切片(免疫染色(緑:hOPN、青:DAPI)):骨形成部は類骨様組織の形成を認め、
ヒト特異的オステオポンチンが陽性であり、iPS細胞由来組織と考えられる。
4. OI患者さん由来iPS細胞(OI iPS)を用いた病態再現とmTORiの効果
この誘導法を用いて、遺伝性骨疾患である骨形成不全症(OI)の病態再現を行いました。標準iPS細胞、OI患者さん由来iPS細胞(OI iPS)、変異を遺伝子編集にて修復したiPS細胞の3つの細胞と、OI iPSを誘導中にmTORiを加えた4群で分化誘導を行い、石灰化結節形成能とⅠ型コラーゲンの免疫染色の比較を行いました。その結果OI iPSにおいて、標準iPS細胞及び変異修復iPS細胞と比較して、石灰化結節形成能の低下、コラーゲンの細胞外分布異常及び細胞内の蓄積を認めました。また、mTORiの添加により、これらは部分的な改善を認めました。これらより、既報のOIの病態である、石灰化能の低下・コラーゲンの分布異常という、in vitroにおける病態再現が確認できました。また、有効性が示唆されているmTORiにおける部分的な改善も認めることから、この誘導系を用いて、候補薬剤の効果を確認することも期待できると考えられました。
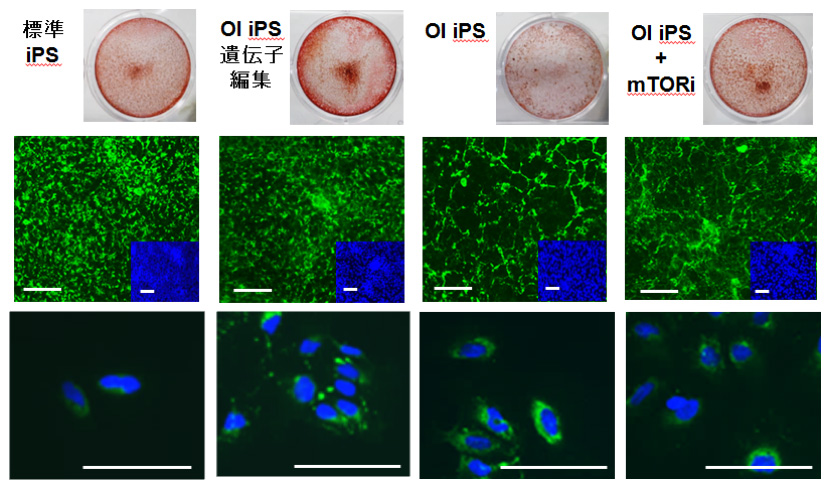
図4:OI患者由来iPS細胞を用いた病態再現
左から標準iPS細胞・遺伝子編集で変異修復したOI iPS・OI iPS・OI iPSにmTORi添加
上から
- アリザリンレッド染色:OI iPSにおいて石灰化の低下、mTORiによる部分的な改善を認める
- 免疫染色(緑:Ⅰ型コラーゲン、青:DAPI):上は誘導のままの染色で細胞外のコラーゲンを観察しており、下は単離細胞の染色で細胞内のコラーゲンを観察している。OI iPSにおいて、細胞外コラーゲンの分布不整、細胞内コラーゲンの蓄積を認め、mTORiにより部分的な改善を認める。
4. まとめ
本研究では、iPS細胞から短期間で骨様結節の形成に至る骨分化誘導法を確立しました。誘導した骨様結節には、骨芽細胞様細胞・骨細胞様細胞が含まれており、その分化過程もin vivoでの分化過程に類似した点もあることから、骨形成細胞の分化過程の研究に応用出来ると考えます。また、患者さん由来iPS細胞を用いることで、骨形成不全症のような遺伝性骨疾患の病態解析・創薬への応用も期待されます。
5. 論文名と著者
- 論文名
In vitro bone-like nodules generated from patient-derived iPS cells recapitulate pathological bone phenotypes - ジャーナル名
Nature Biomedical Engineering - 著者
Shunsuke Kawai1,2,3*, Hiroyuki Yoshitomi1,2,3, Junko Sunaga3, Cantas Alev1, Sanae Nagata1, Megumi Nishio3, Masataka Hada3, Yuko Koyama3, Maya Uemura1, Kazuya Sekiguchi1,2, Hirotsugu Maekawa1,2, Makoto Ikeya1, Sakura Tamaki1,3, Yongui Jin3,4, Yuki Harada5, Kenichi Fukiage5, Taiji Adachi3, Shuichi Matsuda2, and Junya Toguchida1,2,3,4**
* 筆頭著者
** 責任著者
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会(JSPS)科学研究費助成事業
- 再生医療実現拠点ネットワークプログラム
iPS細胞中核拠点
疾患特異的iPS細胞の利活用促進・難病研究加速プログラム - 日本医療研究開発機構(AMED)革新的先端研究開発支援事業
7. 用語説明
(注1)骨様結節
ラットの頭蓋骨由来の骨芽細胞など、骨形成細胞をin vitroにて分化誘導することで形成される結節(Bhargava et al, Bone 1988)。In vitroでの骨形成過程の特徴とされる。
(注2)共焦点レーザー顕微鏡
特定の場所に焦点を結ぶように励起光となるレーザーを照射し、標本の発する蛍光を測定することにより、厚みのある試料であっても高解像度の三次元情報の再構築が可能となる顕微鏡。
(注3)タイムラプスイメージング
一定間隔で連続撮影した何百枚または何千枚もの画像をつなぎ合わせて編集し、1つの動画にする手法。
(注4)骨形成不全症 (Osteogenesis Imperfecta、OI)
全身の骨脆弱性による易骨折性や進行性の骨変形に加え、様々な程度の結合組織症状を示す先天性疾患。90%以上の症例では、結合組織の主要な成分であるI型コラーゲンの遺伝子変異(COL1A1、COL1A2)により、質的あるいは量的異常が原因で発症するとされている。
(注5)レチノイン酸
ビタミンA(レチノール)の代謝物質で、成長や発達に必要なビタミンAの機能を媒介する。胚の発生初期には、胚の特定領域でレチノイン酸が生成し、胚の後部の発達を導く細胞間シグナル分子として、胚の軸に沿った前部/後部を決定する助けとなる。
(注6)mTOR (mechanistic target of rapamycin)
免疫抑制剤ラパマイシンの標的分子として発見されたタンパク質。哺乳類などの動物で細胞内シグナル伝達に関与するタンパク質の一種。活性化するとタンパク質の合成を増加させたり、分解を抑制したり、細胞分裂などの調節に中心的な役割を果たすと考えられている。
(注7)進行性骨化性線維異形成症 (Fibrodysplasia Ossificans Progressiva、FOP)
結合組織に発生する稀な先天性疾患で、ACVR1遺伝子の変異に起因する。筋肉や腱、靭帯などの軟部組織が骨組織に変化して硬化する。


