2023-02-28 量子科学技術研究開発機構
発表のポイント
- 脳局所の神経細胞の異常興奮が広い範囲に伝播し、けいれんや意識消失などを引き起こす深刻な病気であるてんかん1)の画期的な治療法を開発。
- スイッチのように働く人工受容体2)とそれにピンポイントに作用する独自開発の人工薬剤を用いて、症状が出たときにだけてんかん病巣の神経細胞の活動をオフにして症状を緩和するオンデマンド治療3)の有効性を検証。
- 脳の大きさや複雑さがヒトに近く、同じ霊長類であるサルで治療効果が認められたことにより、臨床治療への応用に向け大きく前進。
発表概要
量子科学技術研究開発機構(平野俊夫 理事長、以下「量研」)量子生命・医学部門 量子医科学研究所 脳機能イメージング研究部(南本敬史 グループリーダー、宮川尚久 客員研究員)、および新潟大学(川嵜圭祐 准教授)、京都大学(高田昌彦 教授、井上謙一 助教)、東京都立神経病院(松尾健 医長)、情報通信研究機構(鈴木隆文 室長)らの共同研究グループは、化学遺伝学4)という手法を利用することで、てんかんの症状が発生した時にのみ神経活動を抑制するオンデマンド治療法を開発し、その有効性をサルモデルで実証することに成功しました。
てんかんは局所の神経細胞の異常な興奮が脳の広範囲に伝播し、けいれんや意識消失などの発作を引き起こす深刻な病気です。薬物療法や外科手術などの治療法は、時として正常な脳機能を阻害する可能性もあり、てんかん病巣のみに集中し、かつ発作時のみに作動して異常活動を抑えるようなオンデマンド治療が求められていました。
本研究では、遺伝子操作で導入した人工受容体とそれにのみ作用する人工薬剤を用いて神経活動を操作する化学遺伝学と呼ばれる手法を用いて、てんかんサルモデルにおけるてんかん発作の治療効果を検討しました。サルの一次運動野5)を仮のてんかん病巣と見立て、薬で異常興奮を引き起こすと、その活動が脳に広く伝わり全身性のてんかんが引き起こされます(前頭葉てんかんサルモデル)。この領域の神経細胞に人工受容体を導入し、薬剤で引き起こしたてんかん発生時に量研が独自開発した人工薬剤(デスクロロクロザピン;DCZ)6)を投与すると、わずか数分でてんかんの脳波と症状が抑えられることが確認できました(図1)。これまで化学遺伝学技術の脳疾患への治療応用はマウスなど小動物を対象とした研究に限られてきました。今回、ヒトと同じ霊長類で高度に発達した大きな脳をもつサルでその有効性を確認できたことは、今後の臨床応用に向け大きく前進する成果であるといえます。
本研究は、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(戦略的国際脳科学研究推進プログラム、国際脳)」・「脳科学研究戦略推進プログラム、脳プロ」並びにJSPS科研費における成果を一部活用したもので「Nature Communications」のオンライン版に2023年2月28日(火)19:00(日本時間)に掲載されました。
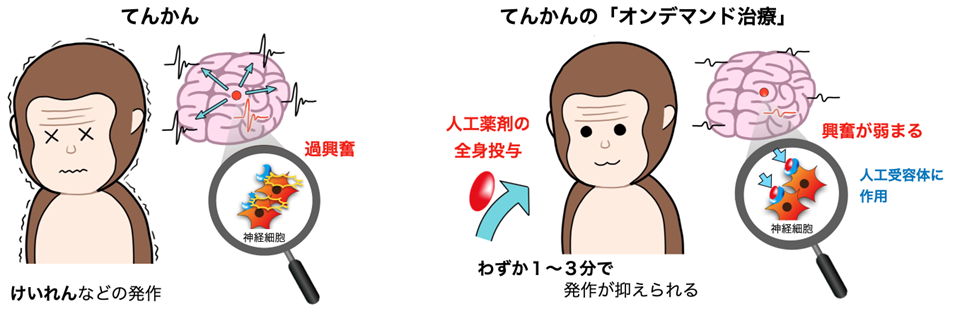
図1:本研究の概要図
研究の背景と目的
てんかんは局所の神経細胞の異常興奮が脳の広い範囲に伝わり、けいれんや意識消失などを引き起こす深刻な病気です。患者さんのうち約6-7割は服薬で症状をコントロールできますが、薬が効かない難治性てんかんの患者さんに対しては、周辺部位を多少含んでも病巣部を切除する外科治療が行われます。しかし、病巣部近辺に運動・言語などの重要な機能がある場合などは、病巣部の切除による機能喪失が生じる可能性もあり、このような症例に対する効果的な代替治療法の開発が求められていました。
本研究では、量研が世界に先駆けて霊長類への応用に成功している化学遺伝学という革新的な技術を応用し、てんかん症状が出たときに病巣部の異常な神経活動のみをピンポイントに抑制するオンデマンド治療法の開発を目指しました。化学遺伝学は、特定の人工薬の作用点となる人工受容体を遺伝学的な手法を用いて標的神経細胞に導入することで、人工薬を全身投与する毎に、その細胞の活動だけをピンポイントで数時間コントロールできる技術です。今回、前頭葉てんかんのサルモデルとして運動機能を司る一次運動野をてんかんの仮想の病巣部位に設定し、この部位に人工受容体を導入し、人工薬剤投与により異常活動やてんかん発作を素早く・確実に・安全に抑えられるかを検証しました。
研究の手法と成果
2頭のカニクイザルの左脳の一次運動野(手支配領域)に抑制性の人工受容体を発現するウイルスベクター7)を注入し、6週間後に狙い通り一次運動野に人工受容体が発現することをPET8)で画像化し確認しました。次に、皮質脳波を計測するアレイ電極9)を埋め込み、てんかんを誘発する薬剤(ビククリン)を運動野に微量注入しました(図2)。
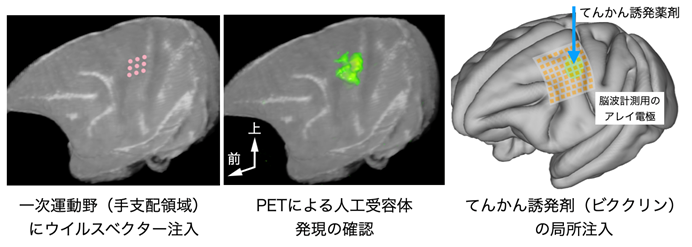
図2:サル一次運動野に導入した人工受容体を画像化して、その中心にてんかんを誘発
(左)人工受容体遺伝子をもったウイルスベクターの注入位置(ピンクの点)の模式図。
(中)人工受容体に結合したPET薬剤から放射される信号の集積部位(緑)を示すPET画像。人工受容体の発現が一次運動野で確認できた。
(右)一次運動野をカバーする脳波計測用アレイ電極の位置とてんかん誘発剤(ビククリン)投与位置を示した模式図。
ビククリンを注入した場所付近では、間もなく、棘波と呼ばれるてんかん脳波が生じるとともに、左の運動野が支配する右手が勝手に動く症状(不随意運動)が見られました。数分後には、その発作は大脳皮質全般に広がり、全身性のけいれんが見られました。
これらの症状を確認した後に、人工受容体の作動薬であるDCZを極微量、筋肉注射で投与したところ、わずか数分でてんかん脳波とてんかん発作様の症状が減弱しました(図3)。
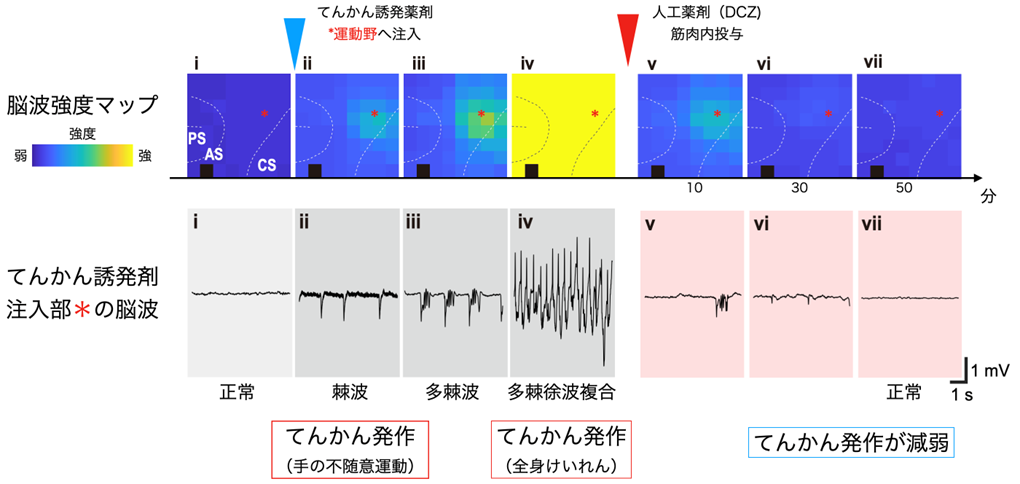
図3:脳波によるてんかんのモニタと「オンデマンド治療」の効果の一例
(上)脳波強度のマップ。アレイ電極上の64箇所から記録された皮質表面電位の強度を色で示したもの。てんかん誘発剤を注入した部位から、高い強度の脳波が全体に広がる様子が捉えられた。また人工薬剤DCZ投与後に強度が減弱した。
(下)誘発剤注入部位に近い電極から記録された脳波の例。誘発剤注入後、棘波→多棘波→多棘徐波複合と、脳波パターンが変わり振幅も増加し、てんかん発作様症状を伴った。DCZ投与後は頻度の低い多棘波がみられるがそれも時間とともに消失し、てんかん発作様行動の頻度も減少した。
2頭のサルで合計6回のてんかん誘発とDCZ投与による治療効果を検討しました。そのいずれにおいても、てんかん脳波及びてんかん発作様の異常行動の頻度が減弱・減少することがわかり、統計学的にも有意な効果であることが判明しました。さらに、その効果が発揮されるまで、投与からわずか3分以内という即効性があることも確認できました(図4)。
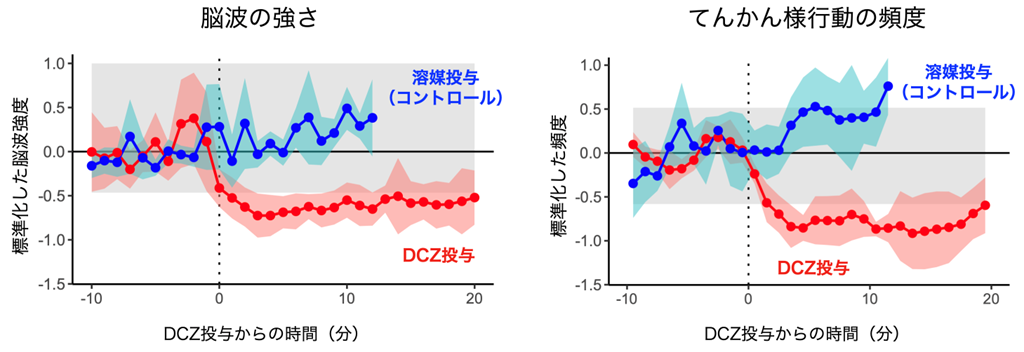
図4:DCZと溶媒投与が及ぼす皮質脳波とてんかん様行動への影響の比較
(左)脳波の強さ。投与前の脳波強度を元に脳波強度を標準化し、平均と標準誤差を表示している。溶媒コントロール(青、 N=4)は変化がないが、DCZ投与により3分後には投与前の95%信頼区間を下まわり有意に強度が減弱した(赤、N=6)。
(右)てんかん様行動の頻度。左と同様に標準化した値の平均と標準誤差を示す。同様にDCZ投与により3分後には投与前の95%信頼区間を下まわり有意に頻度が減少した。
また、人工薬剤DCZの投与自体では運動や覚醒状態に影響はないこと、また一次運動野への人工受容体の遺伝子導入とDCZ投与による活性化に伴う脳へのダメージ(神経細胞死や免疫応答)は確認されず、安全性が十分保たれていることが確認できました。
今後の展開
本研究では、前頭葉てんかんサルモデルにおいて、てんかん病巣の神経細胞に導入した人工受容体を介して、てんかん脳波が皮質全体に拡がりを持つようになった重篤な状態でも、効果的に発作を抑えることができました。本成果は、これまでマウスなど小動物でしか示されていなかった化学遺伝学による発作抑制を、脳の大きさや複雑さがヒトに近く、同じ霊長類であるサルを用いて世界で初めて概念実証(Proof-of-Concept)に成功したものであり、臨床治療への応用に向け大きく前進したといえます。実際には、遺伝子導入技術の安全性、DCZの長期的投与の安全性など臨床試験に移行する前にさらなる取り組みが求められますが、PETによる遺伝子導入の確認と発現レベルの画像化技術は、原理的にはヒトにも適用可能であり、その点においても、応用可能性を示したと考えられます。
また、本研究で用いた化学遺伝学技術は量研が世界に先駆けて霊長類への応用に成功した基幹技術であり、今後は国内外の研究機関などと共同し、10年以内の臨床治療応用を見据えて研究を進めていく予定です。
用語解説
1)てんかん
てんかんは、突然意識を失って反応がなくなるなどの「てんかん発作」を繰り返し起こす病気で患者数も100人に1人と、誰もがかかる可能性のあるありふれた病気のひとつです。「てんかん発作」は、脳の一部の神経細胞が突然一時的に異常な電気活動(電気発射)を起こすことにより生じますが、脳のどの範囲で電気発射が起こるかにより様々な「発作症状」を示します。しかし症状は基本的に一過性で、てんかん発作終了後は元通りの状態に回復することが特徴です。治療は適切な抗てんかん薬を服用することで、60~70%の患者さんでは発作は抑制され通常の社会生活を支障なく送れます。一方、抗てんかん薬では発作を抑えることができず、「難治性てんかん」として複数の抗てんかん薬の調整や外科治療などの専門的なてんかん治療を必要とする場合もあります。
厚生労働省HP(https://www.mhlw.go.jp/kokoro/know/disease_epilepsy.html)参照
2)人工受容体
本来生体内に存在する受容体(内因性受容体)に遺伝子変異を入れることにより作られた、人工の受容体。通常、神経細胞では内因性受容体に神経伝達物質(リガンド)が結合することで活動が変化します。一方、人工受容体は、生体内に存在するいかなるリガンドも結合せず、特定の人工リガンド(作動薬)のみが結合して神経活動が変化します。今回、神経細胞の「スイッチ」として導入した人工受容体は抑制性の(スイッチをオフにする)機能をもつものであり、本研究グループが開発した作動薬であるデスクロロクロザピン(DCZ)が結合します。
3)オンデマンド治療
症状が出そう、あるいは出たときにのみに薬を使い症状を抑えるという治療方法。
4)化学遺伝学(chemogenetics)
遺伝子変異等によって作られた人工受容体と、生体内に存在する受容体には作用しない人工の作動薬の組み合わせによって神経活動を操作する研究手法です。
5)一次運動野
左右の脳の比較的前方にある領域で、反対側の手足などの随意運動の発現に関わり、運動指令を出力します。
6)デスクロロクロザピン(Deschloroclozapine、略称DCZ)
人工受容体を作動させる、QSTが独自開発した人工薬剤の名称。作動薬としては、現在最も効果的です。詳細は2020年QSTプレスリリース(https://www.qst.go.jp/site/press/42113.html)参照。
7)ウイルスベクター
細胞への遺伝子導入を目的に、ウイルスが持つ細胞への感染性を利用し、病原性に関する遺伝子に代わり外来の目的遺伝子を組み込んだものです。遺伝子治療にも応用されています。
8)PET
陽電子断層撮影法(Positron Emission Tomography)の略称。ポジトロン核種(11C、13N、15O、18F等)で標識したPET薬剤を体内に投与し、特定の体の部位に集積したり体内物質に結合したりするPET薬剤から放射される陽電子に起因するガンマ線を検出することによって、体内に存在する生体内物質の局在や量を測定して画像化する方法です。今回は人工受容体に結合するDCZを放射性標識した[11C]DCZをPET薬剤として用い、人工受容体の発現している範囲を生体で特定しました。
9)アレイ電極
硬膜の内外に留置して、脳表面の比較的広い範囲の多くの位置の電気信号を計測するためのシート状の電極。今回用いたのは国立研究開発法人情報通信研究機構 未来ICT研究所 脳情報通信融合研究センター 鈴木隆文室長が開発した64点から記録ができる電極。
研究者のコメント
サルを用いた疾患研究ということで、動物倫理にも配慮しながら実験を行いました。ヒトに近いサルで実際にけいれんが抑えられることを目の当たりにし、この手法の有効性が実感できました。臨床応用に向けた貢献できたことを嬉しく思います。今後も疾患に悩まれる方々の治療法の確立に一歩一歩近づいて行きたいと思います。
論文について
タイトル:Chemogenetic attenuation of cortical seizures in nonhuman primates
著者:Naohisa Miyakawa1*, Yuji Nagai1, Yukiko Hori1, Koki Mimura1, Asumi Orihara1,2, Kei Oyama1, Takeshi Matsuo3, Ken-ichi Inoue4, Takafumi Suzuki5, Toshiyuki Hirabayashi1, Tetsuya Suhara6, Masahiko Takada4, Makoto Higuchi1, Keisuke Kawasaki7, Takafumi Minamimoto1*
- Department of Functional Brain Imaging, National Institutes for Quantum Science and Technology, Chiba, Japan
- Department of Neurosurgery, Graduate School of Medical and Dental Sciences, Tokyo Medical and Dental University, Tokyo, Japan
- Department of Neurosurgery, Tokyo Metropolitan Neurological Hospital, Tokyo, Japan
- Systems Neuroscience Section, Center for the Evolutionary Origins of Human Behavior, Kyoto University, Aichi Japan
- Center for Information and Neural Networks, National Institute of Information and Communications Technology, Suita, Japan
- Institute for Quantum Life Science, National Institutes for Quantum Science and Technology, Chiba, Japan
- Department of Physiology, Niigata University School of Medicine, Niigata, Japan
*Corresponding authors


