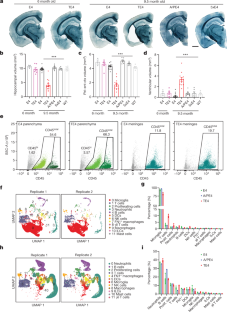
骨に転移した乳がんの治療に新たなアプローチを提案 Suggests a new approach for treating breast cancers that have spread to bone
2023-03-08 ワシントン大学セントルイス校
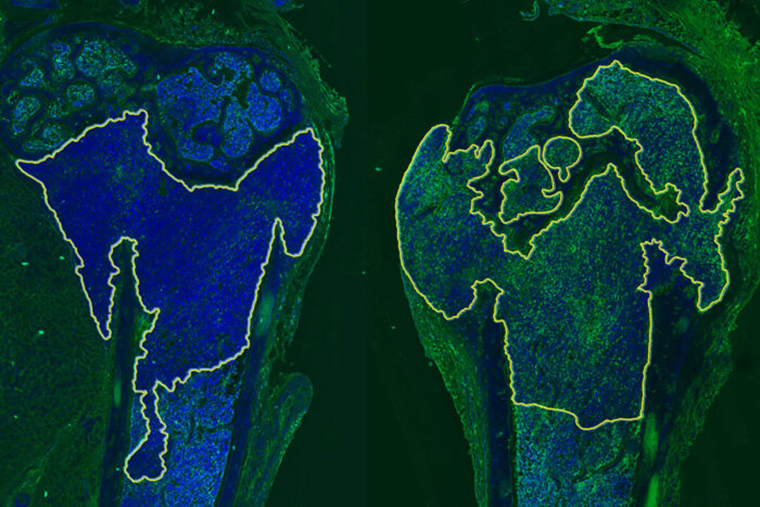
Researchers at Washington University School of Medicine in St. Louis have identified a way to sensitize metastatic breast cancer that has spread to bone to immunotherapy. Shown are two bones from mice with metastatic breast cancer. Tumors are inside the yellow outline. The left side shows an untreated tumor. The right side shows a tumor treated with a p38MAPK inhibitor. The increased green color on the right indicates the tumor is more sensitive to immunotherapy. (Image: Douglas Faget)
マクロファージとT細胞の活性を高めた結果、マクロファージは死んだがん細胞から認識できるがん抗原をT細胞に提示し、T細胞ががん細胞を攻撃するように誘導した。研究者らは、これによって転移性がんを完全に消滅させることができたと述べている。
研究は、米国がん研究協会の雑誌「Cancer Discovery」に掲載された。この研究成果は、骨に転移した乳がんに対する免疫療法の新しいアプローチを提供し、将来的には患者の治療法の選択肢を増やすことが期待されている。
<関連情報>
- https://source.wustl.edu/2023/03/two-pronged-immunotherapy-eliminates-metastatic-breast-cancer-in-mice/
- https://aacrjournals.org/cancerdiscovery/article-abstract/doi/10.1158/2159-8290.CD-22-0907/716615/p38MAPKa-stromal-reprogramming-sensitizes
p38MAPKa間質再プログラミングが転移性乳がんを免疫療法に感化させる p38MAPKa stromal reprogramming sensitizes metastatic breast cancer to immunotherapy
Douglas V. Faget;Xianmin Luo;Matthew J. Inkman;Qihao Ren;Xinming Su;Kai Ding;Michael R. Waters;Ganesh Kumar Raut;Gaurav Pandey;Paarth B. Dodhiawala;Renata Ramalho-Oliveira;Jiayu Ye;Thomas Cole;Bhavna Murali;Alexander Zheleznyak;Monica Shokeen;Kurt R. Weiss;Joseph B. Monahan;Carl J. DeSelm;Adrian V. Lee;Steffi Oesterreich;Katherine N. Weilbaecher;Jin Zhang;David G. DeNardo;Sheila A. Stewart
Cancer Discovery Published:MARCH 08 2023
DOI:https://doi.org/10.1158/2159-8290.CD-22-0907
Abstract
Metastatic breast cancer is an intractable disease that responds poorly to immunotherapy. We show that p38MAPKa inhibition (p38i) limits tumor growth by reprograming the metastatic tumor microenvironment in a CD4+ T cell, IFNy, and macrophage dependent manner. To identify targets that further increased p38i efficacy, we utilized a stromal labeling approach and single cell RNA sequencing. Thus, we combined p38i and an OX40 agonist that synergistically reduced metastatic growth and increased overall survival. Intriguingly, patients with a p38i metastatic stromal signature had better overall survival that was further improved by the presence of an increased mutational load, leading us to ask if our approach would be effective in antigenic breast cancer. The combination of p38i, anti-OX40, and cytotoxic T cell engagement cured mice of metastatic disease and produced long-term immunologic memory. Our findings demonstrate that a detailed understanding of the stromal compartment can be used to design effective anti-metastatic therapies.