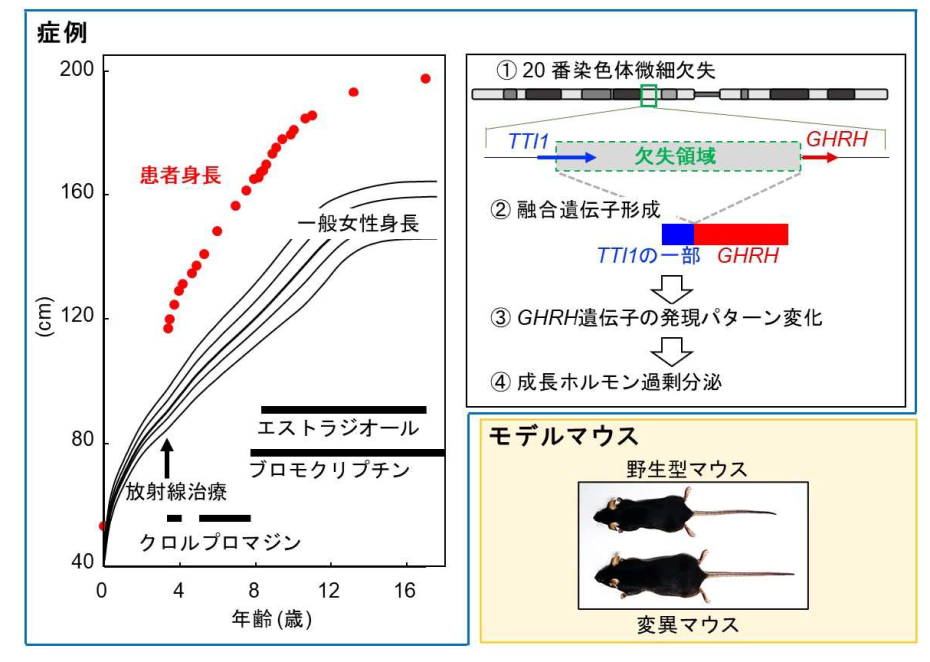
2023-04-20 京都大学iPS細胞研究所
ポイント
- Casタンパク質注1)をRNA-タンパク質相互作用を生み出す分子パーツとみなすことによって、利用可能なmRNAスイッチ注2)の種類を大幅に拡張した。
- ゲノム編集技術のために利用されているさまざまな生物工学的手法を翻訳制御技術に転用できることを示した。
- Casタンパク質を用いることで翻訳と転写を同時に制御することが可能となり、より少ないパーツで算術回路のような非常に複雑な遺伝子発現制御を可能にした。
1. 要旨
川﨑俊輔 特定研究員、小野紘貴 特定研究員、弘澤萌 特定研究員、齊藤博英 教授(いずれも京都大学CiRA未来生命科学開拓部門)らの研究グループは、ゲノム編集技術CRISPR-Casシステムを担うCasタンパク質を用いて、mRNAスイッチからの遺伝子の翻訳を制御する手法CARTRIDGE (Cas-Responsive Translational Regulation Integratable into Diverse Gene control: 多様な遺伝子制御に統合可能なCas応答性の翻訳調節法) を開発しました。これにより、利用可能なmRNAスイッチの数を大幅に増やすことに成功しました。
また、薬剤や抗CRISPRタンパク質注3)などを利用した、Casタンパク質の機能を制御するための既存の技術を転用し、mRNAスイッチの翻訳を制御可能であることを示しました。さらに、Casタンパク質を用いて転写と翻訳を同時に制御することで、細胞内で駆動する複雑な人工遺伝子回路注4)の構築に成功しました。
こうした技術は、mRNAスイッチからの遺伝子発現を精密に制御し、細胞の機能を自在に操るための基盤技術となることが期待されます。
この研究成果は、 2023年4月19日(英国時間)に英国科学誌「Nature Communications」でオンライン公開されました。
2. 研究の背景
合成生物学注5)分野では、細胞の機能や運命をコンピュータのように精密に制御する細胞コンピューティング技術の研究が行われています。研究者の望んだとおりに遺伝子発現パターンをプログラムすることで、生命現象の理解や新たな医療手段の創発が期待されています。
細胞コンピューティングでは、細胞が環境中のシグナルを検知し、それに応じて適切な治療分子の選択や、それを発揮するタイミング、持続時間、強度などを自律的に決定し出力できるようにプログラムします。この技術により、創薬やワクチン開発、細胞移植などの医療において、治療効果の向上や副作用の低減に貢献することが考えられます。
こうした精密な制御機構を実現するためには、コンピュータのように情報処理を行う複雑な論理演算回路を細胞内に構築する必要があります。そのためには、生命システムの構成要素 (DNA、RNA、タンパク質といった生体分子) をもとに開発された人工遺伝子回路のパーツが必要となります。
研究グループは、これまでに、こうしたパーツの一つとしてmRNAスイッチを作製し、人工遺伝子回路の構築を行い、これを利用することで細胞運命の制御が可能な技術の開発に成功しています (CiRAニュース:2015年8月4日「細胞の機能を精密に制御する人工回路をRNAで構築:ヒトの細胞で成功」、2018年11月20日「人工RNA論理回路で細胞の運命を制御する」)。
人工遺伝子回路は複数のパーツを組み合わせて設計します。より複雑な細胞操作を実現する回路を構築するには、これまでよりさらに多くのパーツが必要となります。同グループは、これまでもこの課題の解決に取り組んできました (CiRAニュース:2019年12月17日「タンパク質を検出するmRNAスイッチの拡張:より複雑な細胞操作に向けて」)。しかし、精密に細胞の挙動をプログラムするためには、依然としてmRNAスイッチや翻訳を制御できるタンパク質の数が不足していました。そこで、本研究では多くの種類のCasタンパク質を用いてmRNAスイッチからの翻訳を制御する技術を開発することで、その数の拡張を試みました。
CRISPR-Casシステムは、細菌や古細菌がウイルス感染から自身を守るための獲得免疫機構と考えられています。なかでもCasタンパク質は、その多くがガイドRNAと呼ばれるRNA分子に導かれてウイルスゲノムを切断する「ハサミ」のような機能を担います。これまでにさまざまな種類の原核生物から非常に多くのCasタンパク質が同定されており、哺乳類細胞でもガイドRNAと結合し機能することが確認されていました。Casタンパク質は現在、ゲノムを編集するためのツールや遺伝子の発現を調節するためのツールとしてライフサイエンスの幅広い分野で利用されています。これらのことからCasタンパク質は、mRNAスイッチの翻訳制御に利用できる有望な因子であり、タンパク質応答型mRNAスイッチのレパートリーの拡張に役立つと考えられました。
3. 研究結果
1)Casタンパク質を用いたmRNAスイッチの翻訳制御技術の開発
研究グループは、Casタンパク質がガイドRNAに結合することに着目し、ガイドRNA配列をmRNAの5’側非翻訳領域 (5′-UTR) 内に配置することで、Casタンパク質がmRNAからの遺伝子の発現 (翻訳)を抑えることを見出しました。図1は、ゲノム編集分野で広範に利用されているCasタンパク質であるSpCas9を用いた例を示しています。SpCas9に結合するガイドRNAをmRNAの5′-UTRに挿入することで、SpCas9応答型mRNAスイッチを設計しました。このSpCas9応答型mRNAスイッチは、SpCas9が存在しないときはレポーターである緑色蛍光タンパク質が発現しましたが、SpCas9が存在するときは緑色蛍光タンパク質が発現しませんでした。
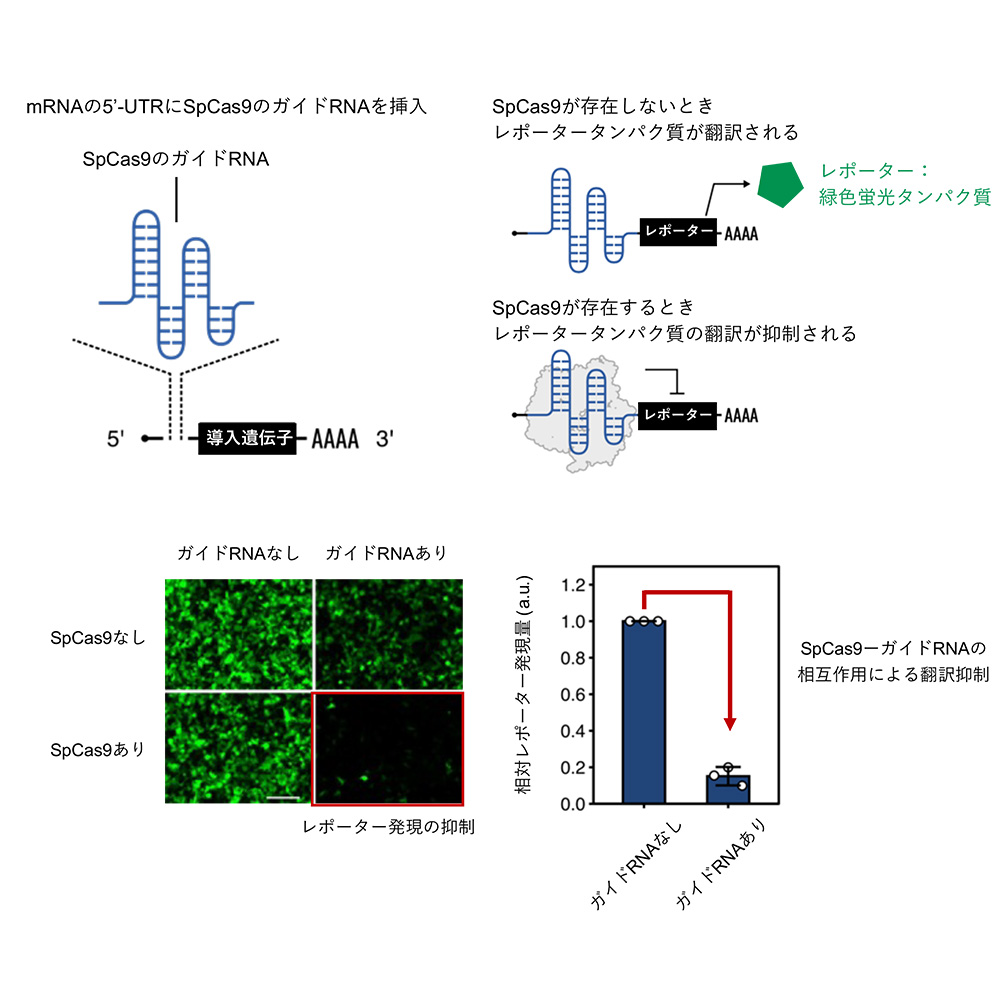
図1:Casタンパク質による翻訳の制御
2)Casタンパク質応答型mRNAスイッチの拡張と有用性の検証
これまでにさまざまな細菌や古細菌からCasタンパク質が同定されており、ヒトを含む哺乳類の細胞内でゲノム編集の活性を発揮できることが報告されています。そこで、SpCas9以外のCasタンパク質も、mRNAスイッチの翻訳を制御するRNA結合タンパク質として利用できるかどうかを調べました。
25種類のCasタンパク質に応答するmRNAスイッチをデザインし、ヒト細胞内で翻訳を抑制する効率を調べたところ、20種類のCasタンパク質が、対応するmRNAの翻訳を効率よく抑制できることが明らかになりました。これまでに開発したmRNAスイッチの翻訳を効率よく抑制できるRNA結合タンパク質は5種類だけでしたが、Casタンパク質を用いることで、mRNAスイッチの翻訳抑制に利用可能なRNA結合タンパク質の種類を大幅に拡張することができました。
また、タンパク質応答型mRNAスイッチを人工遺伝子回路のパーツとして用いて、所望の挙動を示す回路を構築するためには、スイッチが互いに干渉しあわないこと、つまり直交性が高いことが必要です。今回開発したCasタンパク質応答型mRNAスイッチの直交性を確かめるために、25種類のCasタンパク質と、25種類のCasタンパク質応答型mRNAスイッチをあらゆる組み合わせ (25×25 = 625通り) でヒト細胞内に導入し、緑色蛍光タンパク質の発現量を測定しました (図2)。その結果、直交性の高い13種類のCasタンパク質応答型mRNAスイッチを同定することができました。このように互いに直交性の高いmRNAスイッチは、翻訳制御を基盤とした人工遺伝子回路を構築するためのパーツとして有用であると考えられます。
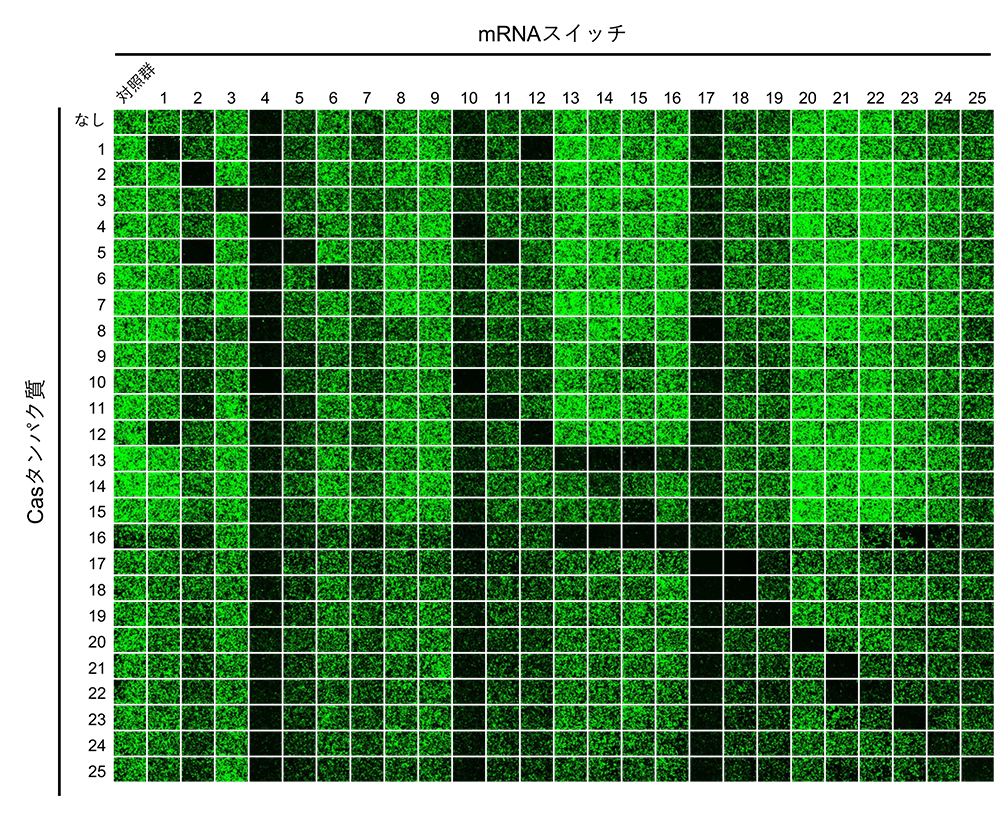
図2:Casタンパク質応答型mRNAスイッチの直交性
3)Casタンパク質の機能を制御する既存技術の翻訳制御への転用
mRNAスイッチに代表される翻訳制御システムを使って、遺伝子発現をより微細に調節するためには、特定の薬剤などの分子シグナルの存在時にmRNAスイッチが駆動するような、条件付き翻訳制御法の開発が有効です。これまで、こうした翻訳制御系を開発するためには、個々の分子パーツ (特に使用するタンパク質) の特性評価と、さらなる改変が必要でした。一方Casタンパク質は、ゲノム編集技術として活用するために、すでに薬剤や抗CRISPRタンパク質、光によって機能を制御する方法が開発されています。そこで、こうした既存のCasタンパク質制御システムを翻訳制御に転用できないかと考えました。
まず、Casタンパク質であるCas9をN末端断片とC末端断片の2つに分割することで、Cas9の活性を不活性化した後、薬剤の添加によって二量体化するタンパク質ドメインをそれぞれの断片に融合した分割型Cas9を設計しました (図3A左)。分割型Cas9とCas9応答型mRNAスイッチを細胞内に導入したところ、薬剤を添加した条件では、薬剤を添加しない条件に比べ、緑色蛍光タンパク質の発現が減少しました (図3A右)。このことから、薬剤を用いて分割型Cas9の二量体化を制御することで、Cas9タンパク質の翻訳抑制活性を制御できることが示されました。
続いて、Cas9とガイドRNAの結合を阻害する抗CRISPRタンパク質を用いることで、Cas9による翻訳の抑制を制御できるかを検討しました。図3Bに示すように、抗CRISPRタンパク質の発現量が増えるほど、Cas9応答型mRNAスイッチから発現する緑色蛍光タンパク質の蛍光強度が高くなりました。この結果は、抗CRISPRタンパク質がCas9による翻訳抑制を解除したことを示唆しています。
このように薬剤や抗CRISPRタンパク質といったCasタンパク質の機能を制御するための既存技術は、翻訳制御技術にも転用できることが示されました。
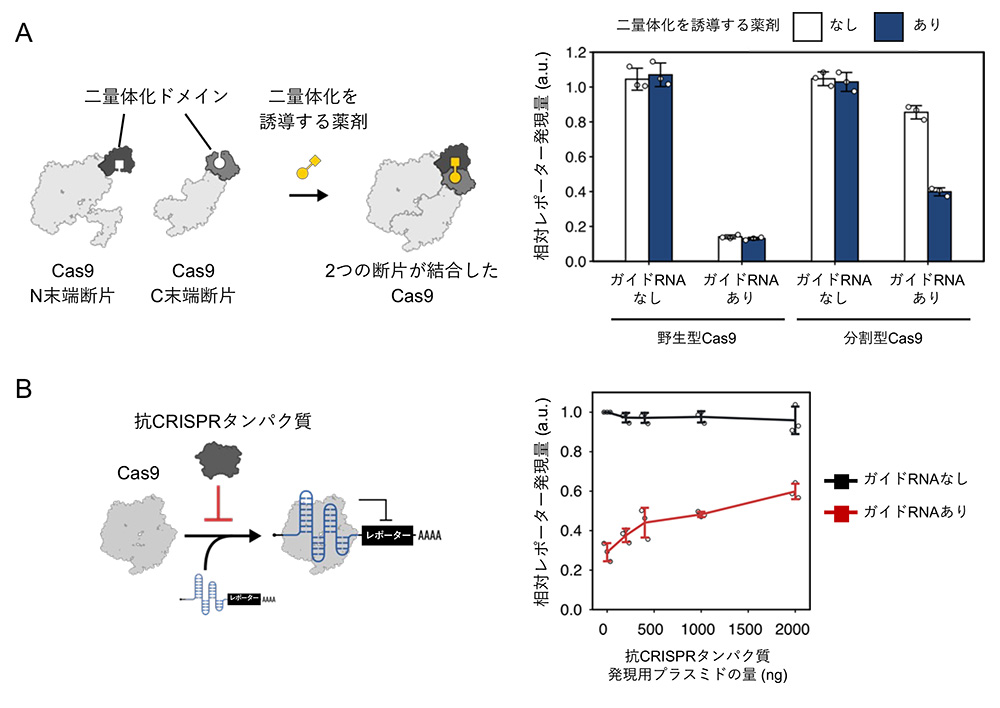
図3:薬剤と抗CRISPRタンパク質による翻訳の制御
A:Cas9断片を二量体化を誘導する薬剤を用いた翻訳制御
B:抗CRISPRタンパク質を用いたCas9応答型mRNAスイッチの翻訳制御
4)改変型Casタンパク質により転写・翻訳同時制御が可能な人工遺伝子回路を構築
Casタンパク質は標的DNAを切断するための「ハサミ」として利用可能なだけでなく、転写活性化ドメインや転写抑制ドメインを融合することで、任意の遺伝子の転写を制御するためのツールとしても利用されます。このように転写を制御できるように改変したCasタンパク質を用いて翻訳も制御できれば、一つのタンパク質で多くの機能を同時に制御することができるため、少ないパーツでより複雑な遺伝子発現制御ネットワークを構築することが可能になると考えられます(図4A)。
そこで、まず転写活性化ドメインを融合したCasタンパク質を用いて、転写と翻訳の両方を同時に制御できることを確かめました(図4B)。続いて、転写活性化ドメインを融合した2種類のCasタンパク質を用いて、転写と翻訳を制御することで、半減算器注6)と呼ばれる引き算を実行する回路を細胞内で構築しました。半減算器などの算術回路は、実際のコンピュータが作動するために必要な回路の一つです。そのため、この回路を細胞内で再現することは、哺乳類細胞コンピューティングを実現するうえで重要なステップとなります。
半減算器では、2種類の入力A、Bそれぞれが存在するとき (1) と存在しないとき (0) のパターンの違いによって、出力D (差)、Bo (桁借り)のパターンが変化します。出力のパターンを観察するために、出力D、Boの存在を青色蛍光タンパク質と緑色蛍光タンパク質の発現として、設計した回路をヒト細胞内に実装したところ、意図した通り、入力の存在に応じて蛍光タンパク質が出力し分けられ、引き算の実行結果を表現することができました (図4C)。
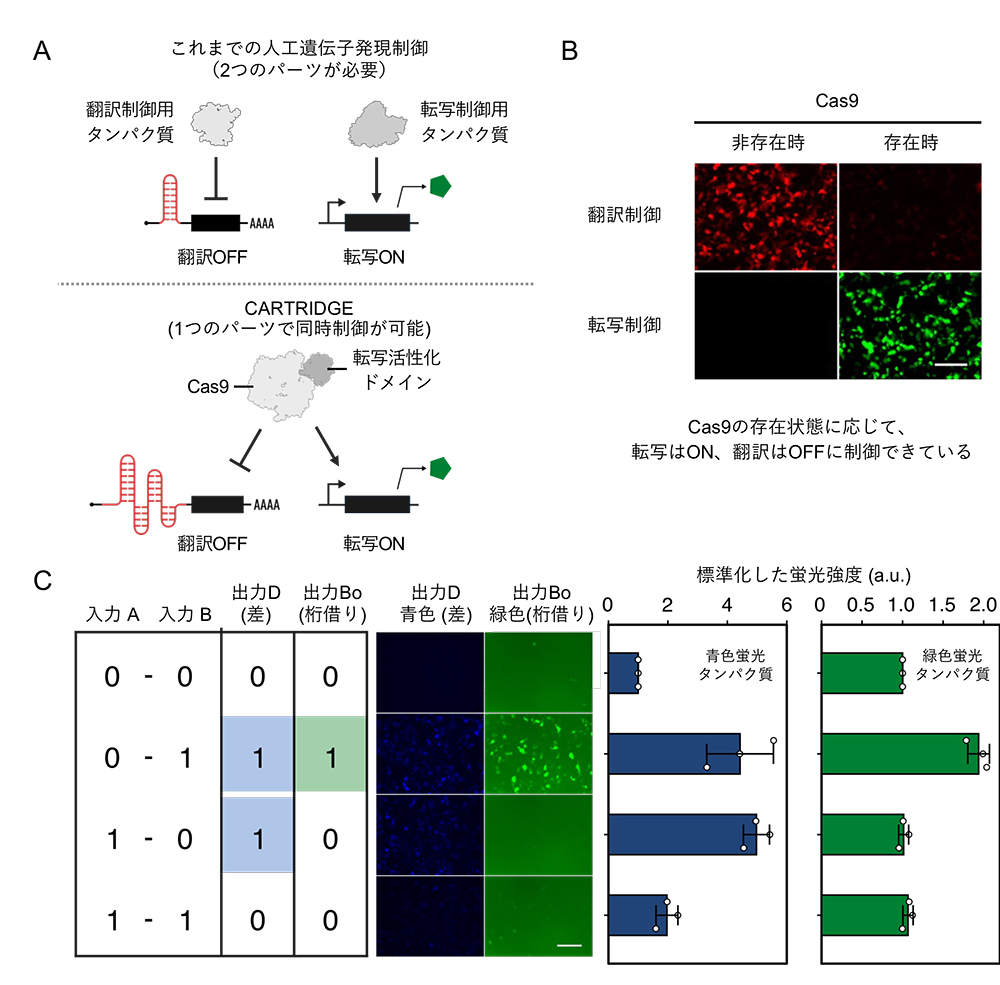
図4:Casタンパク質を用いた半減算器
4. まとめ
本研究では、通常ゲノム編集技術として利用されてきたCasタンパク質をmRNAスイッチ開発に転用することにより、遺伝子発現を微細に制御し、複雑な人工遺伝子回路の構築が可能となる手法CARTRIDGEを開発しました。CARTRIDGEは人工遺伝子回路の設計・構築において、以下のような利点があります。
(1) ゲノム編集研究の広がりにより、Casタンパク質や抗CRISPRタンパク質など多くのCRISPR関連遺伝子が継続的に発見されています。そのため、これからも翻訳制御に利用できるCasタンパク質の数が増加していきます。つまり、新規のCasタンパク質に対して、今回の方法を適用することでmRNAスイッチの数を継続的に増加させることが可能であると考えられます。
(2) CARTRIDGEは、さまざまなCRISPR技術を翻訳制御の仕組みとして再利用できます。今後のCRISPR関連遺伝子の発見やCRISPR技術の開発を再利用することで、目的遺伝子の発現を微調整したり、条件付きで制御したりできる新規の翻訳制御技術をより容易に開発できるようになります。
(3) CARTRIDGEは、1つのCasタンパク質で転写と翻訳を同時に制御できるため、より少ないパーツで高い情報密度と処理能力を実現できます。そのため、CARTRIDGEを用いることで「生体集積回路」が構築できるのではないかと考えています。
今後は、CARTRIDGEをさらに発展させ、より多彩な遺伝子発現パターンをプログラムできるようにし、容易に細胞コンピューティングを利用できる基盤を整えていきます。そして、哺乳類細胞に実装することで、外界の情報を感知して細胞自らが状況を判断し、適切な機能を発揮できる「細胞コンピュータ」の開発につなげたいと考えています。
5. 論文名と著者
- 論文名
Programmable mammalian translational modulators by CRISPR-associated proteins - ジャーナル名
Nature Communications - 著者
Shunsuke Kawasaki1,*,**, Hiroki Ono1,2,*, Moe Hirosawa1,*, Takeru Kuwabara3, Shunsuke Sumi1,2,
Suji Lee1,2, Knut Woltjen1, Hirohide Saito1,2,**
* : 共同第一著者
**: 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 京都大学医学部
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会・文部科学省 科学研究費補助金「特別推進研究」、「基盤研究S」、「若手研究」
- 日本学術振興会・文部科学省 「特別研究員制度」
- iPS細胞研究基金
7. 用語説明
注1)Casタンパク質
細菌や古細菌がウイルス感染から自身を守るための獲得免疫を担うタンパク質。例えば、Cas9と呼ばれるタンパク質はガイドRNAと結合することで、ウイルスゲノムDNAを認識して切断する。DNAを切断する以外にもRNAを切断できるCasタンパク質など、さまざまなCasタンパク質が発見されている。
注2)mRNAスイッチ
標的となるタンパク質やマイクロRNA (miRNA) が認識する配列を挿入することで、遺伝子発現をON/OFF制御する機能を付与した人工mRNA。標的タンパク質/miRNAの存在の有無を検知し、遺伝子の発現を抑制したり活性化したりすることができる。
注3)抗CRISPRタンパク質
バクテリオファージが細菌や古細菌の免疫機構であるCRISPR-Casシステムに対抗するために用いるタンパク質。その種類は多く、Casタンパク質とガイドRNAの相互作用を妨げたり、Casタンパク質のDNA切断活性を不活化したりするなどさまざまな機構でCRISPR-Casシステムを阻害する。
注4)人工遺伝子回路
複数の遺伝子スイッチを組み合わせることで、遺伝子の機能が発揮されるタイミング、強さに加えて、どの遺伝子を働かせるかも正確にコントロールできる。このような仕組みをコンピュータの回路に見立てて人工遺伝子回路と呼ぶ。人工遺伝子回路を搭載した細胞は、所望の機能を発揮し、命令通りの振る舞いをすることが期待される。
注5)合成生物学
生物が自然に持っている仕組みを人の手で再設計することで、生命の機能を拡張・制御したり、その仕組について理解を深めたりすることを目指している学問分野。
注6)半減算器
2つの入力 (被減数Aと減数B) の引き算を計算する回路。入力A、Bの差と桁借りの2つの出力がある。実際のコンピュータにおいて、この回路は、2種類の入力A、Bが存在するとき (1) と存在しないとき (0) の情報をもとに入力A、Bの差を計算する。入力A、Bが共に0のときは、0-0で差は0、桁借りも0となる。入力A、Bが共に1のときも同様に、1-1で差が0、桁借りも0となる。しかし、入力A、Bがそれぞれ0、1のときは、0-1で差は1となり、桁借りは1となる。また、入力A、Bがそれぞれ1、0のときは、1-0で差は1となるが、桁借りは0となる。