2024-01-23 基礎生物学研究所,生命創成探究センター
自然科学研究機構 基礎生物学研究所/生命創成探究センター 定量生物学研究グループの杉山博紀 研究員、後藤祐平 助教、近藤洋平 助教、青木一洋 教授らは、フランス国立科学研究センターのDamien Coudreuse Group Leaderとの共同研究により、細胞周期進行に重要な働きを果たすキナーゼ(リン酸化酵素)であるCDK(Cyclin-dependent kinase、 サイクリン依存性キナーゼ)の活性をリアルタイムに1細胞レベルで可視化するバイオセンサー(Eevee-spCDK:イーブイ エスピーシーディーケー)を開発し、CDKの活性がある閾値に達したときに細胞周期進行が誘導されることを直接的に検証することに成功しました。本成果は、米国の学術誌「Developmental Cell」2024年2月26日号に掲載予定で、1月15日に先行公開されました。
本研究成果のまとめ
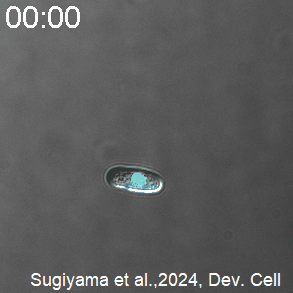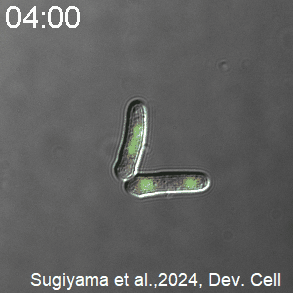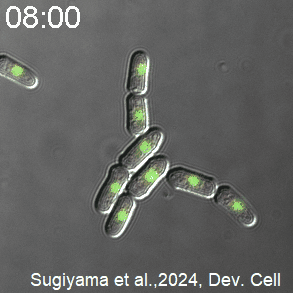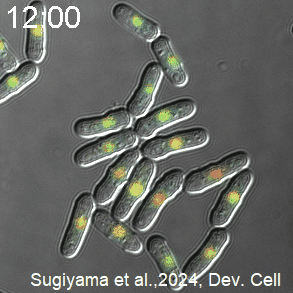
開発したCDK活性を測定するセンサーを発現した分裂酵母の様子。CDK活性が高いときを赤く、低いときを青く、疑似カラーで表示している。分裂直前にCDKが急激に活性化し、分裂直後に不活性化する。
【研究の背景】
細胞は、ゲノムDNAを複製し、細胞分裂とともに娘細胞へと正確に分配する細胞周期を繰り返すことで増殖していきます。細胞周期を正確に行うためには、適切なタイミングに適切な順序で適切な細胞機能が発揮される必要があります。真核生物間で進化的に保存されているキナーゼ(リン酸化酵素)であるCDK(Cyclin-dependent kinase、 サイクリン依存性キナーゼ)*1は細胞周期の主要制御因子であり、様々な制御因子によりその活性を緻密にコントロールされています。分裂酵母(Schizosaccharomyces pombe)は、CDKを一種類しか持たず、細胞周期進行の制御ネットワークが比較的単純であるため、真核生物間で保存された細胞周期制御機構を調べるための強力なモデル生物です。生化学や遺伝学的なアプローチによりCDKを制御する因子の役割やそれらの相互作用は大部分が明らかになってきましたが、それら従来の解析手法には時間・空間分解能に難があり、細胞周期の制御機構はリアルタイム・1細胞レベルの解像度ではあまり議論されてきませんでした。特に、タンパク質の量の変動はたとえば蛍光タンパク質との融合によって顕微鏡下でも比較的簡単に計測できますが、タンパク質の「活性」を計測するのは容易ではありません。
今回、研究グループは、CDKが「生きた分裂酵母の中で、いつ・どのように活性化されるのか」を明らかにすることが重要であると考え、CDKの活性によって蛍光特性が変化するようなバイオセンサーを新たに設計しました。このバイオセンサーを分裂酵母に導入し、様々な培養条件や変異株で、CDK活性の動態を調べました。
【研究の成果】
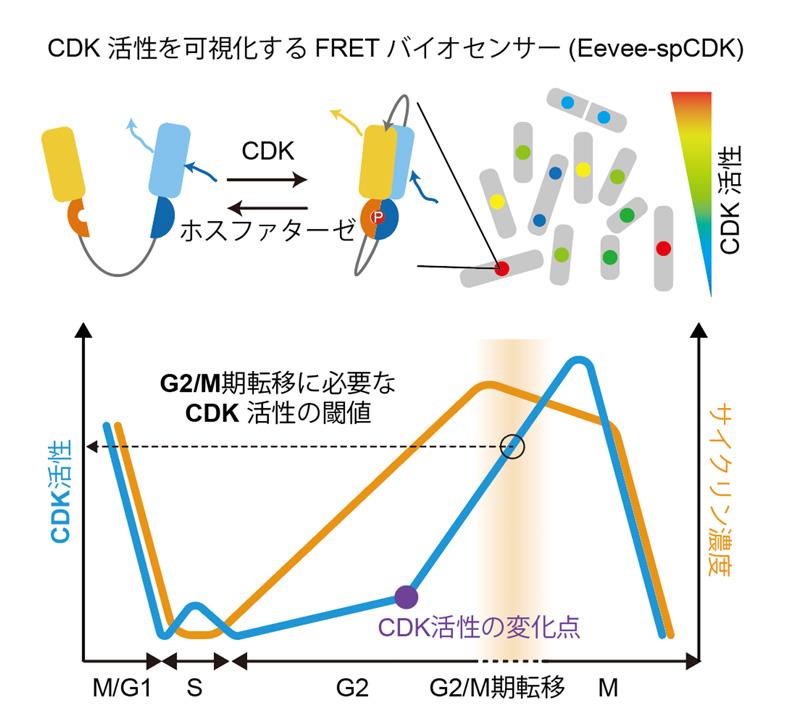
本研究グループが開発したバイオセンサーは、フェルスター共鳴エネルギー移動(FRET)*2と呼ばれる現象を利用したものです。FRETは、ある二つの蛍光タンパク質が適切な配向で近接したときにのみ生じます。研究グループは、二種類の蛍光タンパク質(黄色蛍光タンパク質YFP、シアン色蛍光タンパク質CFP)、リン酸化ペプチドに結合するリガンドドメイン、CDKによるリン酸化を受ける基質センサードメインが、EVリンカーと呼ばれる柔軟性のあるリンカー配列を介してつなげられたFRETバイオセンサーを設計しました(図1A左)。活性化したCDKによってセンサードメインがリン酸化されると、リガンドドメインがセンサードメインと結合し、二つの蛍光タンパク質が近接することでFRETが起こります(図1A右)。
CDKによるリン酸化を効率よく受けるセンサードメインを探索するために、CDKによってリン酸化される基質タンパク質を網羅的に調べた過去の研究を参考に基質候補を選定しました。14個の基質候補のうちの一つが、細胞周期の進行に伴って最大40%程度のFRET効率の変化を示すことがわかりました(図1B, C)。リン酸化されると予想されたセンサードメイン内のセリン・スレオニン残基を、アラニンに置き換えた非リン酸化型のセンサーではこのFRET効率の変化が消失したことから、このFRET効率の変化は、バイオセンサーのリン酸化によるものであることが確かめられました。研究グループは、このバイオセンサーをEevee-spCDK(イーブイ エスピーシーディーケー)と名付けました。これは、図1Aに示したバイオセンサーの設計が、既報のEevee backbone structure*3を利用したものであることに由来しています。
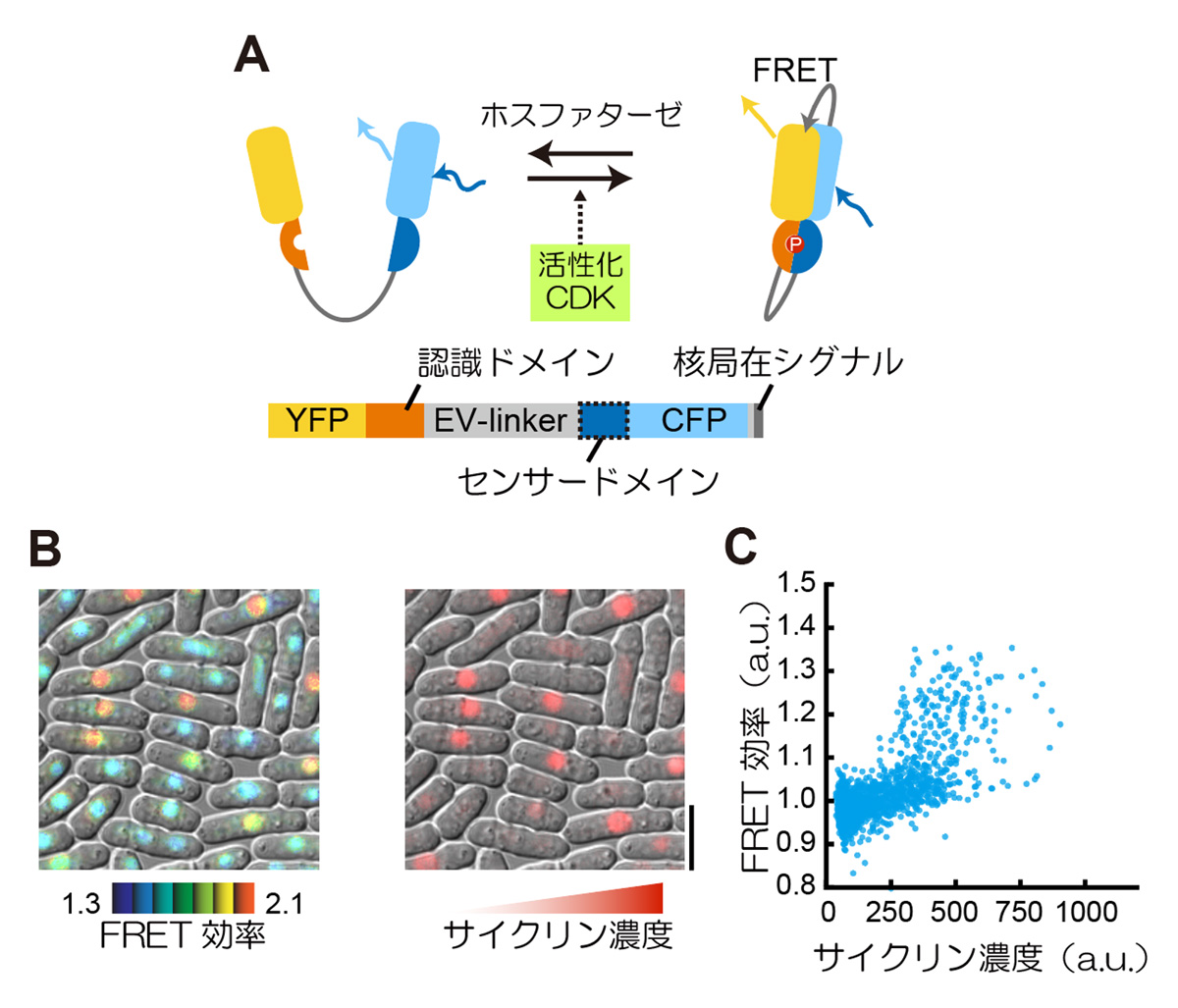 図1. CDK活性を可視化するバイオセンサー(Eevee-spCDK)の設計と開発。
図1. CDK活性を可視化するバイオセンサー(Eevee-spCDK)の設計と開発。
(A)Eevee-spCDKの模式図。CDKによりセンサードメインがリン酸化されると、リガンドドメインがセンサードメインに結合し、二つの蛍光タンパク質間の距離が近くなることでFRET効率が上昇する。ホスファターゼによりセンサードメインが脱リン酸化されると再びFRET効率は低下する。(B)Eevee-spCDKのFRET効率が細胞周期進行と相関するかを測定した。Eevee-spCDKのFRETの効率(左)は青から赤への疑似カラースケールで示している。同時にサイクリン濃度を可視化(内在性のサイクリンに赤色蛍光タンパク質を融合)し、細胞周期進行の指標としている(右)。スケールバー:10 μm。(C)各細胞におけるEevee-spCDKのFRET効率とサイクリン濃度を定量したプロット。サイクリン濃度が上がるにつれてFRET効率が変動しており、Eevee-spCDKはCDK活性を測るバイオセンサーの候補となることがわかる。
次に、Eevee-spCDKを使って、生きた分裂酵母のCDK活性の時間的な変動を1細胞レベルで細胞周期を通して計測してみました(図2A)。この実験では、内在性のサイクリンを赤色蛍光タンパク質と融合させて、その相対的な濃度も単一細胞で同時に計測しました。この計測を通じて興味深い2つの観察結果が得られました。
1.サイクリン濃度は時間とともに直線的に増加するが(図2B 橙線)、CDK活性の増加はゆっくりとした段階と、素早く増加する2つの段階からなる(図2B 青線)。
2.細胞周期のS期にもCDKが一時的に活性化される(図2B 三角印)。
1の観察結果である2段階のCDK活性化は、これまで数理シミュレーションによって予想されていた、CDK制御ネットワークの双安定性*4を観察したものであると考えられます。また、2の観察結果である細胞周期S期での一過的なCDKの活性化は、これまでの生化学的な研究において示唆されていましたが、細胞周期非同調の細胞で初めて直接観察されました。
次に、酸化刺激や浸透圧刺激など細胞周期に影響する外的ストレスにさらされた細胞のCDK活性を測定しました。いずれのストレスに対してもCDK活性は低下しましたが、その低下するタイミングや、細胞がストレスに適応しCDKが再び活性化するタイミングが異なることが可視化されました。このようにEevee-spCDKは、様々な環境に置かれた細胞の中でCDK活性が示す動態を、感度・精度よく把握可能にする、有用なバイオセンサーであると考えられます。
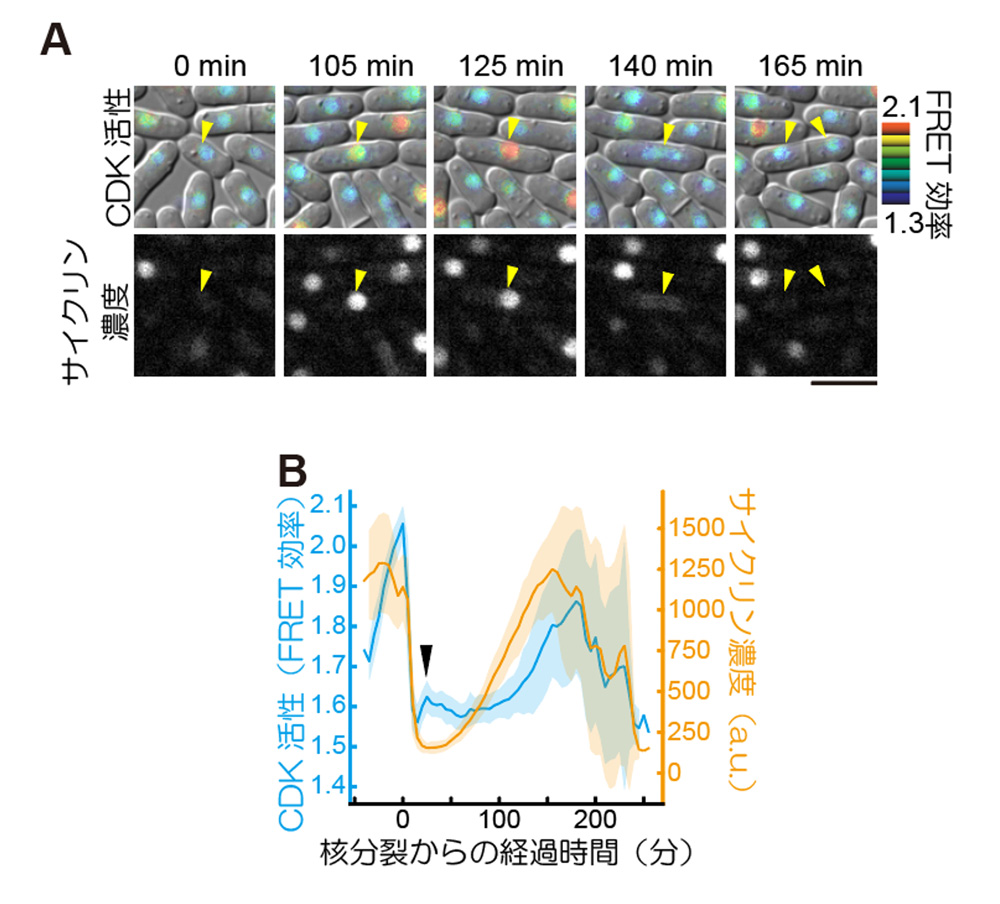 図2. Eevee-spCDKを用いた生細胞イメージング。
図2. Eevee-spCDKを用いた生細胞イメージング。
(A)Eevee-spCDKを導入した細胞群を5分おきに計測した実験における代表的な撮影像。Eevee-spCDKのFRET効率によって測られたCDK活性を青から赤への疑似カラースケールで示し(上)、その時の相対的なサイクリン濃度をサイクリンに融合した赤色蛍光タンパク質の蛍光輝度値で示した。写真上部の時間は、測定開始からの時間を表す。また、このタイムラプスイメージングにおける同一の細胞を、黄色の三角によって追跡している。スケールバー:10 μm。(B)各細胞ごとに測られたCDK活性とサイクリン濃度の時系列データの平均(実線)と標準誤差(影)。各時系列データは、その細胞の核分裂したタイミングからの経過時間によって示されている。図内の黒三角は、細胞周期のS期に対応する部分で、この時期にCDKがわずかに活性化している様子が読み取れる。
そこで研究グループは、Eevee-spCDKを用いて、細胞周期進行がどのようなCDK活性の動態によって担われているのか、という問いに挑むことにしました。特に、細胞が分裂するM期に入るタイミング(G2/M期転移)がどのようにして制御されるかは、細胞にとって決定的に重要な問題です。分裂酵母では細胞長を一定に保つために、細胞周期の長さを制御する機構が存在し、短く生まれた細胞は次の細胞周期の時間が長くなります。そこで今回、pom1という遺伝子を欠失した分裂酵母(pom1Δ)のCDK活性を計測しました。通常分裂酵母は、娘細胞が均等に分裂しますが、pom1Δでは、非対称分裂が起こり短い細胞と長い細胞が生まれます(図3A)。研究グループは、この変異体を用いて、初期の細胞長に違いのある遺伝的には同一の2つの個体において、CDK活性を観察しました。予想通り、初期細胞長の短い細胞は、初期細胞長の長い細胞よりも次の分裂までの時間は長いことを確認しました。興味深いことに、短い細胞でも長い細胞でも、サイクリン濃度は同じ速度で増加し、その結果として、G2/M期転移期には、短い細胞のほうがサイクリン濃度が高くなることがわかりました(図3B)。しかしG2/M期転移でのCDK活性を比べると、両群の間に統計的に優位な差は認められませんでした(図3C)。これらの結果は、G2/M期転移の制御において、先行研究で特に重要性が指摘されていたサイクリン濃度だけでなく、CDKの翻訳後修飾などによる制御機構も含む形で包括的に議論する必要性を強く示唆しています。
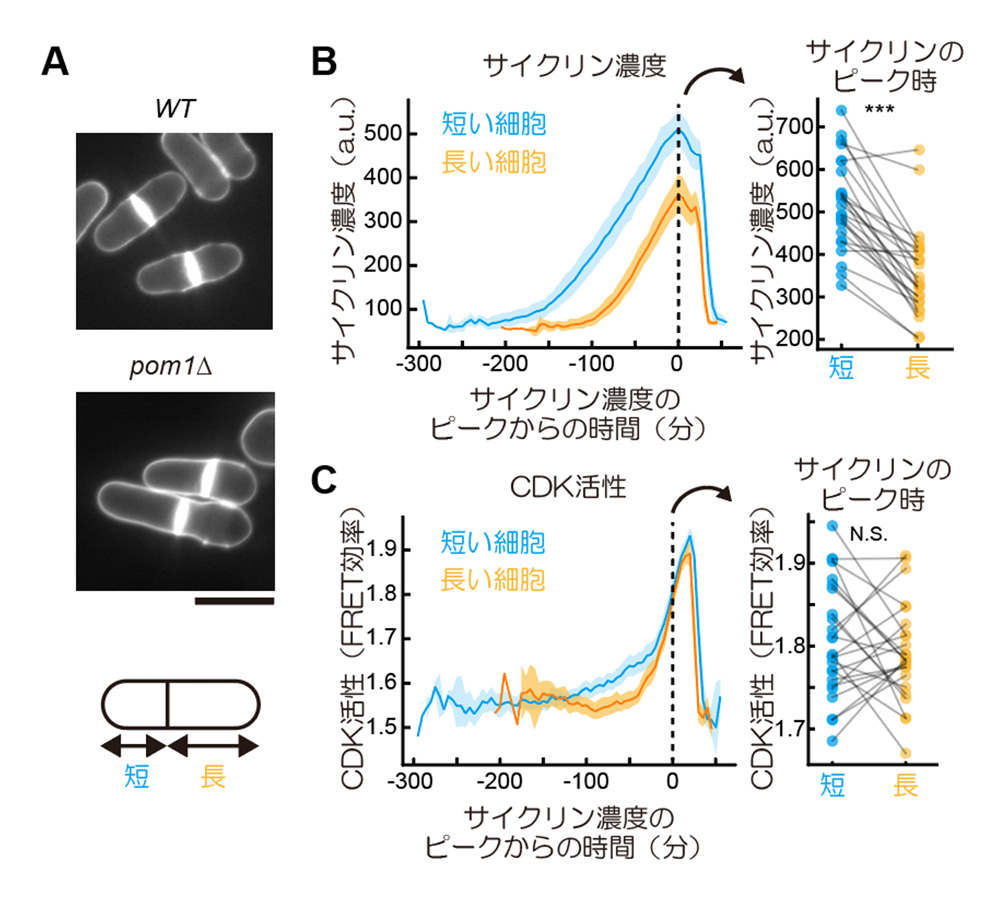 図3. pom1Δにおける細胞長の異なる娘細胞でのCDK活性の測定。
図3. pom1Δにおける細胞長の異なる娘細胞でのCDK活性の測定。
(A)野生株とpom1Δ株の比較。細胞壁と特異的に結合する蛍光物質(Calcofluor white)で細胞の輪郭を可視化した。pom1Δでは分裂面が中央からずれ、非対称に分裂する。スケールバー:10 μm。
(B、C)左のグラフは、pom1Δの長短それぞれの細胞で分類した、サイクリン濃度(B)とCDK活性(C)の時系列データの平均(実線)と95% 信頼区間(影)を示している。各時系列データは、その細胞のサイクリン濃度がピークに達したタイミング(G2/M期転移)からの経過時間によって示されている。右図では、グラフ内のひとつの丸が一細胞から得られたデータに対応し、黒い線は娘細胞をつないでいる。また図内の***は、二群間でのpaired T-testにおける統計検定量が0.05以下であったことを示し、N.S.は統計的優位性が認められなかったことを示す。
次に研究グループは、CDKに抑制的なリン酸化を入れるWee1キナーゼと、その抑制的リン酸化を解除するCdc25ホスファターゼという二つのCDK活性制御因子に着目しました。Wee1とCdc25は、CDKとの間でそれぞれ正のフィードバックループを形成しており、G2/M期転移の重要な分子基盤として注目されてきました(図4A)。これらの二つの遺伝子の発現量を変動させることでG2/M期転移でのCDK活性がどのような影響を受けるのかを調べました。発現量変動の極端な例として、Wee1とCdc25を致死となる一歩手前まで過剰発現させた細胞を選び、CDK活性を計測しました。その結果、各細胞株間で細胞周期を通じてCDK活性の違いが見られたにもかかわらず、G2/M期転移のタイミングでは株間でのCDK活性の違いが顕著に少なくなることがわかりました(図4B)。CDK活性に直接影響する摂動を与えても、G2/M期転移付近ではCDK活性がそろうということは、細胞がCDKの活性を直接参照してG2/M期転移のタイミングを決めていることを示唆しています。先のpom1Δを用いた実験でもG2/M期転移でのCDK活性は異なる細胞長の娘細胞間で一定であり、このG2/M期転移におけるCDK活性の頑健性は広範な摂動に対して成り立つと推測されました。これらの結果は、細胞周期のG2/M期転移はCDK活性の閾値によって定まるという仮説を強く裏付ける直接の実験的証拠です。
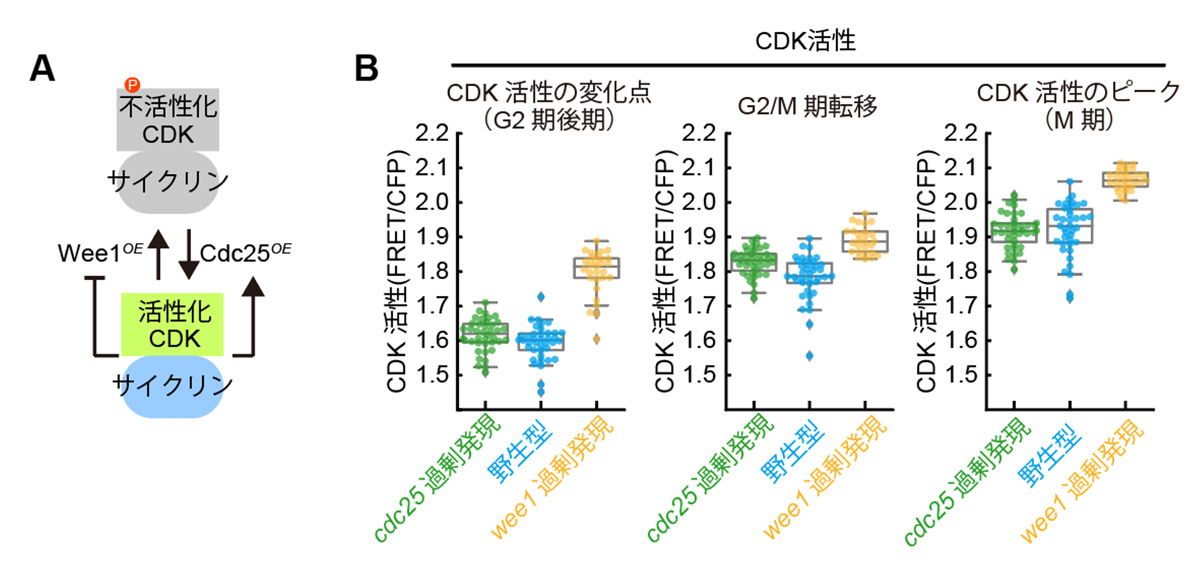 図4. Wee1とCdc25を過剰発現した分裂酵母株におけるCDK活性の測定。
図4. Wee1とCdc25を過剰発現した分裂酵母株におけるCDK活性の測定。
(A)Wee1とCdc25がCDKを制御するメカニズムの概念図。Wee1とCDKは互いに不活性化し合い、Cdc25とCDKは互いに活性化し合うことで、それぞれフィードバックループを形成している。(B)Wee1またはCdc25を致死とならない範囲で最大限過剰発現した株それぞれについての、重要な細胞周期イベントにおけるCDK活性。グラフ内のひとつの丸が一細胞から得られたデータに対応する。
最後に、CDKは真核生物間で進化的によく保存されていることから、Eevee-spCDKは分裂酵母以外の細胞でもCDKの活性を測定できるのではないかと推測しました。ヒト培養細胞にEevee-spCDKを導入したところ、細胞周期依存的なCDKの活性化動態が観察されました(図5)。ヒト培養細胞には、分裂酵母と違い、複数のCDKが発現しています。各CDKの選択的阻害剤を用いた実験から、Eevee-spCDKがヒト培養細胞では主にCDK1とCDK2の活性を反映してFRET効率を変化させていることが示唆されました。このように、Eevee-spCDKは分裂酵母のために設計されたものですが、その応用範囲は分裂酵母に限定されず、様々な真核細胞でのCDK活性を測定する有用なツールであることが示唆されました。
 図5. ヒト培養細胞にEevee-spCDK導入して計測したCDK活性。CDK活性の指標となるFRETの効率を青から赤への疑似カラースケールで表示している。スケールバー:20 μm。
図5. ヒト培養細胞にEevee-spCDK導入して計測したCDK活性。CDK活性の指標となるFRETの効率を青から赤への疑似カラースケールで表示している。スケールバー:20 μm。
【本研究の課題と今後の展望】
本研究では、細胞周期進行の制御を司るCDKの活性を生きた分裂酵母の中で感度・精度よく可視化する、FRETの原理に基づくバイオセンサー(Eevee-spCDK)を開発することに成功しました。Eevee-spCDKを用いて、分裂酵母の様々な変異株におけるCDK活性の変動とG2/M期転移のタイミングを計測することで、G2/M期転移がCDK活性の閾値によって誘導されるという仮説に、直接的な実験的証拠を与えることができました。
しかし、今回開発したEevee-spCDKには、現時点ではいくつか技術的な制限もあります。たとえば、今回のバイオセンサーでは、異なるサイクリンと結合したCDKの活性や、哺乳類細胞におけるCDK1とCDK2の違いなどを区別することが困難です。それぞれのCDK-サイクリン複合体に特異的な結合ドメインなどを用いることにより、バイオセンサーの特異性を向上できる可能性があります。また、CDKがリン酸化する基質はきわめて多様であり、同じ細胞周期の段階でもそのリン酸化状態は必ずしも同一ではありません。Eevee-spCDKが明らかにするCDK活性自体の変動と相補するように、こうした各基質の個別のリン酸化状態について、たとえばリン酸化プロテオーム解析など、他の網羅的な検討結果を参照することで、より包括的な細胞周期制御の理解が進むと考えられます。
こうした技術的な困難の一方で、Eevee-spCDKは、CDK活性の時間変動のみならず、空間的な調節について解像度高く把握する手法に発展すると期待できます。本研究では、Eevee-spCDKに核局在シグナルを付与することで、CDKが主として局在する核の中のCDK活性を計測しました。一方で、CDKは細胞周期進行に応じて局在変化することが知られており、Eevee-spCDKの局在シグナルを自由に取り換えることで、たとえば細胞質やspindle pole body*5など、核以外にも興味ある細胞小器官などに局在化させ、その領域特有のCDK活性を計測できることが期待されます。このように、高い時空間解像度でのCDK活性の可視化への道を拓くEevee-spCDKは、CDKを通じた細胞周期の動的な制御原理を明らかにする強力な手段として、今後のさらなる研究を推進することが期待できます。
【用語解説】
*1 CDK: サイクリン依存性キナーゼ、細胞周期進行に伴って発現量が増減するサイクリンと複合体を形成することで活性化する細胞周期制御キナーゼ。
*2 FRET: フェルスター共鳴エネルギー移動、Förster Resonance Energy Transfer。ある二つの発色団が近接し適切な配向にあるとき、片方の励起された発色団(ドナー)が蛍光を発して基底状態へと戻る代わりに、その励起エネルギーが直接もう片方の発色団(アクセプター)へと移動する現象。FRETが起こると、励起したドナーの蛍光ではなく、アクセプターの蛍光が観察されるようになる。
*3 Eevee backbone structure: Extension for enhanced visualization by evading extra-FRET。研究グループの先行研究において開発された分子内のFRETを利用したバイオセンサーの汎用的な基本骨格の名称。たとえば、PKA、ERK、JNK、EGFR/Abl、Ras、 Rac1、ARSK,、S6K、Akt、PKCなど多くのバイオセンサーの開発に利用されている。(Komatsu et al., 2011, DOI:10.1091/mbc.e11-01-0072)
*4 双安定性: あるシステムが、ある一定の条件下で、異なる2つの安定な状態をとりうる性質。
*5 spindle pole body (SPB): スピンドル極体。酵母細胞における、微小管の形成中心であり他の真核生物での中心体に相当する。CDKのSPBへの局在移行が細胞周期進行において重要であることが知られている。
【発表雑誌】
雑誌名 Developmental Cell
掲載日 2024年1月15日 先行公開 (2024年2月26日号掲載予定)
論文タイトル: Live-cell imaging defines a threshold in CDK activity at the G2/M transition
著者: Hironori Sugiyama*, Yuhei Goto*, Yohei Kondo, Damien Coudreuse, and Kazuhiro Aoki (*同等に貢献)
DOI: https://doi.org/10.1016/j.devcel.2023.12.014
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの杉山博紀 研究員、後藤祐平 助教、近藤洋平 助教、青木一洋 教授と、フランス国立科学研究センターのDamien Coudreuse Group Leaderによる国際共同研究グループの成果です。
【研究サポート】
本研究は、文部科学省日本学術振興会科学研究費助成事業(18H02444, 19H05798, 22H02625, 19K16050, 22K15110, 21J01354, 22K15115)の支援のもと行われました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 定量生物学研究部門
生命創成探究センター 定量生物学研究グループ
教授 青木 一洋 (アオキ カズヒロ)
【報道担当】
自然科学研究機構 基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 研究戦略室