2024-02-21 理化学研究所,ヒューマン・テクノポール
理化学研究所(理研)生命医科学研究センター トランスクリプトーム研究チームの髙橋 葉月 研究員、ハルシタ・シャルマ 研究員(研究当時、現 客員研究員)、ピエロ・カルニンチ チームリーダー(ヒューマン・テクノポール ゲノミクス研究センター センター長)らの国際共同研究グループは、機能性アンチセンスロングノンコーディング(lnc)RNA[1]「SINEUP(サインアップ)[2]」の機能ドメイン(領域)として働くレトロトランスポゾンSINE[3]の特徴的なRNAの配列と構造が、マウスとヒトに共通して存在し、タンパク質合成を促進する重要な役割を担っていることを発見しました。
今回、国際共同研究グループは、アンチセンスlncRNAに埋め込まれているレトロトランスポゾンSINEをマウス、ヒトから18種類抽出し、細胞内で形成されるRNAの構造とその構造がもたらすSINEUP機能の役割を調査しました。その結果、ほとんどのSINEが共通の機能構造を細胞内で保持しており、標的のmRNAから合成されるタンパク質の量に重要な影響を与えていることが分かりました。
さらに、機能構造を持たないRNAに人工的に機能構造を付加することで、標的とするタンパク質の合成が向上できることを示しました。
本研究成果は、アンチセンスlncRNAの未知の機能を解明する研究の礎となることが期待され、さらにタンパク質の機能を一部失うことにより発症するハプロ不全[4]を伴う希少遺伝性疾患の治療に向けた医薬品開発に貢献することが期待されます。
本研究は、科学雑誌『Nature Communications』オンライン版(2月21日付:日本時間2月21日)に掲載されました。
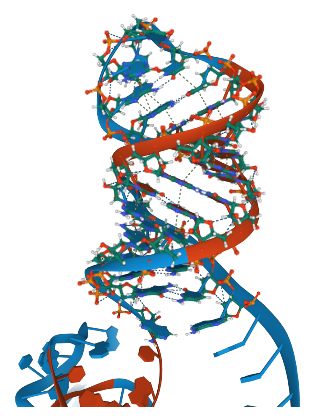
SINEUPの機能ドメインSINEのSL1構造
背景
ゲノムに繰り返し存在するレトロトランスポゾンSINEは、植物からヒトまで進化的に保存されている遺伝子ですが、2000年代前半までは機能を持たない遺伝子と認識されてきました。繰り返される遺伝子地図の場所やSINE配列の長さに共通点が少なく、遺伝子地図上にジャンク(がらくた)として存在していました。
しかし、国際研究コンソーシアムFANTOM[5]は、SINEなどのレトロトランスポゾンを持ったアンチセンスlncRNAがマウスの特定の細胞で大量に発現していること、SINEがストレスにさらされた細胞内で特定のタンパク質の合成を増やす手助けをしていることを次々と発見しました注1)。カルニンチチームリーダーらは、ヒトのSINEにもタンパク質の合成を向上する機能があることを報告し注2)、それらアンチセンスlncRNAをSINEUPと名付け、生体内での作用機序の解明を進めてきました注3-5)。
SINEUPは標的タンパク質の合成を向上することができるため、タンパク質合成が遺伝的に一部欠損する、ハプロ不全を伴う希少遺伝性疾患の治療への応用が進められています。しかし、SINEUPの詳細な作用機序にはいまだ多くの謎が残されています。
そこで本研究ではマウスとヒトに存在するレトロトランスポゾンSINEがどのような特徴を持ってSINEUPに埋め込まれ、機能性分子として働いているのか、細胞内でのRNA配列、構造、その複合体の共通点を調査し、解析しました。
注1)2012年10月25日プレスリリース「タンパク質合成を促進するアンチセンスRNAを初めて発見」
注2)2016年10月28日プレスリリース「タンパク質合成を促進する「ジャンク」と呼ばれていたRNA」
注3)2018年3月15日プレスリリース「翻訳を促進するアンチセンスRNAの機能解析」
注4)2020年8月6日プレスリリース「タンパク質を増やす秘訣に迫る」
注5)2020年11月2日プレスリリース「タンパク質を増やすSINEUPのメカニズムを解明」
研究手法と成果
まず、マウスで発現するアンチセンスlncRNAに埋め込まれているレトロトランスポゾンSINEを18種類選択し、SINEUP RNAの機能ドメインに挿入しました。その後、ヒトの細胞に強制発現させ、標的であるGFPmRNAの翻訳能力を向上させ、GFPタンパク質の合成量が増えるかを確認しました。その結果、15種類のレトロトランスポゾンSINEがSINEUPとしての機能を有することを示しました。それら15種類のSINEのRNA配列を調査しましたが、特徴的な共通点は見いだせませんでした。
次に、細胞内で形成されるRNAの2次構造を網羅的に測定できるicSHAPE法[6]を用い、15種類のマウスレトロトランスポゾンSINEとすでにSINEUPの機能を有することが知られている1種類のヒトSINEのRNAの構造を調べたところ、すべてのレトロトランスポゾンSINEで同一のステムループ構造(SL1)を形成することが判明しました(図1)。
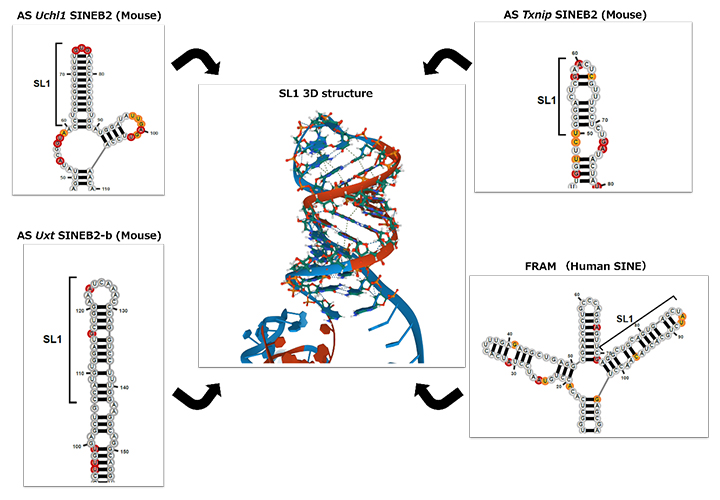
図1 SINEUP機能ドメインSINEのSL1構造
SINEの2次構造をicSHAPE法で解析し比較したところ、図1に示した3種類を含む15種類全てのマウス(Mouse)のレトロトランスポゾンSINEがヒト(Human SINE)と同一のステムループ構造(SL1)を形成していた。さらに、3次構造(3D:図中央)を予測すると、同じような立体構造を形成していた。
さらに、そのステム(幹)部分には、グアニン(G)とシトシン(C)が他の構造よりも多く含まれており、SINEUPとして機能しなかったレトロトランスポゾンの一種であるSINE B2(AS Gadd45α)にステムループ構造を人工的に付加するとSINEUPとして機能することが分かりました。従って、この特徴的なステムループ構造がSINEUPの機能に必要だと考えられます。
レトロトランスポゾンSINEの2次構造は、細胞質や細胞核で異なる部位が存在する一方、ステムループ構造部位はどちらの場所でも構造を強く保っていました。また、SINEUPは、リボソームRNAと直接結合していることが示されたため、lncRNAはその構造を変化させたり、保ったりする場所を自ら決定し、タンパク質を結合させたり離脱させたりすることで、細胞内で標的mRNAの翻訳を助けるガイド的な役割を担っていると考えられます(図2)。
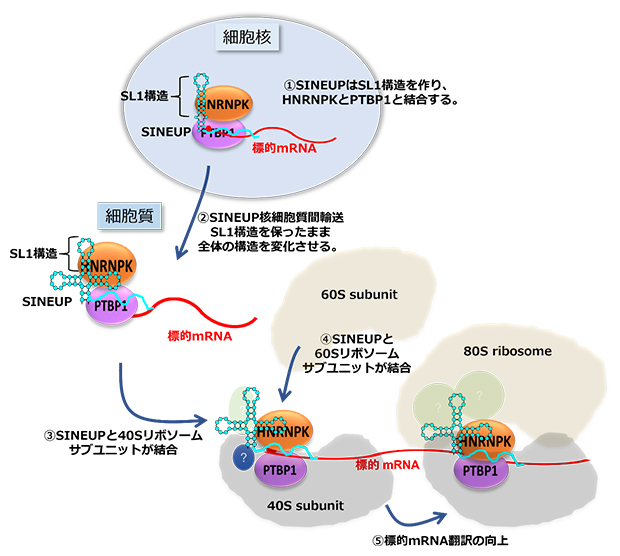
図2 SINEUPの構造と機能の役割
細胞核に存在するSINEUPはその機能ドメインレトロトランスポゾンSINEのSL1と呼ばれる構造(水色)にRNA結合タンパク質HNRNPKとPTBP1を結合し(①)、細胞質に輸送する(②)。細胞質内でSINEUPのSINEはSL1構造を保ったまま、40Sリボソームサブユニットに結合し(③)、次に60Sリボソームサブユニットに結合する(④)ことで、標的mRNA翻訳を促進し、タンパク質合成を向上させる(⑤)。
今後の期待
レトロトランスポゾンSINEを含め、生体内に発現する多くのノンコーディングRNAの機能はいまだ解明されておらず、その数の多さや共通性の欠如から同定の作業に膨大な時間と労力を必要としています。本研究では、18種類のノンコーディングRNAに含まれるSINEの共通構造や機能を特定しましたが、同様の実験手法を使用することで、機能が未知であるノンコーディングRNAの共通構造やその特徴付けが今後可能になると考えられます。
本研究では、人工的に作成したSINEの機能構造をアンチセンスRNAに新たに挿入し、標的タンパク質の合成を向上させることに成功しました。今後は、同定したSINEの機能構造を使用し、ハプロ不全疾患などのRNA医薬品開発に応用できると期待しています。
補足説明
1.アンチセンスロングノンコーディング(lnc)RNA
DNAの配列として書かれた遺伝情報はRNAに転写される。タンパク質をコードするメッセンジャーRNA(mRNA)のように意味を持つ配列として転写されたRNAをセンスRNAと呼ぶのに対し、その相補的な配列を持つRNAをアンチセンスRNAと呼ぶ。ロング(長鎖)は200塩基以上のRNAのことであり、ノンコーディングはタンパク質をコードしないRNAのことである。
2.SINEUP(サインアップ)
マウスのUchl1遺伝子のアンチセンスRNAがUchl1タンパク質の合成を促進する現象が発見されたのをきっかけに見いだされた、新しいタイプのノンコーディングRNA。レトロトランスポゾンSINE(下記[3]参照)の配列がmRNA翻訳を促進する機能領域(ED:Effector Domain)として埋め込まれており、標的mRNAと相補的なアンチセンス配列が結合領域(BD:Binding Domain)として埋め込まれており、これら二つのドメインで構成される。任意の標的mRNAからのタンパク質合成を促進するツールとして使うことができるため、研究用試薬やタンパク質製造ツールから核酸医薬まで、幅広い応用が進んでいる。SINEUPは、SINE element-containing translation UP-regulatorの略。
3.レトロトランスポゾンSINE
多種あるレトロトランスポゾンの一種で、SINEはその中でもサイズが短いために短鎖散在反復配列とも呼ばれる。レトロトランスポゾンはゲノムの特定の塩基配列がコピーされ、再びゲノムに挿入されたもの。生物進化の過程において、ある生物のゲノムの特定の場所にレトロトランスポゾンSINEが挿入されると、これが子孫に受け継がれる。このことから、多数の生物のレトロトランスポゾンSINEを分析すると系統関係が分かる。レトロトランスポゾンは長年「ジャンクDNA」とも呼ばれてきたが、近年それ自体がRNAとして転写されたり、lncRNA内に埋め込まれて転写されたりして機能性分子として働くことが報告されている。SINEUPはレトロトランスポゾンSINEがlncRNAに埋め込まれて機能性RNAとして転写されるため、後者に当たる。SINEは、short interspersed nuclear elementの略。
4.ハプロ不全
2倍体の生物であるヒトは、二つある対立遺伝子のうち一つが正常であれば十分な量のタンパク質が作られ、多くの場合は表現型として影響が現れない。これに対し、正常な遺伝子が一つだけでは十分なタンパク質量が生産できず、生体機能を維持できない現象をハプロ不全と呼ぶ。このとき、正常な遺伝子から転写されるmRNAを標的とするSINEUPを細胞に導入すれば、タンパク質の合成量が増加し機能を回復できると期待される。
5.FANTOM
理研が主催する国際研究コンソーシアム。理研のマウスゲノム百科事典プロジェクトで収集された完全長cDNA(complementary DNA:相補的DNA)の機能注釈(アノテーション)を行うことを目的に、2000年に結成された。その成果は、iPS細胞(人工多能性幹細胞)の樹立研究など生命科学の広い分野に貢献している。現在のFANTOM6には20カ国、100以上の研究機関が参加し、ノンコーディングRNAの網羅的な機能解析に取り組んでいる。
6.icSHAPE法
生細胞内に発現するRNAの2次構造を1塩基ごとにトランスクリプトームレベルで決定する技術。方法としては、RNAの1本鎖領域をNAI-N3で修飾し、逆転写反応により修飾された部位をcDNAとして回収する。次世代シーケンサーとバイオインフォマティクスの技術を組み合わせ、修飾部位を解読することで、標的RNAの2次構造を決定する。icSHAPEは、in vivo click selective 2-hydroxyl acylation and profiling experimentの略。
国際共同研究グループ
理化学研究所 生命医科学研究所トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
(ヒューマン・テクノポール(イタリア)ゲノミクス研究センター センター長)
研究員 髙橋 葉月(タカハシ・ハヅキ)
研究員(研究当時)ハルシタ・シャルマ(Harshita Sharma)
(現 客員研究員)
研究員(研究当時)マシュー・バレンタイン(Matthew NZ Valentine)
特別研究員(研究当時)土岐 直子(トキ・ナオコ)
(現 客員研究員)
専門技術員 末木(西頼)広美(スエキ ニシヨリ・ヒロミ)
イタリア工科大学 Central RNA Laboratory部門
部門長 ステファノ・グスティンチッチ(Stefano Gustincich)
研究支援
本研究の一部は、日本医療研究開発機構(AMED)革新的バイオ医薬品創出基盤技術開発事業「タンパク質翻訳を促進する新規ノンコーディングRNAを用いた革新的創薬プラットフォームの構築(研究開発代表者:ピエロ・カルニンチ)」による助成を受けて行われました。
原論文情報
Harshita Sharma, Matthew N Z Valentine, Naoko Toki, Hiromi Sueki Nishiyori, Stefano Gustincich, Hazuki Takahashi* and Piero Carninci*, “Decryption of sequence, structure, and functional features of SINE repeat elements in SINEUP non-coding RNA-mediated post-transcriptional gene regulation”, Nature Communications, 10.1038/s41467-024-45517-3
発表者
理化学研究所
生命医科学研究センター トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
(ヒューマン・テクノポール ゲノミクス研究センター センター長)
研究員 髙橋 葉月(タカハシ・ハヅキ)
研究員(研究当時)ハルシタ・シャルマ(Harshita Sharma)
(現 客員研究員)
報道担当
理化学研究所 広報室 報道担当

