2024-06-24 理化学研究所
理化学研究所(理研)光量子工学研究センター 生細胞超解像イメージング研究チームの宮代 大輔 技師、戸島 拓郎 上級研究員、中野 明彦 副チームリーダー(光量子工学研究センター 副センター長)の研究チームは、生きた細胞の動態を精密に観察するための新しい原理の高速超解像顕微鏡法(SCLIM2M)を開発しました。
本研究成果は、細胞規模の動的な現象を最も直接的な方法で観察する手段として幅広い分野で利用され、生命現象の根幹の理解に貢献すると期待できます。
今回、研究チームは、新しい方法論を基礎から構築することで、これまでにない時間分解能[1]と空間分解能[2]を両立する顕微鏡法を開発しました。従来は、小さな構造を観察したければ電子顕微鏡[3]を用いて、固定した細胞(分子をはじめ内部の構造すべての動きが停止している状態)を見ていました。一方、生きて動いている細胞を見るためには光学顕微鏡[4]が必要ですが、従来型の空間分解能には限界があり、小さな構造を見ることはできませんでした。SCLIM2Mでは、生きた細胞の中で小さな構造体が高速で動く様子を非常に高い精度で観察することが可能になり、「細胞が生命活動を営む真の描像」が見えてきました。
動きが直接見えるということは、すなわちその現象を数値的に記述することができ、数理的な理論と照らし合わせることが可能になります。これは生命活動を科学として本質的に理解するための極めて重要な一歩です。
本研究は、科学雑誌『Frontiers Cell and Developmental Biology』オンライン版(6月24日付:日本時間6月24日)に掲載されました。
背景
従来の顕微鏡法では、時間分解能を持つ光学顕微鏡で可視光の波長より大きい構造の動態を観察するか、電子顕微鏡で動かない固定細胞の微細構造を観察するかを、目的に応じて使い分ける必要がありました。対象や適用の異なるこれらの顕微鏡法とともに、物理学的な手法や化学的な手法も組み合わせることで、さまざまな生命現象を説明するモデルが提唱されてきました。
高速超解像顕微鏡法(SCLIM2M)では、時間分解能として1秒間に20コマの立体像、空間分解能として10-8メートルオーダーを達成しました。これにより、細胞内のミクロな世界を、あたかもわれわれが普段肉眼で見るようなマクロな世界と同様の感覚で見ることができます。「直接見る」ということは、科学者にとって、生命現象の直観的理解を促すにとどまらず、現象のより精密な理解への道を開くことになります。
当然のことながら、このような方法の実現は以前から待ち望まれていました。近年、光学顕微鏡の空間分解能を向上させる超解像顕微鏡法がいくつも開発され、2014年のノーベル化学賞受賞に象徴されるようにその成果は顕著です。しかし、それらはいずれも時間分解能を犠牲にして空間分解能を向上させるという側面がありました。その背景には、一般的な計測における時間と精度との間の根本的な板挟み状態の存在があります。
今回、時間分解能と空間分解能を両立させるために重要であった着眼点は、光の計測で得られる情報量でした。生体試料が放つ有限な情報を最大限に取得する高感度計測系と、それを最大限に利用して生命現象の実体を復元する計算方法を開発することにより、本研究の成果を得るに至りました。
研究手法と成果
研究チームは長年にわたって、生きた細胞の観察に最適化した高速高解像度共焦点顕微鏡システム(SCLIM)[5]の開発を続けてきました注1~8)。SCLIM2Mでは、これまでの性能を大幅に上回る時間空間分解能を達成しました。方法論の概略を図1に示します。この方法において重要な要素は大きく二つあります。一つは生体試料からの有限なシグナル(光子[6]:光の最小単位)を正確に測定することです。もう一つは、得られたシグナルから観察対象の真の姿を復元する新しい計算方法です。
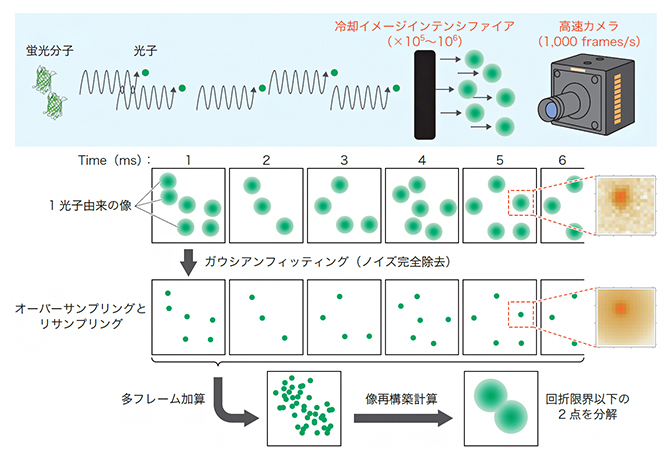
図1 SCLIM2Mの方法論
蛍光分子から放出された光子が増幅され、光子一つ一つが分離して高速カメラで撮影される。その画像を基にノイズ除去と像の復元計算が行われる。(羊土社、実験医学 Vol.36 No.20 増刊 2018 103ページ より許可を得て転載)
測定は独自に開発した装置で行われますが、特に重要な点は高精度な光計測の方法です。光学顕微鏡を通して結像した光学像をイメージインテンシファイア(I.I.)といわれる増幅器で増幅することで、光子一つ一つがはっきりと分離して高速カメラで観察できるようになります。この状態は画像として多くのノイズを含んでいますが、光子一つ一つが見えているという状況を利用した画像処理を行うことで極限精度(1光子精度)の計測が実現されます。一般に1光子感度をうたう高感度計測器がありますが、ここでいう1光子精度とはさらに上の精密さを意味します。この結果として得られる情報量は106倍(100万倍)もの差になります。
この豊富な情報量を基に行う復元計算も新しい試みです。古くは現代情報学の草創期に当たるシャノンの情報論が生まれた時代から、こうした復元は、膨大な情報量があれば可能であることは分かっていました。しかし、これまでの光学顕微鏡の分野では、それだけの情報量を取得できる計測方法がありませんでした。そのため、復元計算の具体的な方法などは未開拓な分野でしたが、研究チームでは試行錯誤を重ね実用に足る計算方法を確立しました。
一つの大きな問題は点像分布関数(point spread function: PSF)の取り扱いでした。微小な点を顕微鏡で観察すると、ある広がりを持った像として観察されます。これが、いわゆる「ボケ」を意味し、顕微鏡の分解能には限界が存在するといわれる理由でもあります。この点の像が広がる形を表した関数がPSFです。この形を正確に知ることが復元計算の鍵となりますが、理論的な光学系のPSFと実測値の間には大きな隔たりがありました(図2)。この隔たりを計算上どのように取り扱うかは大きな問題です。この問題を解決するための多くの試行錯誤の結果、今回、実用的範囲内で妥当な取り扱い方法を定めることができました。

図2 点像分布関数の理論値と実測値の違い
左は光学条件から理論的に導かれる点像分布関数、右は実際に計測した点像分布関数をそれぞれ表している。実際の形状は理論値と大きく異なったひずみを持っている。
完成したSCLIM2Mを使って実際の生命現象を観察しました(図3、4)。その結果、従来の顕微鏡観察では捉えられなかった微細な構造と、高速で動き回る微粒子の動きを同時に見ることができました。図3に、高速動画撮影中の1コマ(HeLa細胞[7]のゴルジ体[8]の3次元像)を示します。こうした動画は一見しただけで多くのインスピレーションを研究者に与えます。場合によってはそれだけで従来の仮説の証明あるいは否定につながることもあります。
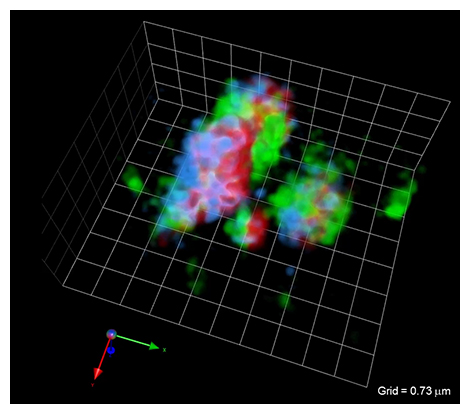
図3 細胞小器官(ゴルジ体)の3次元像(高速動画撮影中の1コマ)
HeLa細胞のゴルジ体の3槽構造をそれぞれ別の色の蛍光タンパク質で標識した。赤はメディアル槽、青はトランス槽、緑はトランスゴルジ網。撮影は1秒間に20立体という高速で行われている。
また、そこから詳細な解析に進むこともできます。SCLIM2Mでは、情報を精密に取り扱うことで像を復元する性質上、多様な数理解析が可能です。直観的には、図4の酵母細胞のトランスゴルジ網とクラスリン[9]の画像のように、注目する領域を切り出してコマを並べて見ることを例にとると分かりやすいでしょう。切り出された個々の画像は、方法論上厳密に精度が評価されており、これらの画像を使ってさまざまな物理量(例えば速度や揺らぎなど)を計算することができます。
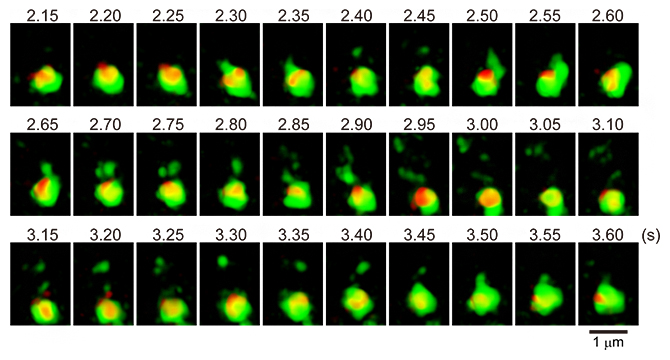
図4 酵母細胞のトランスゴルジ網とクラスリンの可視化
酵母細胞のトランスゴルジ網(赤)とクラスリン(緑)を可視化した。クラスリン被覆小胞と思われる微小な粒子の運動を時系列で追跡することができる。
注1)2006年5月15日プレスリリース「細胞小器官ゴルジ体のタンパク質輸送の大論争に決着(PDF 976.7KB)」
注2)2013年11月5日プレスリリース「ゴルジ体内のタンパク質輸送を制御する分子機構の一端を解明」
注3)2016年9月2日プレスリリース「ゴルジ体槽成熟の分子機構を解明」
注4)2017年11月14日プレスリリース「ゴルジ体形成の足場GECCO」
注5)2019年3月11日プレスリリース「タンパク質がゴルジ体内を輸送される仕組みが明らかに」
注6)2019年7月11日プレスリリース「トランスゴルジ網の時空間ダイナミクス」
注7)2021年3月26日プレスリリース「トランスゴルジ網における積荷選別様式を可視化」
注8)2024年3月19日プレスリリース「ゴルジ体の一生の時空間ダイナミクス」
今後の期待
SCLIM2Mを使ってさまざまな生命現象を観察することで、従来の生物学分野の進展に貢献するにとどまらず、これまでにない観察方法に基づいた新しい生物学分野の開拓も期待できます。それに値する革新的技術であることは、現時点で実証されている数値上の時間空間分解能に加えて、これから行ういろいろな観察を通して確かなものとなっていくでしょう。
今回の成果は方法論に関するものであるため、SCLIM2Mの応用分野は数え切れないほど挙げることができます。研究チームで現在進めている研究から例を挙げると、まずは、広い生物種にまたがる細胞内の普遍的な活動の観察です。これについてはすでに教科書を書き換えることになるような観察結果をいくつか得ています。さらにその先には、応用としてウイルスの感染機構の可視化、創薬への応用、病理の解明などさまざまな分野への発展も考えられ、すでに多くの専門家から関心が寄せられています。
現在、理研外からの利用の準備も進めており、近い将来、多くの成果が期待されます。
補足説明
1.時間分解能
時間変化をどこまで小刻みに追えるかの指標。空間分解能とはしばしばトレードオフの関係になる。
2.空間分解能
空間をどこまで細かく見ることができるかの指標。顕微鏡では、用いる波(光、電子)の波長程度が一般的な限界となる。
3.電子顕微鏡
電子線を使った顕微鏡。固定細胞を見るが、原子サイズまでの空間分解能を持つ。
4.光学顕微鏡
可視光を使った顕微鏡。生きたままの細胞を見ることができるが、細胞内部の微細構造を見るためには空間分解能がやや不足している。
5.高速高解像度共焦点顕微鏡システム(SCLIM)
研究チームが独自に開発している顕微鏡システム。スピニングディスク式共焦点スキャナー、高速駆動ピエゾ、多波長分光器、冷却イメージインテンシファイア、高速・高感度カメラなどから構成される。SCLIMは、Super-resolution confocal live imaging microscopyの略、SCLIM2Mは、SCLIM, second generation Miyashiro modelの略。
6.光子
光を観測するときの最小単位。顕微鏡観察においては、個々の光子を検知することが最高精度の計測の条件となる。
7.HeLa細胞
多くの生物学者が観察に用いるモデル細胞株。ヒトの細胞に由来する。
8.ゴルジ体
細胞の中に存在する細胞小器官の一つ。細胞内物質(主にタンパク質)輸送の中核として働く。真核細胞に共通して存在するが、その形態や細胞内配置は生物種ごとにさまざまである。シス槽、メディアル槽、トランス槽、トランスゴルジ網と呼ばれる、複数の膜区画が順に積み重なった構造をとる。
9.クラスリン
ゴルジ体を構成する区画の一つであるトランスゴルジ網からタンパク質が運び出される際に働く分子。トランスゴルジ網の表面に集積し、局所的に膜を湾曲させることで膜がくびり切られ、クラスリンに覆われた小さな輸送小胞ができる。輸送小胞は最終目的地へと運ばれていく。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「ゴルジ体を中心とした選別輸送機構の超解像ライブイメージングによる完全解明(研究代表者:中野明彦)」、同基盤研究(A)「ゴルジ体を中心とした膜交通機構の統合モデルの構築(研究代表者:中野明彦)」、同新学術領域研究(研究領域提案型)「ER exit siteでのGPIアンカー蛋白質選別輸送ゾーンの解析(研究代表者:中野明彦)」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「ゴルジ体の動態解明に基づく糖鎖修飾の制御(研究代表者:加藤晃一)」による助成を受けて行われました。また本研究では、理研バイオリソース研究センターから提供されたバイオリソース(HeLa細胞RCB0007)を使用しました。
原論文情報
Daisuke Miyashiro, Takuro Tojima, and Akihiko Nakano, “Extremely high spatiotemporal resolution microscopy for live cell imaging by single photon counting, noise elimination, and a novel restoration algorithm based on probability calculation”, Frontiers Cell and Developmental Biology, 10.3389/fcell.2024.1324906
発表者
理化学研究所
光量子工学研究センター 生細胞超解像イメージング研究チーム
技師 宮代 大輔(ミヤシロ・ダイスケ)
上級研究員 戸島 拓郎(トジマ・タクロウ)
副チームリーダー 中野 明彦(ナカノ・アキヒコ)
(光量子工学研究センター 副センター長)
報道担当
理化学研究所 広報室 報道担当