2024-11-12 理化学研究所
理化学研究所(理研)生命医科学研究センター 粘膜システム研究チームの大野 博司 チームリーダーらの国際共同研究グループは、腸管の免疫誘導組織であるパイエル板[1]に分布する単核貪食細胞[2]の分化が転写因子[3]RelBとC/EBPαによって調節されることを発見しました。
パイエル板のsub-epithelial dome(SED)と呼ばれる領域に存在する単核貪食細胞は、抗原の取り込みや免疫応答の誘導など、感染防御の最前線で多様な機能を果たしています。本研究では、デジタルRNA-seq[4]を用いた詳細な遺伝子発現解析とwPGSA[5]を通じて、SEDの単核貪食細胞の機能を調節する主要な転写因子としてRelBとC/EBPαを特定しました。SEDの単核貪食細胞においてRelBが欠損すると、パイエル板への抗原取り込みを調節するタンパク質であるIL-22BP(インターロイキン-22結合タンパク質)[6]の発現が著しく低下し、また成熟M細胞[7]の数が減少することが観察されました。また、SEDの単核貪食細胞においてC/EBPα欠損マウスでは、細菌の細胞壁を分解する酵素であるリゾチームの発現低下によって腸管内の病原菌に対する感受性が増加しました。
この成果は、単核貪食細胞による腸管免疫応答の調節機構に関する新たな知見となり、将来的には腸管免疫応答の破綻によって起こる疾患や感染症の新しい治療ターゲットとなる可能性が期待されます。
本研究は、科学雑誌『Mucosal Immunology』オンライン版(10月14日付)に掲載されました。
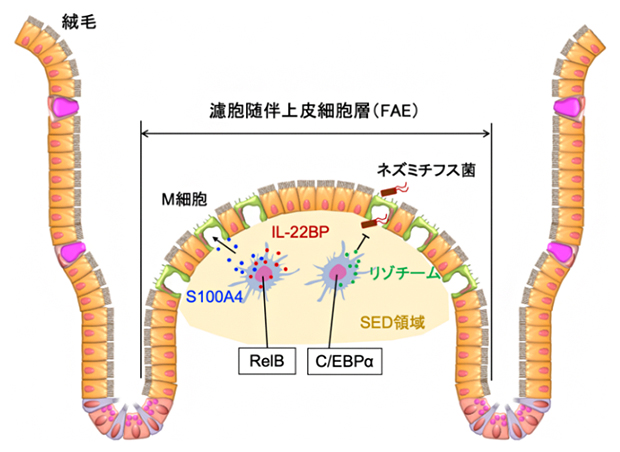
RelBとC/EBPαによるSEDの単核貪食細胞の機能調節
背景
腸管粘膜は、栄養や水分の吸収効率を高めるため、広い表面積を持ち、食物や食物とともに侵入する外来微生物、さらには40兆個もの腸内細菌といった異物(抗原)に常にさらされています。従って腸管粘膜は、多くの感染症における病原性微生物の初期侵入経路でもあり、感染から個体を守る最前線と考えられます。そのため、腸管にはパイエル板に代表される腸管免疫組織が発達しています。腸管粘膜は腸管上皮細胞という細胞で構成されており、その中で腸管免疫組織を覆う部分は、濾胞随伴上皮細胞層(FAE)[7]と呼ばれています。FAEにはM細胞が存在しており、M細胞は腸管内の抗原を取り込み、M細胞直下のsub-epithelial dome(SED)と呼ばれる領域に分布する単核貪食細胞に受け渡します。これらの単核貪食細胞は、取り込んだ抗原をT細胞へ提示し、その結果取り込まれた抗原に対して特異的な免疫応答が誘導されます。
SEDの単核貪食細胞は、抗原提示以外にもさまざまな役割を有しています。大野チームリーダーらは以前に、SEDの単核貪食細胞がインターロイキン-22結合タンパク質(IL-22BP)と呼ばれる分子を発現することで、M細胞が抗原を取り込むために適した環境を形成することを発見しました注1)。しかしながら、IL-22BPの発現をはじめとするSEDの単核貪食細胞の機能調節機構は十分に理解されていませんでした。
注1)2017年5月16日プレスリリース「腸管内の細菌取り込みの新たな仕組みを解明」
研究手法と成果
本研究では、より正確かつ包括的な遺伝子発現プロファイリングが可能なデジタルRNA-seqを活用し、SEDの単核貪食細胞の遺伝子発現解析を実施しました。さらに、得られた遺伝子発現データを用いてwPGSAを実施し、SEDの単核貪食細胞の機能を調節するために重要な複数の転写因子を選抜しました。その結果、転写因子RelBとC/EBPαがSEDの単核貪食細胞の主要な機能調節因子として特定されました。パイエル板におけるRelBとC/EBPαの発現様式を調べたところ、SEDの単核貪食細胞において発現することが観察されました(図1)。
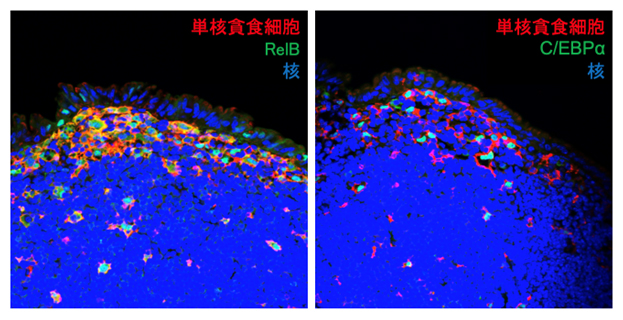
図1 パイエル板における転写因子RelBとC/EBPα発現様式
パイエル板の組織切片を抗CD11c抗体(単核貪食細胞マーカー)、抗RelB抗体と抗C/EBPα抗体を用いて免疫染色を行ったところ、SED領域において、RelB(左)およびC/EBPα(右)を発現する細胞が観察された。
RelBは、非古典的なNF-κBシグナル伝達経路[8]によって活性化される転写因子です。単核貪食細胞特異的にRelBを欠損したマウス(RelBMP-KOマウス)におけるSEDの単核貪食細胞の機能を調べたところ、IL-22BPの発現が欠失しており、その結果RelBMP-KOマウスのFAEにおいてはIL-22BP欠損マウス同様に上皮細胞表面のフコシル化[9]が亢進(こうしん)していることが分かりました。また、興味深いことに、RelBMP-KOマウスのSEDの単核貪食細胞においてS100A4というタンパク質の発現が著しく低下することが観察されました。近年の報告でS100A4はM細胞の機能的成熟に重要な分子であることが見いだされています注2)。そこでRelBMP-KOマウスのFAEにおけるM細胞の数を調べたところ、RelBMP-KOマウスのFAEにおいて成熟M細胞の数が著しく減少していました。これらのことから、RelBMP-KOマウスにおいては、パイエル板への抗原取り込みが阻害され、抗原特異的な免疫応答の誘導が低下していることが示唆されます。
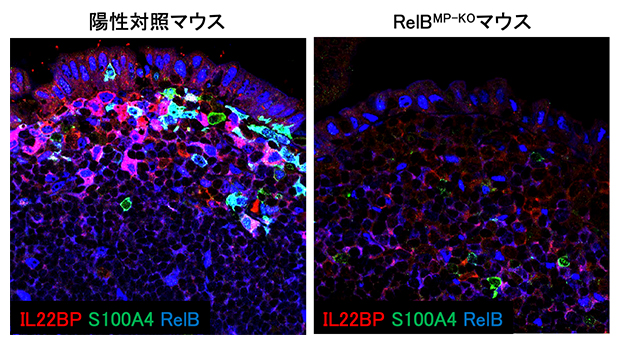
図2 転写因子RelBのIL-22BPとS100A4の発現制御
パイエル板の組織切片を抗IL-22BP抗体、抗S100A4抗体および抗RelB抗体を用いて免疫染色を行った。RelBMP-KOマウスのSEDの単核貪食細胞においてIL-22BPとS100A4の発現が著しく低下することが観察された(右)。
C/EBPαは、SEDの単核貪食細胞の中でも特にリゾチームを発現する細胞集団において選択的に発現していることが観察されました。単核貪食細胞特異的にC/EBPαを欠損したマウス(C/EBPαMP-KOマウス)におけるSEDの単核貪食細胞の機能を調べたところ、リゾチームの発現が著しく低下することが分かりました。リゾチームは、細菌の細胞壁を分解する酵素であり、腸内の病原体に対する第一線の防御を担います。そこでC/EBPαMP-KOマウスの病原性細菌感染に対する感受性を調べたところ、経口感染させたネズミチフス菌(Salmonella Typhimurium)のパイエル板や腸間膜リンパ節への侵入が有意に増加することが観察されました。これらのことから、C/EBPαはSEDの単核貪食細胞の防御機能を調節することで感染防御の第一線として重要な役割を果たしていることが分かりました。
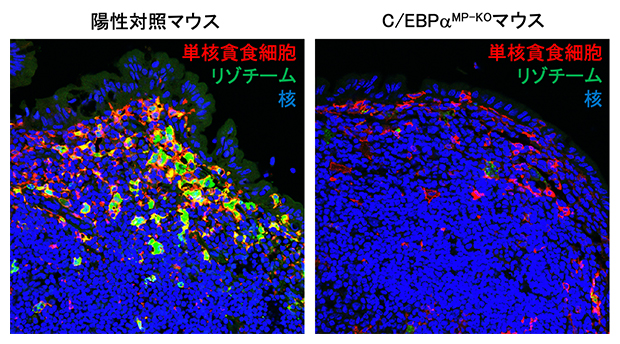
図3 転写因子C/EBPαのリゾチームの発現制御
パイエル板の組織切片を抗CD11c抗体(単核貪食細胞マーカー)、抗リゾチーム抗体を用いて免疫染色を行った。C/EBPαMP-KOマウスのSEDの単核貪食細胞において、陽性対照マウス(左)と比べ、リゾチームの発現が著しく低下することが観察された(右)。
注2)Jakob Neuser.et al. 2019, HBI1 Mediates the Trade-off between Growth and Immunity through Its Impact on Apoplastic ROS Homeostasis, Cell rep, 28(7):1670-1678.e3.
今後の期待
今回、パイエル板SEDの単核貪食細胞の機能調節因子としてRelBとC/EBPαが重要な役割を担っていることが明らかになりました。この発見は、単核貪食細胞を介した腸管免疫の調節機構に関する新たな知見となり、将来的には腸内免疫バランスの乱れによって引き起こされる疾患(例:炎症性腸疾患や感染症)に対する新たな治療ターゲットとなることが期待されます。
補足説明
1.パイエル板
パイエル板は小腸の粘膜下にリンパ球などの免疫細胞が集合して作られるリンパ組織。粘膜側は濾胞随伴上皮細胞層(FAE)([7]参照)と呼ばれる、絨毛とは異なった上皮細胞層に覆われている。腸管内の細菌などの抗原を、FAEを介して取り込む。取り込まれた抗原はFAEに近接するドーム下領域(sub-epithelial dome: SED)に分布する樹状細胞に受け渡され、T細胞へと抗原提示が行われる。最終的に抗原特異的なIgA(免疫グロブリンA)抗体を産生するB細胞が成熟する。抗原特異的なIgA抗体は腸管内に放出され、抗原の排除に寄与する。
2.単核貪食細胞
単球、マクロファージと樹状細胞の総称。これらの細胞は貪食や抗原提示などの機能を有し、自然免疫系と獲得免疫系の両方において重要な役割を果たしている免疫細胞である。
3.転写因子
DNAのさまざまな領域に結合することで遺伝子からmRNAの転写を制御するタンパク質。
4.デジタルRNA-seq
少ない数の細胞からより正確な定量性を持ってRNAの発現量を比較するために開発された、DNA配列を読み取るシークエンス技術の一種。読み取るDNA断片に特異的な短い配列を付加しておくことで、DNAをあらかじめマークしておくバーコード技術を使うことにより、RNAのコピー数を正確に測ることから、デジタルという名称が使用されている。
5.wPGSA
遺伝子発現データから遺伝子制御に重要な転写因子を網羅的に予測する手法。wPGSAはweighted Parametric Gene Set Analysisの略称。
6.IL-22BP(インターロイキン-22結合タンパク質)
インターロイキン-22(IL-22)のシグナルを負に制御するタンパク質。IL-22は免疫細胞から産生されるサイトカインであり、上皮細胞に作用してバリア機能に関与する抗菌タンパク質の産生や上皮細胞のフコシル化を誘導する。
7.M細胞、濾胞随伴上皮細胞層(FAE)
濾胞随伴上皮細胞層(FAE)はパイエル板の粘膜側を覆う上皮細胞層。FAEには5~10%の割合でM細胞が存在する。M細胞は抗原の取り込みに特化した上皮細胞で、細菌などの抗原を取り込み、パイエル板のドーム下領域(SED)に分布する樹状細胞へ受け渡す。残りは主に絨毛の大部分を占める吸収上皮細胞様の細胞で構成されている。FAEはfollicle-associated epitheliumの略。
8.NF-κBシグナル伝達経路
シグナル伝達経路は生体内である種のシグナルが他のシグナルに変換され、連続して伝わる過程のこと。NF-κBシグナル伝達経路はNF-κBファミリー転写因子を中心に構成されるシグナル伝達経路である。NF-κBファミリー転写因子としてp50、p52、RelA、RelBおよびc-Relの5種類のタンパク質が知られており、これらがホモもしくはヘテロ二量体を形成し、転写因子として機能する。NF-κBシグナル伝達経路には古典経路および非古典経路の2種類があり、受容体の種類によって活性化される経路が異なる。なお古典経路はタンパク質の合成を必要としない迅速な経路であり、一方で非古典経路はタンパク質の合成を伴うため比較的時間がかかる経路である。
9.フコシル化
糖の一種であるフコースが付加されること。
国際共同研究グループ
理化学研究所 生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
副チームリーダー(研究当時)金谷 高史(カナヤ・タカシ)
研究員 陣野原 俊(ジンノハラ・トシ)
テクニカルスタッフⅡ 榊原 小百合(サカキバラ・サユリ)
テクニカルスタッフⅡ 橘 直子(タチバナ・ナオコ)
基礎科学特別研究員(研究当時)佐々木 崇晴(ササキ・タカハル)
(現 客員研究員)
研究員(研究当時)加藤 完(カトウ・タモツ)
(現 専門技術員)
生命機能科学研究センター 細胞システム動態予測研究チーム
チームリーダー 城口 克之(シログチ・カツユキ)
情報統合本部 医療データ数理推論チーム
チームリーダー 川上 英良(カワカミ・エイリョウ)
(千葉大学 大学院医学研究院 人工知能(AI)医学 教授)
フリッツ・リップマン研究所(ドイツ)
研究員 マーク・リーマン(Marc Riemann)
中国科学院動物研究所
教授 金 堅石(Jin Jianshi)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(研究代表者:大野博司)」、同基盤研究(B)「食物繊維が小腸免疫系を発達させる仕組みの解明(研究代表者:金谷高史)」、同基盤研究(C)「パイエル板樹状細胞による腸管免疫制御機構の解明(研究代表者:金谷高史)」、日本医療研究開発機構(AMED)ムーンショット型研究開発事業目標7のプロジェクト「健康寿命伸長に向けた腸内細菌動作原理の理解とその応用(プロジェクトマネージャー:本田賢也、分担者:大野博司、22zf0127007)」、公益財団法人ロッテ財団による助成を受けて行われました。
原論文情報
Takashi Kanaya*, Toshi Jinnohara, Sayuri Sakakibara, Naoko Tachibana, Takaharu Sasaki, Tamotsu Kato, Marc Riemann, Jianshi Jin, Katsuyuki Shiroguchi, Eiryo Kawakami, and Hiroshi Ohno*(*責任著者), “RelB and C/EBPα critically regulate the development of Peyer’s patch mononuclear phagocytes”, Mucosal Immunology, 10.1016/j.mucimm.2024.10.005
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
報道担当
理化学研究所 広報室 報道担当