2025-01-29 理化学研究所,大阪大学
理化学研究所(理研)生命機能科学研究センタ ー生体機能動態イメージング研究チーム(研究当時)の崔 翼龍 チームリーダー(研究当時、現 分子標的化学研究チーム 客員主管研究員)、根山 広行 研究員(研究当時)、健康・病態科学研究チーム(研究当時)の渡辺 恭良 チームリーダー(研究当時、現 分子標的化学研究チーム 客員主管研究員)、大阪大学 医学部附属動物実験施設実験動物学の宮坂 佳樹 助教らの共同研究グループは、薬理作用のない偽薬(プラセボ)[1]の投与により実際に痛みが和らぐプラセボ鎮痛効果[1]の神経生物学的な実態を明らかにしました。
本研究成果は、医療現場におけるプラセボ効果の合理的な活用に理論的な根拠を与え、治療効率の向上、薬剤の副作用・耐性や依存の予防などに貢献するだけでなく、”心と脳”問題を神経科学で理解するきっかけを提供すると期待されます。
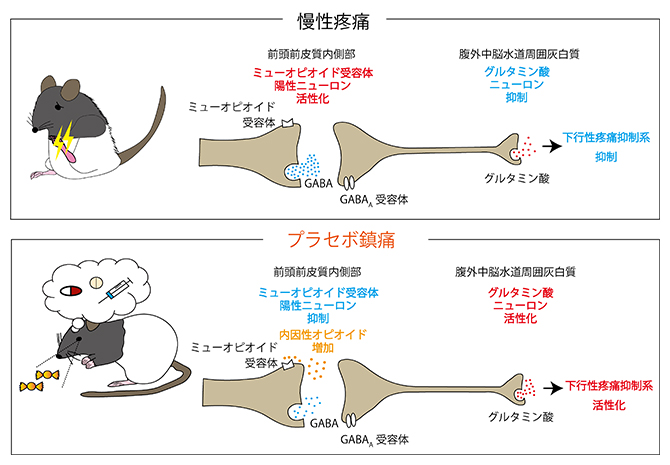
今回、共同研究グループは、陽電子放射断層撮影法(PET)[2]で同定したラットのプラセボ効果に関わる脳内領域である前頭前皮質内側部[3]に焦点を当てました。プラセボに対する「期待感」といった高度な心理活動が、前頭前皮質内側部に存在するミューオピオイド受容体(MOR)[4]陽性ニューロンの活動を抑制し、腹外側中脳水道周囲灰白質(vlPAG)[5]に投射するニューロンを脱抑制することで脳内の内因性の下行性疼痛(とうつう)抑制系[6]を活性化し、痛みを和らげるプラセボ鎮痛効果を発揮していることを明らかにしました。
本研究は、科学雑誌『Science Advances』(1月15日付)に掲載されました。
プラセボ鎮痛効果の神経生物学的な実態
背景
薬理効果のない偽薬(プラセボ)に対して、”効果があると思い込む”だけで実際に何らかの治療効果が得られるプラセボ効果は、古くから知られ、また科学的にも実証されています。しかし、このようなプラセボ効果は、ほぼすべての医療行為の中に存在しているにもかかわらず、その神経生物学的な実態はいまだに不明であることから、日本でもその医療応用は制限されています。
プラセボ効果の中で最も研究が進んでいるのが、プラセボにより痛みの感覚が和らぐ効果(プラセボ鎮痛)です。近年、ヒトを対象とした機能的核磁気共鳴画像法(fMRI)[7]や陽電子放射断層撮影法(PET)などの非侵襲的脳機能イメージング技術を用いた研究から、プラセボ鎮痛効果によって背外側前頭前皮質[3]、前帯状回[8]、中脳水道周囲灰白質などの脳領域において神経活動が亢進(こうしん)すること、内因性のオピオイド[4]やドーパミン神経系[9]が関わることなどが報告されています注1)。しかし、これらの研究では脳内の大まかな部位は同定できても、「どのような神経細胞」が「どんな機序」で痛みを和らげるか、その詳細な分子神経基盤をヒトで明らかにすることはできていませんでした。
一方、近年の小動物用PETなどのイメージング技術の進歩によって、げっ歯類などの小動物でも臨床データに匹敵する高精度の脳機能画像を得ることが可能になっています。これまで崔チームリーダーらは、「パブロフの条件付け[10]」を利用してプラセボ鎮痛効果を再現したラットの脳神経活動をPETで解析し、ラットにおいても、ヒトの背外側前頭前皮質に相当する前頭前皮質内側部がプラセボ鎮痛効果に関わっていることを発見しました。同時に行った行動薬理学的な検討では、前頭前皮質内側部のミューオピオイド受容体(MOR)がプラセボ鎮痛効果に深く関わっていることも突き止めています注2)。ミューオピオイド受容体を発現するニューロン(MOR陽性ニューロン)は、内在性のオピオイドやモルヒネなどの鎮痛薬が受容体に結合すると、その活動が抑制され、痛みを抑える働きがあります。しかし、前頭前皮質は脳のさまざまな領域と複雑な神経ネットワークを形成し、情動、認知、動機付けなど多様な高次脳機能に関連しており、この領域に発現するミューオピオイド受容体がどのように痛みを制御しているのかは不明でした。
本研究では、光・化学遺伝学手法を用いて、MOR関連の神経回路を選択的に操作し、プラセボ鎮痛効果の詳細な神経生物学的な基盤の解明を目指しました。
注1)T. D. Wager, L. Y. Atlas, The neuroscience of placebo effects: Connecting context, learning and health. Nat. Rev. Neurosci. 16, 403-418 (2015).
注2)2018年11月5日プレスリリース「『期待感』は痛みを和らげる」
研究手法と成果
共同研究グループはまず、脳内のミューオピオイド受容体(MOR)関連の神経回路を特異的に操作するため、先端モデル動物支援プラットフォーム(AdAMS)の支援を得て、脳内の特定領域でのMOR陽性ニューロン特異的に神経活動の操作が可能な遺伝子組換えラットを開発しました。このラットを用いて、前頭前皮質内側部MOR陽性ニューロンの活動を選択的に操作し、プラセボ鎮痛効果への影響を調べました。これまでに崔チームリーダーらは、後肢への弱い痛み刺激に反応する神経障害性疼痛[11]モデルラットを用いて、数日間の鎮痛剤との条件付けにより、その後プラセボとして投与した生理食塩水でも鎮痛作用が現れることを見いだしています注2)。しかし、今回の調査では、前頭前皮質内側部(mPFC)のMOR陽性ニューロンを特異的に活性化させると、このような「パブロフの条件付け」によるプラセボ鎮痛効果が消失しました(図1)。
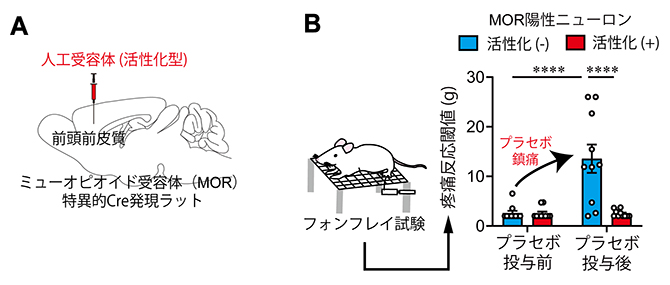
図1 mPFCのMOR陽性ニューロンの活性化によるプラセボ鎮痛効果の抑制
A)MOR陽性ニューロンの神経活動の操作が可能な遺伝子組換えラットでの実験の模式図。このラットでは、MOR陽性ニューロン特異的に組換え酵素Creが発現する。このラットの脳に、人工受容体を組み込んだウイルスベクターを局所投与すると、脳内の特定領域でのMOR陽性ニューロンの神経活動を活性化あるいは抑制させることができる。
B)MOR陽性ニューロンを活性化した神経障害性疼痛モデルラットに対して、フォンフレイ試験(後肢への刺激に対しても逃避反応を起こす圧力を計測する試験)を行った結果。逃避反応(疼痛反応)を起こす圧力(g)の閾値(いきち)が低いことは、痛み刺激に敏感であることを示す。対照ラット(青)では、プラセボ投与により疼痛反応閾値が上昇するプラセボ鎮痛効果が現れた。このプラセボ鎮痛効果は、MOR陽性ニューロンを活性化すると抑制された(赤)。白丸は個体ごとの値を示す。
体が受けた痛みの刺激は、感覚神経を伝わって脊髄に入ります。脊髄はこの刺激を上(脳)に伝達し、痛みが認識されます。これに対して、脳には痛みを弱める仕組みも存在しており、これは脳から下(脊髄)に向けて痛覚情報の伝達を抑制するため下行性疼痛抑制系と呼ばれます。次に、前頭前皮質内側部(mPFC)のMOR陽性ニューロンがどの脳領域を介して下行性疼痛抑制系を活性化するかを調べました。崔リームリーダーらはすでに、前頭前皮質内側部(mPFC)と、痛みの制御に深く関わっている腹外側中脳水道周囲灰白質(vlPAG)の機能的結合[12]が、プラセボ鎮痛効果によって上昇することを明らかにしています。そこで、前頭前皮質内側部(mPFC)から腹外側中脳水道周囲灰白質(vlPAG)に投射する神経回路とプラセボ鎮痛効果の関連について検討しました。その結果、前頭前皮質内側部(mPFC)から腹外側中脳水道周囲灰白質(vlPAG)に投射するニューロン(以下、「投射ニューロン」)の神経活動を選択的に抑制すると、プラセボ鎮痛効果が消失することが分かりました(図2)。
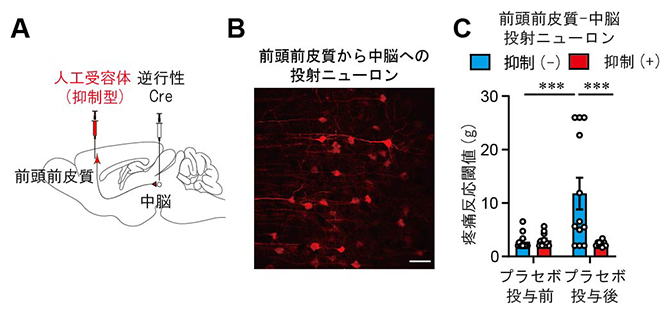
図2 mPFC-vlPAG神経回路の抑制によるプラセボ鎮痛効果の抑制
A)実験の模式図。神経軸索を逆行するウイルスベクターにCre遺伝子を組み込み、中脳に局所投与すると、腹外側中脳水道周囲灰白質(vlPAG)に投射している前頭前皮質内側部(mPFC)のニューロン(投射ニューロン)にCre酵素を発現させることができる。ここでさらに、人工受容体(抑制型)を組み込んだウイルスベクターを前頭前皮質内側部(mPFC)に局所投与することで、mPFC-vlPAG神経回路の神経活動を選択的に抑制できる。
B)人工受容体(抑制型)を発現する投射ニューロンの蛍光顕微鏡像(赤)。スケールバーは50マイクロメートル(μm、1μmは100万分の1メートル)。
C)前頭前皮質内側部(mPFC)から腹外側中脳水道周囲灰白質(vLPAG)に投射するニューロン(「投射ニューロン」)の神経活動を抑制するとプラセボ鎮痛効果は抑制される。プラセボ投与前、非抑制(-)・抑制(+)いずれも疼痛反応閾値(青棒グラフ、赤棒グラフ)は低い。一方、プラセボ投与後、疼痛反応閾値は、非抑制(青棒グラフ)では上昇するが、抑制(赤棒グラフ)では反応閾値は低いままで、プラセボ鎮痛効果が消失していた。
最後に、前頭前皮質内側部(mPFC)のMOR陽性ニューロンが、どのような仕組みで投射ニューロンに作用しているかを調べました。複数の実験系を組み合わせた結果から、下記のことが判明しました。
①MOR陽性ニューロンは、投射ニューロンに直接シナプス結合する(図3A)
②活性化したMOR陽性ニューロンは、投射ニューロンを抑制する(図3B)
③MOR陽性ニューロンの選択的な活動抑制は鎮痛作用を示すが、投射ニューロンを特異的に除去するとこの鎮痛効果が現れなくなる(図3C)
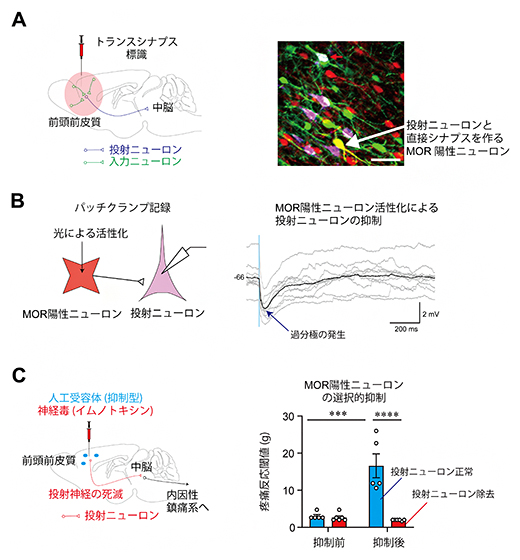
図3 mPFC MOR陽性ニューロンによるmPFC-vlPAG投射ニューロンの抑制作用
A)トランスシナプス標識法(ある神経細胞群へシナプス入力を送るシナプス前細胞を網羅的に可視化する手法)を用いた神経解剖学的な観察結果。投射ニューロンをマゼンタ、投射ニューロンに入力するニューロンを緑、MOR陽性ニューロンを赤で標識した。投射ニューロンと直接シナプスを作る入力ニューロンは、MOR陽性ニューロン(緑+赤=黄、白矢印)であることが分かった。なお赤矢印は、腹外側中脳水道周囲灰白質(vlPAG)からさかのぼって標識された多色染色の起点となる細胞(白)。
B)電気生理学的手法(パッチクランプ法)で記録した、投射ニューロンの膜電位。投射ニューロンに入力するMOR陽性ニューロンを活性化させると、投射ニューロンが過分極(膜電位の低下)した。この抑制作用は、抑制性の神経伝達物質であるGABAの受容体(GABAA受容体)を介していることが、GABAA受容体の阻害実験で判明した。
C)イムノトキシン(神経毒)標的法を用いて、前頭前皮質内側部(mPFC)から腹外側中脳水道周囲灰白質(vlPAG)に投射するニューロンを特異的に除去した。このラットでは、MOR陽性ニューロンの選択的な抑制が引き起こす鎮痛効果(抑制後の青棒グラフ、疼痛反応閾値の上昇)が現れなくなった(抑制後の赤棒グラフ)。
以上の結果をまとめると、鎮痛薬の条件付けによって生み出された「期待感」の神経生物学的な実態は、下記の仕組みであると考えられます。①プラセボが投与されると、前頭前皮質内側部(mPFC)で内因性オピオイドが増加し、MOR陽性ニューロンの活動が抑制されます。②腹外側中脳水道周囲灰白質(vlPAG)に投射するニューロン(投射ニューロン)は、普段はMOR陽性ニューロンによる抑制を受けていますが、プラセボ投与に伴い脱抑制されます。③脱抑制された投射ニューロンは下行性疼痛抑制系を活性化し、プラセボ鎮痛効果が現れます。
今後の期待
プラセボ効果は、ほぼすべての医療行為に存在しており、本研究によるプラセボ鎮痛効果の神経生物学的な基盤の解明は、これからの医療現場におけるプラセボ効果の合理的な活用に理論的な根拠を与え、治療効率の上昇だけではなく、鎮痛薬の投与量削減による薬物副作用の軽減ならびに耐性・依存の予防などにもつながると考えられます。
昨今、シングルセル解析などのゲノムワイドな解析法の普及によって個々の細胞の遺伝情報が解読され、生命機能や病態に関わるさまざまな遺伝子や機能分子が次々と報告されていますが、精神神経活動の分子神経基盤はいまだに不明なところが多く残されています。その主な原因は、分子神経機序の探索に用いる多くの動物モデルが行動学変化の相同性だけに頼っており、どれくらいヒトの精神神経活動を反映しているかは依然として曖昧であることです。さらに、ヒトと動物の種差以外にも、脳神経活動を計測する方法論や得られたデータの階層および質が大きく異なることも挙げられます。本研究では、小動物脳機能画像解析によってヒトのプラセボ効果といった高度な精神神経活動と一致する脳領域を同定し、さらに光・化学遺伝学手法を駆使し、その詳細な分子神経基盤を明らかにしました。これらの研究手法は、プラセボ研究をはじめ、”心と脳”問題の科学的な理解に有効なアプローチを提供できると期待しています。
補足説明
1.偽薬(プラセボ)、プラセボ鎮痛効果
薬理作用のない偽薬(プラセボ)に対する「期待感」によって、何らかの治療効果が現れる現象をプラセボ効果と呼び、プラセボ鎮痛効果は、プラセボにより痛みが抑制されること。プラセボ効果は意識を伴う「期待感」だけでなく、意識下のパブロフの条件付け([10]参照)によっても現れる。
2.陽電子放射断層撮影法(PET)
PETは、陽電子を放出する陽電子放出核種(放射性同位体の一種)をプローブとして、生体内のプローブ分布を画像化する手法。陽電子放出核種またはその陽電子放出核種で標識したPETプローブを体内に注入し、その集積を非侵襲的に(体を傷つけずに)3次元画像化し定量することができる。先行研究では、脳内の神経細胞の糖代射レベルを定量解析するFDG-PETと、ボクセル(立方体)ごとに実験群間の統計的な有意差を検出可能な脳機能画像解析法(statistical parametric mapping(SPM)解析法)を組み合わせ、げっ歯類動物の深部脳領域まで網羅した全脳領域において、神経活動領域を網羅的に探索した。PETはpositron emission tomographyの略。
3.前頭前皮質内側部、背外側前頭前皮質
大脳皮質のうち、前頭部に位置する領域を前頭前皮質と呼び、前頭前皮質内側部(mPFC)、背外側前頭前皮質(dlPFC)、眼窩前頭皮質(OFC)などの領域に細分化される。主に高次元の実行機能に関与している。
4.ミューオピオイド受容体(MOR)、オピオイド
オピオイドは、モルヒネ様の活性を持つ脳内の内因性の生理活性物質であり、そのオピオイドの受容体の一つにミューオピオイド受容体(MOR)がある。ミューオピオイド受容体はGTP結合タンパク質と共役する7回膜貫通型受容体で、鎮痛作用に関連している。MORはmu opioid receptorの略。
5.腹外側中脳水道周囲灰白質(vlPAG)
中脳内部の中脳水道周囲に広がる細胞集団。痛覚抑制機能を担う。vlPAGはventrolateral periaqueductal greyの略。
6.下行性疼痛(とうつう)抑制系
中脳から脊髄に下行する神経回路で、痛みの情報伝達を抑制する作用がある。セロトニンを介した抑制系とノルアドレナリンを介した抑制系の2種類がある。この痛覚抑制機構を下行性疼痛抑制系と呼ぶ。
7.機能的核磁気共鳴画像法(fMRI)
核磁気共鳴画像法(MRI)を利用して、脳の局所的な神経活動の高まりを血流動態反応で視覚化する方法の一つ。fMRIはfunctional magnetic resonance imagingの略。
8.前帯状回
大脳半球内側面に広がる帯状回のうち、前方部の領域。痛みの刺激により活性化される。
9.ドーパミン神経系
中枢神経に存在する神経伝達物質の一つであるドーパミンを使用する神経系。
10.パブロフの条件付け
ロシアの生理学者パブロフは、音などの本来は中立的な刺激(条件刺激)を食べ物など意味のある刺激(無条件刺激)に先立って繰り返し与える(条件付け)ことで、条件刺激だけで無条件刺激と同じ反応(唾液の分泌など)が現れることを発見した。この条件付けを「パブロフの条件付け」あるいは「古典的条件付け」と呼ぶ。
11.神経障害性疼痛
神経が傷ついたり圧迫を受けたりすることで過敏になり、慢性的な痛みや、痛み刺激への過反応が生じた状態。
12.機能的結合
脳の異なる領域間の活動が正または負に相関することが観察された場合、それらの領域は機能的に結合していると表現される。機能的結合は、神経がつながっていない(解剖学的に結合していない)領域間でも見られる。
共同研究グループ
理化学研究所 生命機能科学研究センター
生体機能動態イメージング研究チーム(研究当時)
チームリーダー(研究当時)崔 翼龍(サイ・ヨクリュウ)
(現 分子標的化学研究チーム 客員主管研究員、兵庫医科大学 医学部脳腸相関機能解析学 特任教授)
研究員(研究当時)根山 広行(ネヤマ・ヒロユキ)
(現 分子標的化学研究チーム 客員研究員、京都大学 がん免疫総合研究センター 特定研究員)
リサーチアソシエイト(研究当時)武 玉萍(ウー・ユーピン)
(現 発生エピジェネティクス研究チーム テクニカルスタッフⅠ)
研究員(研究当時)清水 朋子(シミズ・トモコ)
研究員(研究当時)田原 強(タハラ・ツヨシ)
(現 分子標的化学研究チーム 客員研究員)
テクニカルスタッフⅠ(研究当時)重田 美香(シゲタ・ミカ)
テクニカルスタッフⅠ(研究当時)井上 道子(イノウエ・ミチコ)
比較コネクトミクス研究チーム
チームリーダー 宮道 和成(ミヤミチ・カズナリ)
健康・病態科学研究チーム(研究当時)
チームリーダー(研究当時)渡辺 恭良(ワタナベ・ヤスヨシ)
(現 分子標的化学研究チーム 客員主管研究員、神戸大学 大学院科学技術イノベーション研究科 特命教授)
日本大学 歯学部薬理学
教授 小林 真之(コバヤシ・マサユキ)
専任講師 中谷 有香(ナカヤ・ユカ)
福島県立医科大学 生体情報伝達研究所 生体機能研究部門
教授 小林 和人(コバヤシ・カズト)
准教授 加藤 成樹(カトウ・シゲキ)
愛知医科大学 総合医学研究機構動物実験部門
准教授 松下 夏樹(マツシタ・ナツキ)
東京大学 医科学研究所 実験動物研究施設 先進動物ゲノム研究分野
教授 真下 知士(マシモ・トモジ)
大阪大学 医学部附属動物実験施設実験動物学
助教 宮坂 佳樹(ミヤサカ・ヨシキ)
兵庫医科大学 医学部解剖学神経科学部門
主任教授 戴 毅(ダイ・ツヨシ)
客員教授 野口 光一(ノグチ・コウイチ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成制度挑戦的萌芽研究「小動物脳機能画像解析法を用いたプラセボ効果の神経生物学的機序の解明(研究代表者:崔翼龍)」「特定の神経活動パタンに依存したPETイメージング解析法の確立(研究代表者:崔翼龍)」、同新学術領域研究(研究領域提案型)「神経回路活動を計測する非侵襲的イメージング技術(研究代表者:尾上浩隆、研究分担者:崔翼龍)」、同若手研究「線維筋痛症モデルにおけるミクログリアを介したリゾホスファチジン酸分子機構の解明(研究代表者:根山広行)」による助成を受けて行われました。MOR-Creラットは文部科学省(MEXT)学術変革領域研究(学術研究支援基盤形成)「先端モデル動物支援プラットフォーム(Advanced Animal Model Support:AdAMS)」の支援を受けて作製しました。
原論文情報
Hiroyuki Neyama, Yuping Wu, Yuka Nakaya, Shigeki Kato, Tomoko Shimizu, Tsuyoshi Tahara, Mika Shigeta, Michiko Inoue, Kazunari Miyamichi, Natsuki Matsushita, Tomoji Mashimo, Yoshiki Miyasaka, Yi Dai, Koichi Noguchi, Yasuyoshi Watanabe, Masayuki Kobayashi, Kazuto Kobayashi, Yilong Cui, “Opioidergic activation of the descending pain inhibitory system underlies placebo analgesia”, Science Advances, 10.1126/sciadv.adp8494
発表者
理化学研究所
生命機能科学研究センター 生体機能動態イメージング研究チーム(研究当時)
チームリーダー(研究当時)崔 翼龍(サイ・ヨクリュウ)
(現 分子標的化学研究チーム 客員主管研究員)
研究員(研究当時)根山 広行(ネヤマ・ヒロユキ)
健康・病態科学研究チーム(研究当時)
チームリーダー(研究当時)渡辺 恭良(ワタナベ・ヤスヨシ)
(現 分子標的化学研究チーム 客員主管研究員)
大阪大学 医学部附属動物実験施設実験動物学
助教 宮坂 佳樹(ミヤサカ・ヨシキ)
報道担当
理化学研究所 広報室 報道担当