2025-11-13 Tii技術情報研究所
第1章 合成生物学・バイオテクノロジー分野における2025年の注目の研究と技術
【1】感染症治療に向けた革新的バイオテクノロジー
- 技術概要:京都大学の”Collectron”は、PEG修飾カチオン性リポソーム+抗体によって血液中の細菌を選択的に除去する新技術。磁性ビーズを使わず、抗原抗体反応+静電吸着のハイブリッド設計。
- 効果/課題/展望:高い除去効率と生体適合性を持つが、安全性検証と臨床応用には更なる検証が必要。抗菌剤に代わる治療の可能性を開く。
 感染症治療に向けた革新的バイオテクノロジーを開発~血液中のバクテリアを物理的に除去~2025-03-21 京都大学京都大学の研究グループは、血液中のバクテリアを体外の循環装置で除去する技術「Collectron」を開発しました。この技術は、ナノサイズのリポソームを核とし、バクテリアを選択的に吸着する一方で、赤血球や白血...
感染症治療に向けた革新的バイオテクノロジーを開発~血液中のバクテリアを物理的に除去~2025-03-21 京都大学京都大学の研究グループは、血液中のバクテリアを体外の循環装置で除去する技術「Collectron」を開発しました。この技術は、ナノサイズのリポソームを核とし、バクテリアを選択的に吸着する一方で、赤血球や白血...
【2】ファージを利用した遺伝子水平伝播の新機構
- 技術概要:ジャンボファージが細菌の防御遺伝子(制限修飾系)を他細胞へ運ぶ新たな伝播機構”I55″を発見。
- 効果/課題/展望:DNAの大量転送が可能なバイオツールへの応用が期待されるが、制御性や意図しない拡散のリスクも。
 バクテリアがファージを利用して防御機構を拡散(Jumbo Phages for Gene Transfer in Bacteria)2025-11-03 マックス・プランク研究所マックス・プランク進化生物学研究所(ポール・レイニー所長、ヤンソン・ジャオ研究員ら)は、バクテリアが巨大ファージ(ジャンボファージ)を利用して自身の防御遺伝子を拡散させる仕組みを発見した。研究で...
バクテリアがファージを利用して防御機構を拡散(Jumbo Phages for Gene Transfer in Bacteria)2025-11-03 マックス・プランク研究所マックス・プランク進化生物学研究所(ポール・レイニー所長、ヤンソン・ジャオ研究員ら)は、バクテリアが巨大ファージ(ジャンボファージ)を利用して自身の防御遺伝子を拡散させる仕組みを発見した。研究で...
【3】スジアオノリでの精密ゲノム編集
- 技術概要:緑藻スジアオノリに抗生物質選択マーカー+CRISPR/Cas9で正確なノックインを実現。
- 効果/課題/展望:非モデル生物への適用に道を開き、食品・環境技術に応用可能。藻類研究の加速が期待される。
 食用海藻スジアオノリで精密なゲノム編集技術を確立~遺伝子レベルで成長や香りの仕組みを解明する新たな道を開く~2025-10-23 北海道大学北海道大学の研究チームは、食用海藻スジアオノリで精密なゲノム編集を実現し、海藻類で初めて遺伝子レベルで機能を直接検証できる技術基盤を確立した。抗生物質耐性遺伝子を選択マーカーとし、CRISPR/Cas9を用い...
食用海藻スジアオノリで精密なゲノム編集技術を確立~遺伝子レベルで成長や香りの仕組みを解明する新たな道を開く~2025-10-23 北海道大学北海道大学の研究チームは、食用海藻スジアオノリで精密なゲノム編集を実現し、海藻類で初めて遺伝子レベルで機能を直接検証できる技術基盤を確立した。抗生物質耐性遺伝子を選択マーカーとし、CRISPR/Cas9を用い...
【4】核膜孔の分子選択輸送メカニズム解明
- 技術概要:核膜孔複合体内のFGリピートが、動的に選択輸送を制御している機構をモデル化。
- 効果/課題/展望:ナノポアやドラッグデリバリーへの応用が可能。合成ナノ構造への展開が鍵となる。
 核膜孔複合体が分子の通過を制御する仕組みを解明(New study reveals how tiny but powerful gatekeepers guard the nucleus)2025-10-21 ロックフェラー大学ロックフェラー大学とヘブライ大学の国際研究チームは、細胞核と細胞質をつなぐ「核膜孔複合体(NPC)」の分子輸送メカニズムを、実験データと計算モデルを統合して解明した。NPCは直径髪の毛の500分の1ほ...
核膜孔複合体が分子の通過を制御する仕組みを解明(New study reveals how tiny but powerful gatekeepers guard the nucleus)2025-10-21 ロックフェラー大学ロックフェラー大学とヘブライ大学の国際研究チームは、細胞核と細胞質をつなぐ「核膜孔複合体(NPC)」の分子輸送メカニズムを、実験データと計算モデルを統合して解明した。NPCは直径髪の毛の500分の1ほ...
【5】ユーグレナにおける非従来型イントロンの機能
- 技術概要:GT-AGとは異なるスプライシングを持つイントロンの規則を解明し、合成イントロンで検証。
- 効果/課題/展望:新たなRNA制御ツールとして、発現制御やRNA治療に貢献。機能予測が難しく設計に工夫が必要。
 ユーグレナにおけるイントロンの非従来型配列規則を解明~真核生物の新たな遺伝子発現の塩基配列ルール~2025-09-23 理化学研究所,東京大学,株式会社ユーグレナ,山形大学,鶴岡工業高等専門学校,高知大学,長崎大学,横浜市立大学理化学研究所らの共同研究チームは、ミドリムシ(ユーグレナ)のゲノムを解析し、真核生物で一般的な「GT-AGルー...
ユーグレナにおけるイントロンの非従来型配列規則を解明~真核生物の新たな遺伝子発現の塩基配列ルール~2025-09-23 理化学研究所,東京大学,株式会社ユーグレナ,山形大学,鶴岡工業高等専門学校,高知大学,長崎大学,横浜市立大学理化学研究所らの共同研究チームは、ミドリムシ(ユーグレナ)のゲノムを解析し、真核生物で一般的な「GT-AGルー...
【6】植物ベースのタンパク質生産拠点の設置
- 技術概要:横浜国大に遺伝子導入から抽出・精製までを統合した植物由来タンパク質生産の一気通貫拠点を設立。
- 効果/課題/展望:持続可能な医薬・酵素生産が可能に。プロセス標準化と大量生産技術が鍵。
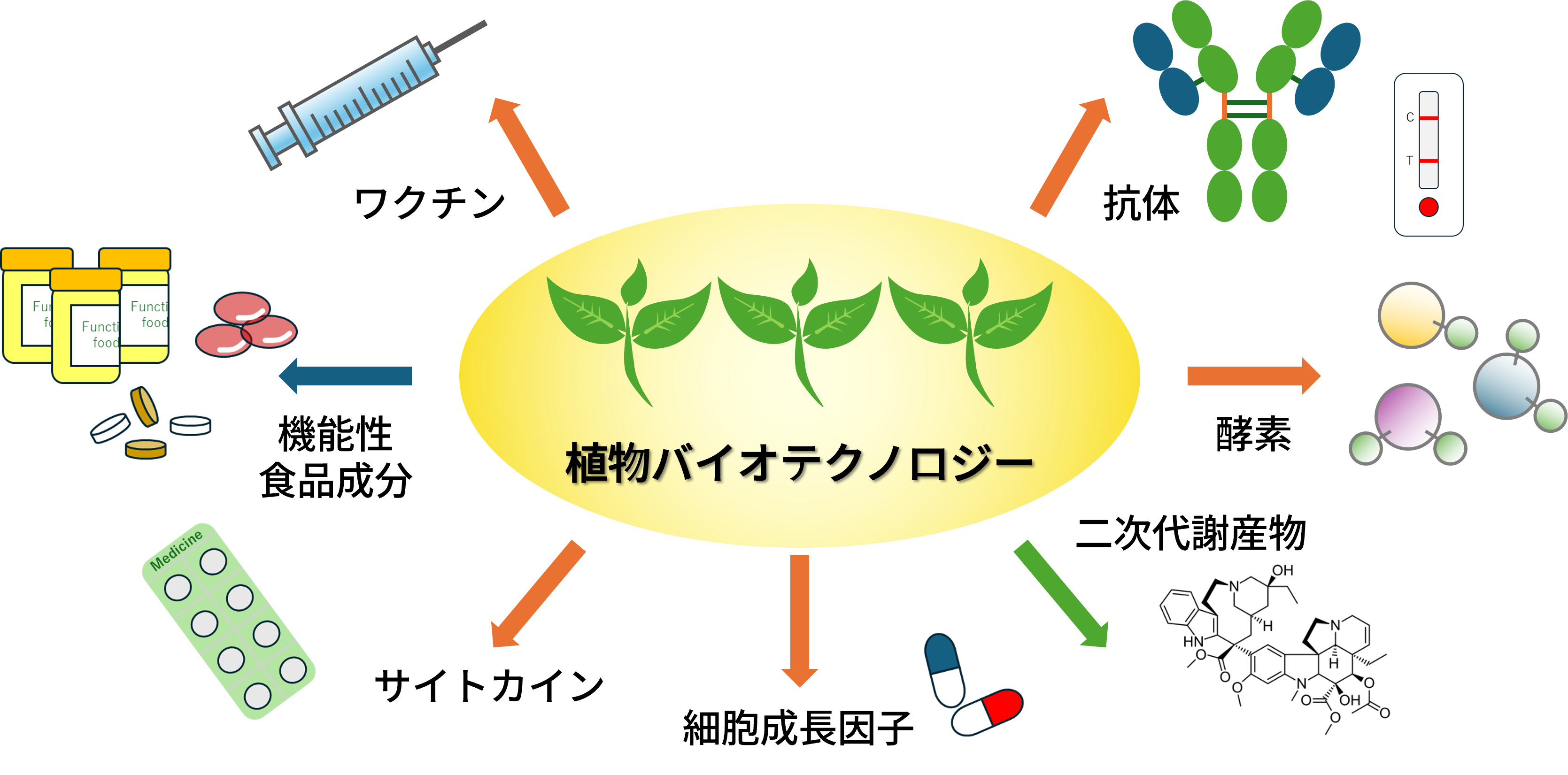 植物を用いた有用タンパク質生産のための研究開発拠点を設置しました~世界初の“一気通貫型システム”で次世代製造の扉を開く~2025-07-09 新エネルギー・産業技術総合開発機構,産業技術総合研究所,横浜国立大学.鹿島建設株式会社,デンカ株式会社,東京大学,北海道大学NEDOなど7機関は、植物を用いた有用タンパク質の一気通貫生産を実現する世界初の研究開発拠点を...
植物を用いた有用タンパク質生産のための研究開発拠点を設置しました~世界初の“一気通貫型システム”で次世代製造の扉を開く~2025-07-09 新エネルギー・産業技術総合開発機構,産業技術総合研究所,横浜国立大学.鹿島建設株式会社,デンカ株式会社,東京大学,北海道大学NEDOなど7機関は、植物を用いた有用タンパク質の一気通貫生産を実現する世界初の研究開発拠点を...
【7】皮膚常在微生物カクテルの標準提供
- 技術概要:NITEが日本初の皮膚微生物カクテル(14種細菌+4種真菌)を提供。
- 効果/課題/展望:マイクロバイオーム研究の標準化が進むが、実環境への適用と変動因子の検証が今後の課題。
 日本初、NBRCが皮膚常在微生物カクテルを提供開始 ~皮膚に存在する微生物群集の解析精度を向上!化粧品などの研究開発を加速~2025-06-03 製品評価技術基盤機構独立行政法人製品評価技術基盤機構(NITE)のバイオテクノロジーセンター(NBRC)は、2025年6月2日より、日本初となる「NBRC皮膚常在微生物カクテル」の提供を開始しました。このカクテルは、ヒ...
日本初、NBRCが皮膚常在微生物カクテルを提供開始 ~皮膚に存在する微生物群集の解析精度を向上!化粧品などの研究開発を加速~2025-06-03 製品評価技術基盤機構独立行政法人製品評価技術基盤機構(NITE)のバイオテクノロジーセンター(NBRC)は、2025年6月2日より、日本初となる「NBRC皮膚常在微生物カクテル」の提供を開始しました。このカクテルは、ヒ...
【8】シアノバクテリアの昼夜遺伝制御
- 技術概要:光合成微生物が昼夜で転写・代謝を切り替える仕組みを特定。酸化還元状態が鍵。
- 効果/課題/展望:生産性向上に貢献するが、環境条件下での安定性制御が必要。
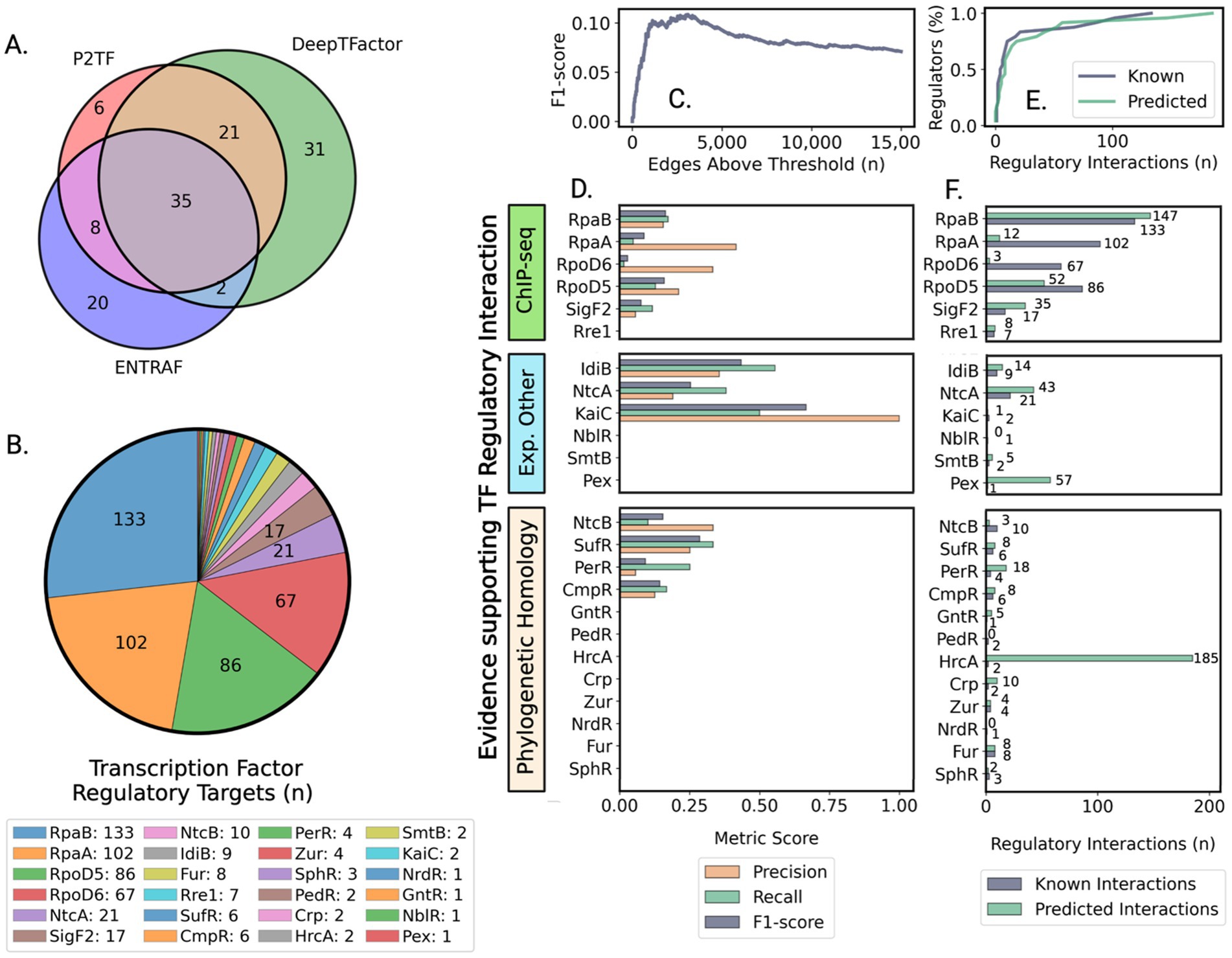 シアノバクテリアの昼夜遺伝制御の仕組みを解明(Gene Regulatory Networks Respond to Day and Night Cues to Affect Phenotype in Cyanbacteria)2025-05-19 パシフィック・ノースウェスト国立研究所(PNNL)太平洋岸北西部国立研究所(PNNL)の研究チームは、シアノバクテリア(光合成を行う微生物)の遺伝子制御ネットワークが昼夜の光環境に応じてどのように変化し、細胞の表現型に...
シアノバクテリアの昼夜遺伝制御の仕組みを解明(Gene Regulatory Networks Respond to Day and Night Cues to Affect Phenotype in Cyanbacteria)2025-05-19 パシフィック・ノースウェスト国立研究所(PNNL)太平洋岸北西部国立研究所(PNNL)の研究チームは、シアノバクテリア(光合成を行う微生物)の遺伝子制御ネットワークが昼夜の光環境に応じてどのように変化し、細胞の表現型に...
【9】タキソールの酵母によるバイオ合成
- 技術概要:抗がん剤タキソールを酵母で全合成し、コスト50%削減。
- 効果/課題/展望:高付加価値医薬品のバイオ生産が可能に。商業規模生産と品質管理が今後の鍵。
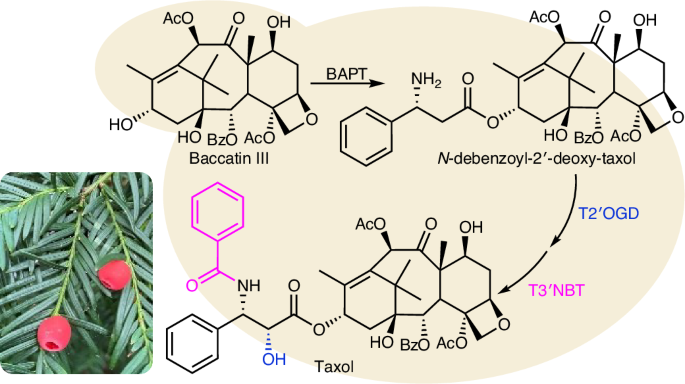 高価な癌治療薬の製造コストを半減する科学的ブレークスルー(Scientific breakthrough: We can now halve the price of costly cancer drug)2025-05-19 コペンハーゲン大学(UCPH)コペンハーゲン大学の研究チームは、抗がん剤タキソール(パクリタキセル)の生合成経路を完全に解明し、酵母を用いたバイオ合成に成功した。これにより、生産コストを最大50%削減し、環境負荷も大幅...
高価な癌治療薬の製造コストを半減する科学的ブレークスルー(Scientific breakthrough: We can now halve the price of costly cancer drug)2025-05-19 コペンハーゲン大学(UCPH)コペンハーゲン大学の研究チームは、抗がん剤タキソール(パクリタキセル)の生合成経路を完全に解明し、酵母を用いたバイオ合成に成功した。これにより、生産コストを最大50%削減し、環境負荷も大幅...
【10】合成炭素同化経路の開発
- 技術概要:ギ酸+CO₂からバイオマスを生産する還元的グリシン経路をCupriavidus necatorに導入。
- 効果/課題/展望:従来のカルビン回路を超える効率で、低炭素製造に革新。経路安定性と環境適応性が課題。
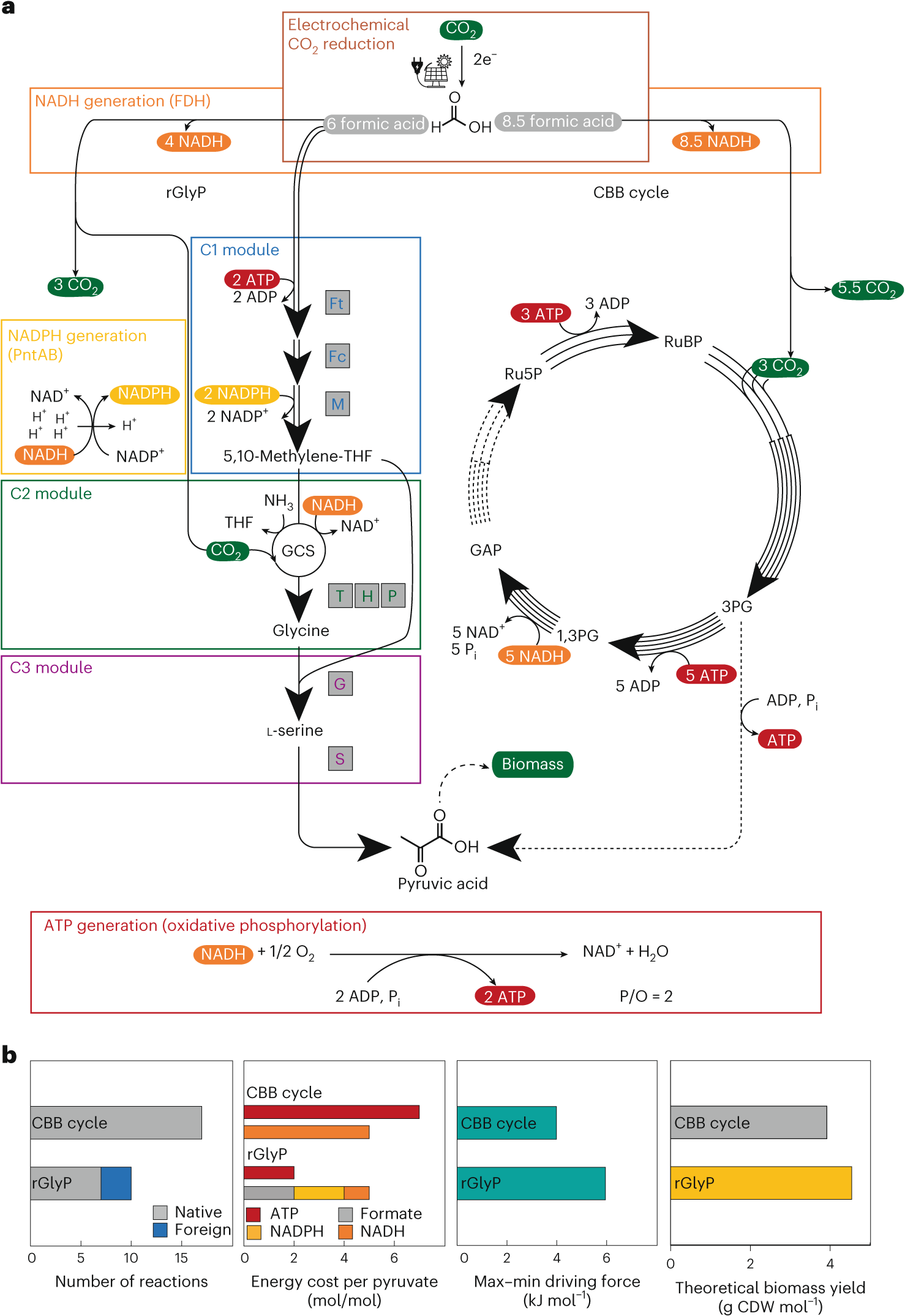 合成炭素同化が自然を超える新経路を発見 (Synthetic Carbon Assimilation Surpasses Nature)2025-02-27 マックス・プランク研究所マックス・プランク陸上微生物学研究所のトビアス・エルブ教授率いる国際研究チームは、人工的な炭素同化経路が自然のものよりも効率的に機能することを、生きた細菌で初めて実証しました。研究チームは、細菌...
合成炭素同化が自然を超える新経路を発見 (Synthetic Carbon Assimilation Surpasses Nature)2025-02-27 マックス・プランク研究所マックス・プランク陸上微生物学研究所のトビアス・エルブ教授率いる国際研究チームは、人工的な炭素同化経路が自然のものよりも効率的に機能することを、生きた細菌で初めて実証しました。研究チームは、細菌...
第2章 各分野ごとのトレンド分析
2025年には合成生物学の適用範囲が大きく広がり、産業応用・環境対応・医療革新のすべてに波及している。特に非モデル生物、代謝工学、マイクロバイオーム、セルファクトリー設計の4つの軸が今後の中核トピックになると考えられる。
1.合成生物学を用いたナノメディシン設計

概要
最近、Synthetic biology のアプローチをナノメディシン(超微粒子・ナノキャリア等)に適用し、「遺伝子工学的設計を伴うナノ医薬品」つまり “合成生物学ベースのナノメディシン” が議論されています。例えば「top‐down/bottom‐up」戦略を用い、細胞機能や合成生物構成部材を利用してナノ粒子を設計するという視点です。
効果
- 従来のナノメディシン(物理/化学的合成キャリア)と比較して、より生物機構を活用できるため ターゲティング精度/生体適合性/機能拡張性 が向上する可能性があります。
- 遺伝子工学で駆動させる設計により、「細胞内で自己生成・自己修復・反応駆動型」のナノ構造を実現できる可能性があります。
課題
- 生物由来/遺伝子制御系を含むため、安全性・免疫反応・長期安定性のリスクが増えます。
- ナノスケールかつ複雑な生物系統を設計・製造・規模化するコスト・技術的ハードルが高いです。
- 規制・倫理面で「遺伝子工学+医薬品」という掛け合わせの承認・検証プロセスが未成熟です。
今後の方向性
- モジュール化された設計部材(遺伝子回路+ナノキャリア)をライブラリ化し、汎用プラットフォーム化が進むでしょう。
- 安全規格・標準化(合成生物安全、ナノ医薬品規制)の枠組み整備が急務です。
- 臨床移行を視野に、小型/低コスト/高スループットの製造プロセス(例:セルフアッセイ、マイクロ流体系)開発が鍵となります。
2.マルチプレックス/プログラム可能なゲノム編集ツールの進展

概要
ゲノム編集技術、特に CRISPR‑Cas system を基盤としたマルチプレックス編集(複数遺伝子・複数座位を同時に編集)や、プログラム可能な制御(ベースエディター、プライムエディター、ミニ/スモールCas バリアントなど)に関するレビューが2025年にも出ています。
効果
- 複雑な遺伝子ネットワークや代謝回路を一括で改変できるため、 微生物セルファクトリー や 作物改良 、医療細胞治療 など幅広い応用が加速します。
- 編集効率・スピード・精度が向上することで、研究→産業化の移行が短縮できます。
課題
- 多座位編集ではオフターゲット(非目的部位の変異)や多重編集による相互作用リスクが増えます。
- 遺伝子導入・編集成分のデリバリー(特に高効率・低毒性・体内利用)には依然として技術的な壁があります。
- 倫理・法規制(特にヒト/作物編集)および特許・知財の複雑化も課題です。
今後の方向性
- 小型Cas、改良ベースエディター、細胞外送達技術(ナノキャリア、ウイルス様粒子、金属有機骨格など)が実用化フェーズに入りそうです。
- 自動化・AI支援による遺伝子編集設計プラットフォームが普及し、「設計→構築→試験」のサイクルが短縮化されるでしょう。
- 特に環境微生物・非モデル生物への展開が、既存のモデル生物偏重から脱却する鍵となります。
3.低炭素/CO₂アップサイクルを目指す合成生物システム

概要
気候変動・カーボンニュートラルの文脈から、CO₂を有価化化合物(長鎖炭化物など)に変換する「合成生物学 × 電触媒/バイオ合成 ハイブリッドシステム」が注目されています。
効果
- CO₂という豊富かつ環境負荷のある原料を、有機物/化学品へ変換できれば、 循環型バイオエコノミー の実現に大きく寄与します。
- 微生物や細胞を使った合成により、化石燃料依存を減らす新たな生産方式を構築できます。
課題
- 電触媒からバイオ合成モジュールへの連携(互換性・効率面)に技術的ギャップがあります。
- 微生物/酵素系が高濃度CO₂・高圧環境・低温環境などに耐える必要があり、スケールアップが難しいです。
- 投資・規模化・安定運転(特に長期間運転)に関する産業化ハードルが高いです。
今後の方向性
- モジュール化/プラグ&プレイ型の電触媒–微生物連携プラットフォームが開発されていくでしょう。
- 合成生物学における “カーボンネガティブ” 技術(CO₂を固定→有機化合物生成)が、政策・資金面で優遇される傾向が強まります。
- 非炭素系原料(例:C1化合物、メタン、廃ガス)を活用する次世代バイオプロセスとして展開が加速しそうです。
4.細胞外・セルフリー合成系および合成生物部品モジュール化
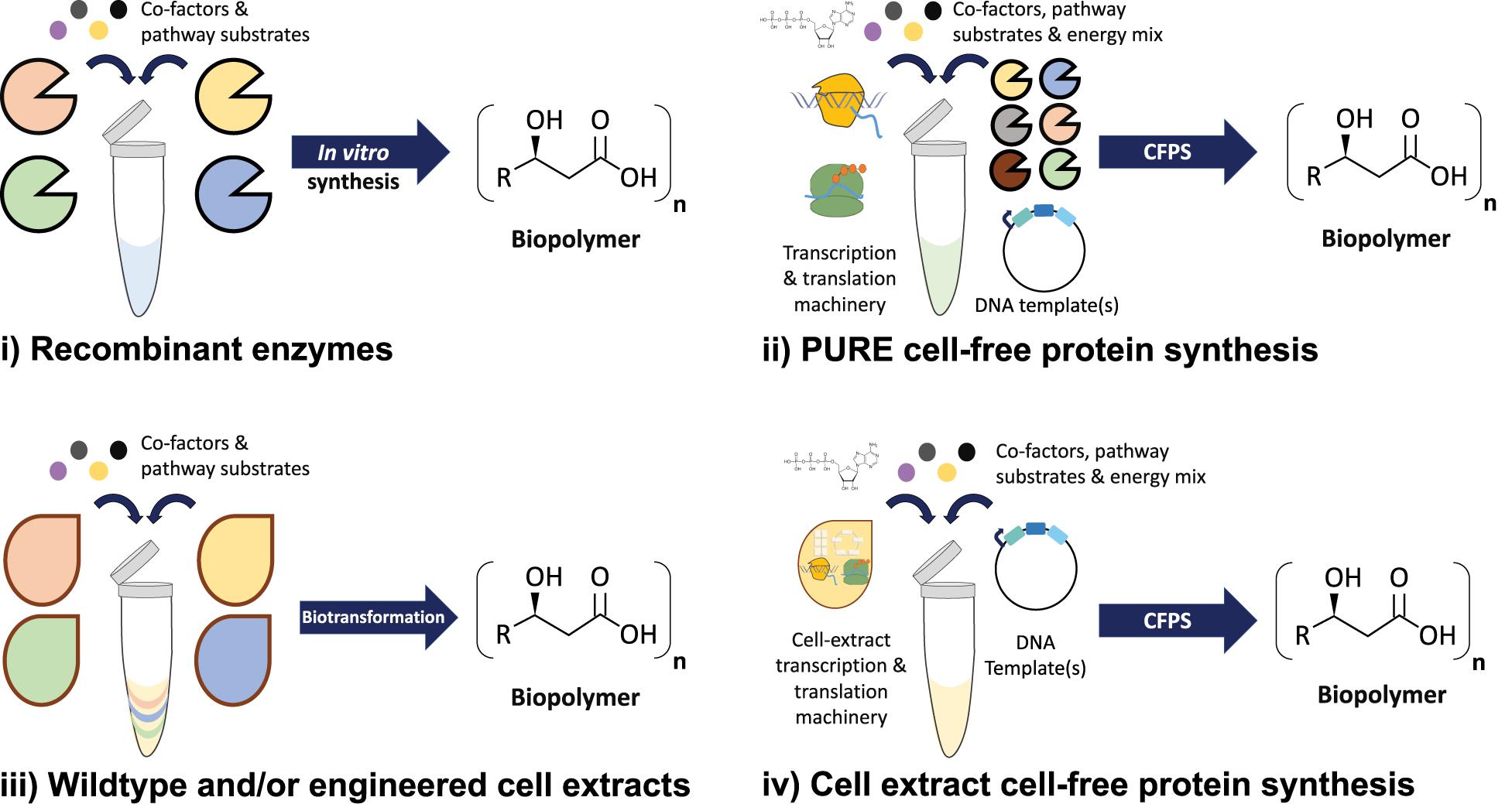
概要
合成生物学における「部材(パーツ)・デバイス・モジュール」のライブラリ化、および細胞外(セルフリー)環境での生合成系構築が加速しています。たとえば、設計可能な転写終止構造、アプタマー・スイッチなどを使った遺伝子回路制御の研究もこの枠に含まれます。
効果
- 部品の標準化・モジュール化により、設計→構築→テストのサイクルが高速化します。
- セルフリー系は生細胞特有の代謝/制御バイアスや安全問題を回避でき、プロトタイピングや産業化に好適です。
課題
- モジュール設計において「予測可能性」「再現性」が依然として課題です。生体環境では予期せぬ相互作用が起きやすいです。
- セルフリー系ではスケールアップ・コスト削減・連続運転・安定性の確保が技術的に難しいです。
今後の方向性
- 「デザインビルドテストループ(DBTL)」の自動化・AI統合が進み、部品ライブラリ+設計支援ツールがより普及するでしょう。
- 工業用に向けた「キメラ微生物/整備済みセルファクトリー」+細胞外モジュール併用型ハイブリッド生産系が見えてきそうです。
- 標準化/相互運用性(部品間のインターフェース、データフォーマット)を整備することで、産業界参入の門戸が広がります。
5.医療・治療応用における合成生物学の拡大
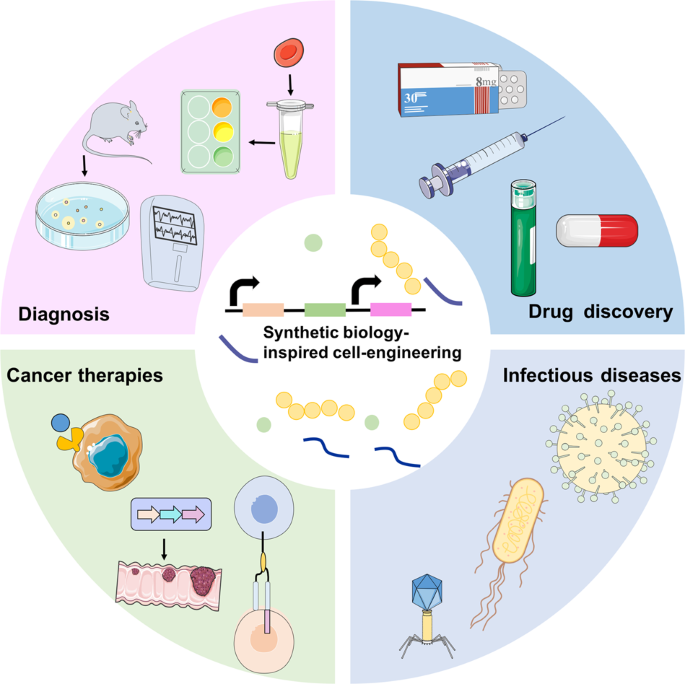
概要
合成生物学技術(遺伝子編集、細胞工学、ナノキャリアなど)が医療・治療分野へさらに拡大しています。特に細胞治療(CAR‑Tなど)、遺伝子治療、バイオセンサー、ナノ医薬品、etc。過去数年のレビューも踏まえ、2025年時点でもそのトレンドは継続中です。
効果
- 従来治療では困難だった疾患(多遺伝子疾患、希少疾患、個別化医療)に対し、 精密・個別化/セルベース治療 が現実味を帯びてきています。
- バイオセンサー・診断用途でも合成生物学が「生きた部材」を活用した新たなモダリティ(例:細胞ベースセンサー、人工遺伝子回路)を提供可能です。
課題
- 安全性(腫瘍化、免疫反応、長期影響)、コスト、スケーラビリティが高いハードルです。
- 医療機器・医薬品/生物製剤としての規制枠組みへの適合・承認に時間がかかります。
- 技術的にも「オフターゲット編集」「治療細胞の生存・機能維持」「デリバリー効率」などが課題です。
今後の方向性
- より安全性・効率性の高いセル・遺伝子治療プラットフォームが構築され、商用実例が増えるでしょう。
- 合成生物学+デジタルヘルス(AI/モニタリング)+バイオ製造の融合が進み、「オンサイト生産」「個別対応生製剤」の流れが加速。
- 倫理・社会・規制の議論(遺伝子・細胞改変、データ活用、コストアクセス)も活発化すると考えられます。
第3章 総合トレンド分析/まとめ
トレンドの共通テーマ
- モジュール化・標準化・自動化:設計部材(遺伝子回路、部品、セルファクトリー)のライブラリ化が進み、設計‐構築‐試験のサイクルが加速しています。
- 多分野融合型アプローチ:合成生物学がナノテクノロジー、電触媒、細胞治療、AI設計など他分野と結びつき、「ハイブリッド技術」が目立ちます。
- 産業化・スケール化フェーズの到来:研究室レベルのデモから、実用/商用化を見据えた動きが強まっており、低炭素原料、医療用途、細胞ファクトリーなどの「次世代バイオ産業」が形を帯びつつあります。
効果/機会
- 環境(CO₂削減・バイオ製造)、医療(個別化治療・新薬開発)、材料・化学(バイオベース化合物)など、社会的インパクトの大きな用途で合成生物学が鍵技術となりつつあります。
- 競争優位性(生産コスト削減、製造スピード、カスタマイズ可能性)をもたらすため、企業・投資家の注目も増しています。
課題/リスク
- 技術的な成熟度(信頼性/再現性/スケール)や安全性・規制対応が追いついていない領域が多く、実用化段階での“落とし穴”があります。
- 倫理・社会的受容(遺伝子改変、細胞工場、バイオ安全性)および知財・産業構造の整備が遅れており、進展には制度的な対応も必要です。
- コストとアクセス(特に医療用途)も大きな壁で、「誰が・どこで・どのように」この技術を享受できるかが問われています。
今後の方向性
- 2025年以降、技術の“プロトタイプ→量産/実装”への移行期にあると考えられます。部材ライブラリ/セルファクトリー/デザインツール等が整備されることで、ブループリント(設計図)的な開発が主流化するでしょう。
- 規制・標準・インフラ(バイオデザインプラットフォーム、データ共有、セルファクトリー設備、バイオ安全ネットワーク)が追いかける形で発展する必要があります。
- また、発展途上国・中小企業・地域拠点向け“小型・低コスト”バイオ製造技術の普及も視野に入ると思われます。
- 社会的・倫理的な対話も並行して進み、「合成生物学が社会実装されるための環境づくり」が重要となります。