遺伝性のリンパ腫に生じる遺伝子変異の全体像を動物実験で明らかに
2019-03-25 量子科学技術研究開発機構
発表のポイント
- DNA1)修復遺伝子の異常によりリンパ腫を生じるモデルマウスを用いて、リンパ腫の全遺伝子を解析した
- 被ばくしていないマウスに比べて、被ばくしたマウスではリンパ腫の発生率が高いにもかかわらず、遺伝子変異の数や変異パターンには違いがないことがわかった
- 放射線には、遺伝子突然変異2)の誘発とは別のメカニズムでがんの発生を促進する作用があることが示唆された
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)放射線医学総合研究所放射線影響研究部の柿沼志津子部長、発達期被ばく影響研究チームの臺野和広研究統括らは、弘前大学の吉田光明教授、北海道科学大学の中田章史准教授らとの共同研究により、DNA修復機構の異常が原因で発生するリンパ腫のモデルマウスを用いて、放射線による発がんには遺伝子突然変異の誘発とは別のメカニズムがあることを明らかにしました。
放射線はDNAを傷つけることが知られています。DNAの傷は、通常正しく修復されますが、時として、修復のミスによる突然変異を引き起こします。がんは、このようなDNAの突然変異が蓄積することで発生します。研究チームは、放射線により生じたDNAの傷の修復が上手く行われない場合、より多くの突然変異や放射線被ばく特有の変異を蓄積したがんが発生するのではないかと考えました。
そこで研究チームは、DNAミスマッチ修復3)と呼ばれるDNAの修復機構で働く酵素Mlh1の機能を欠損させた遺伝性リンパ腫のモデルマウスを用いて、放射線を照射していない群、あるいは生後に放射線を照射した群に発生したリンパ腫について、その発生率や遺伝子変異を調べました。遺伝子変異の解析には、その全体像を解明するため、次世代シーケンス4)と呼ばれる最新のゲノムDNA解読技術が用いられました。その結果、リンパ腫の発症率は、照射群の方が高いにもかかわらず、両群のリンパ腫に生じた遺伝子変異の数や変異パターンには違いが見られないことがわかりました。
これは、放射線にはDNAを傷つけ遺伝子突然変異を誘発する以外の別の作用、例えば、がん細胞の周囲の環境を変化させることによって腫瘍の発生を促進するといった作用がある可能性を示唆しています。今後、放射線ががんのリスクを高める仕組みについて、その詳細を明らかにすることで、より科学的な発がんリスクの評価や、リスクを低減する方法の開発に繋がると考えられます。また研究チームは、リンパ腫において高頻度に突然変異が見られる遺伝子を探索し、新たに29個の変異遺伝子を同定することに成功しました。本研究により同定された遺伝子変異やシグナル伝達経路の異常に関する情報は、それらを標的とする遺伝性リンパ腫の新しい治療法の開発に繋がると期待されます。
本研究は、がん研究分野で重要な論文が数多く発表されている英国の科学雑誌「Carcinogenesis」にオンライン掲載(2019年2月4日付)されました。また、文部科学省科学研究費補助金JP15H01834の援助を一部受けています。
研究開発の背景と目的
放射線は、細胞の中にあるDNAを傷つける作用を持っていますが、細胞にはDNAの損傷を治す能力が備わっており、傷ついたDNAは通常、細胞内の修復酵素の働きよって正しく修復されます(図1)。しかしながら、時としてDNAの修復ミスにより突然変異が引き起こされることが知られています。また最近の研究によって、がんは、細胞の中でDNAの突然変異が蓄積し、遺伝子が正常に機能しなくなることで起こる病気であることがわかってきました。
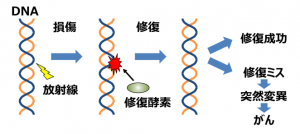
図1 放射線によるDNA損傷とその修復
研究チームは、放射線により生じたDNAの傷の修復が上手く行われない場合、より多くの突然変異や放射線被ばく特有の変異を蓄積したがんが発生するのではないかと考え、DNAミスマッチ修復と呼ばれるDNAの修復機構で働く酵素Mlh1の機能を欠損させたマウスに発生するリンパ腫に注目しました。
今回、研究チームは、次世代シーケンスと呼ばれる最新のゲノムDNA解読技術を用いて、放射線を照射していないマウスと、放射線を照射したマウスに発生したそれぞれのリンパ腫について全遺伝子解析5)を行い、遺伝子突然変異の全体像を比較しました。
研究の手法と成果
研究チームは、DNAミスマッチ修復酵素Mlh1の機能を欠損させたマウスを用いて、放射線を照射していない群(非照射群)と、幼若期(2週齢)や若齢成体期(10週齢)のマウスに放射線(X線、2 Gy)を照射した群に発生したリンパ腫の解析を行いました。その結果、非照射群では、約7割のマウスにリンパ腫の発生が見られたのに対し、放射線照射群では、全てのマウスにリンパ腫の発生が見られ、放射線照射によりリンパ腫の発生率が増加することがわかりました(図2)。
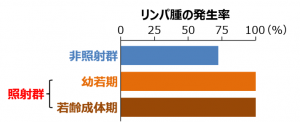
図2 DNA修復酵素Mlh1の機能欠損マウスにおけるリンパ腫の発生率
次に、全遺伝子解析によりリンパ腫に生じた突然変異を調べたところ、予想に反して、非照射群に生じたリンパ腫と放射線被ばく群に発生したリンパ腫では、遺伝子突然変異の数だけでなく、変異のパターン(例えば、DNAを構成している元の塩基(A(アデニン)、T(チミン)、G(グアニン)、C(シトシン))が、別の塩基に置き換わる変異のパターン)の割合にも違いが見られないことがわかりました(図3)。
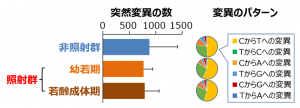
図3 DNA修復酵素Mlh1の機能欠損により発生した
リンパ腫における遺伝子突然変異の数と変異パターンの割合
今後の展開
本研究により、放射線被ばくがDNA修復機能の欠損したマウスにおいてリンパ腫の発生率を高めるにもかかわらず、リンパ腫のゲノムDNAには放射線の影響が見られないことがわかりました。この結果は、放射線にはDNAを傷つけ遺伝子突然変異を誘発する以外の別の作用、例えば、がん細胞の周囲の環境を変化させることによって腫瘍の発生を促進するといった作用がある可能性を示唆しています。今後、放射線ががんのリスクを高める仕組みについて、その詳細を明らかにすることで、より科学的な発がんリスクの評価や、リスクを低減する方法の開発に繋がると考えられます。
また、両親から受け継いだDNAミスマッチ修復遺伝子の両方に異常がある場合、小児の白血病やリンパ腫を発症することが知られています。そこで研究チームは、DNA修復機能の欠損したマウスに発症したリンパ腫において高頻度に突然変異が見られる遺伝子を探索し、新たに29個の変異遺伝子を同定しました。
その結果、正常なリンパ球細胞に必要な遺伝子(Ikzf1、Notch1、Bcl11b、Ep300)や、がん細胞の増殖に関与する指令(シグナル)を伝達する経路の活性化に関わる遺伝子(Pten、 Trp53)を始めとする様々な遺伝子に突然変異が引き起こされていることがわかりました(図4)。本研究により同定された遺伝子変異やシグナル伝達経路の異常に関する情報は、それらを標的とする遺伝性リンパ腫の新しい治療法の開発に繋がると期待されます。
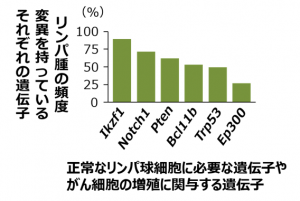
図4 DNA修復酵素Mlh1の機能欠損により発生したリンパ
腫に見つかった変異遺伝子(一部)
用語解説
1)DNA
デオキシリボ核酸(Deoxyribonucleic acid)の略語。生物の遺伝情報を担うDNAは、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)という4種類の塩基から構成されています。この4種類の塩基の並ぶ配列(順序)の組み合わせによる情報によって遺伝子の特性が決められています。
2)突然変異
DNAの塩基の1個が他の塩基に置き換わること。この他にも、塩基の間違った挿入や欠失といった変化があります。
3)DNAミスマッチ修復
DNAに生じる塩基のミスマッチ(塩基の間違った結合や挿入、欠失など)を修復する機構のこと。
4) 次世代シーケンス
DNAの塩基配列データを並列に大量取得することによって、高速に塩基配列情報を解読する技術のこと。
5) 全遺伝子解析
ゲノムDNAのなかで遺伝子の情報を持っている領域(エクソン領域)の塩基配列を選択的に解読する手法のこと。エクソン領域は、遺伝子からタンパク質を作るための塩基配列情報がある重要な領域であるため、がんの原因となる変異が存在しています。
掲載論文
Kazuhiro Daino, Atsuko Ishikawa, Tomo Suga, Yoshiko Amasaki, Yotaro Kodama, Yi Shang, Shinobu Hirano-Sakairi, Mayumi Nishimura, Akifumi Nakata, Mitsuaki Yoshida, Takashi Imai, Yoshiya Shimada, Shizuko Kakinuma. Mutational landscape of T-cell lymphoma in mice lacking the DNA mismatch repair gene Mlh1: no synergism with ionizing radiation. Carcinogenesis (in press). DOI: 10.1093/carcin/bgz013