平成30年1月29日 大阪大学,日本医療研究開発機構
研究成果のポイント
- 視神経脊髄炎患者の病態を抗体を用いて、新しい動物病態モデルを開発した。
- 視神経脊椎炎を発症したラットにおいて、軸索再生阻害因子RGMaを抑制することにより、神経症状の緩和が認められた。
- 視神経脊髄炎に対して新しい治療薬になることが期待される。
概要
大阪大学の山下俊英教授(大学院医学系研究科/生命機能研究科/免疫学フロンティア研究センター 分子神経科学)、藤田幸助教(大学院医学系研究科/免疫学フロンティア研究センター 分子神経科学)、望月秀樹教授(大学院医学系研究科 神経内科学)らの研究グループは、軸索再生阻害因子※1であるRepulsive guidance molecule a(RGMa)※2を抑制することで、視神経脊髄炎モデル動物の病状を緩和できることを発見しました。
視神経脊髄炎(NMO)※3は、主に視神経炎と横断性脊髄炎を特徴とする疾患です。以前は炎症によって脱髄が生じる多発性硬化症※4の一部と考えられていましたが、NMO患者の血清中には中枢神経系のアストロサイトに※5多く発現しているアクアポリン4※6に対する自己抗体(抗AQP4抗体)の存在が認められることがわかり、現在では別の疾患と考えられています。NMOの多くは再発と寛解を繰り返すことが多く、症状は徐々に増悪します。NMOでは多発性硬化症の治療薬が有効ではないとの報告もあり、再発を予防するためにはステロイドや免疫抑制薬の長期投与が必要になることがあります。このため、NMOの症状を緩和する新たな治療薬の開発が待たれています。
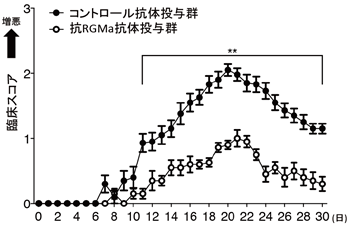
今回、山下教授らの研究グループは、神経軸索の再生を阻害するタンパク質であるRGMaの機能を抑制することで、NMOを発症したラットの神経症状を緩和できることを明らかにしました。抗AQP4抗体を投与して作出した新たなNMOモデル動物では、神経症状の増悪、脊髄病変が認められます。このラットにRGMaタンパク質の機能を阻害する中和抗体を静脈内注射することで、これらの病態を抑制できることがわかりました(図1)。
本研究成果により、既存の治療薬では十分に治療できないNMOに対して、RGMaの機能を阻害することで有効な治療法の開発に繋がることが期待されます。
本研究の成果は、英国科学誌「Scientific Reports」に、1月8日(月)(日本時間)に公開されました。
視神経脊髄炎(NMO)※3は、主に視神経炎と横断性脊髄炎を特徴とする疾患です。以前は炎症によって脱髄が生じる多発性硬化症※4の一部と考えられていましたが、NMO患者の血清中には中枢神経系のアストロサイトに※5多く発現しているアクアポリン4※6に対する自己抗体(抗AQP4抗体)の存在が認められることがわかり、現在では別の疾患と考えられています。NMOの多くは再発と寛解を繰り返すことが多く、症状は徐々に増悪します。NMOでは多発性硬化症の治療薬が有効ではないとの報告もあり、再発を予防するためにはステロイドや免疫抑制薬の長期投与が必要になることがあります。このため、NMOの症状を緩和する新たな治療薬の開発が待たれています。
今回、山下教授らの研究グループは、神経軸索の再生を阻害するタンパク質であるRGMaの機能を抑制することで、NMOを発症したラットの神経症状を緩和できることを明らかにしました。抗AQP4抗体を投与して作出した新たなNMOモデル動物では、神経症状の増悪、脊髄病変が認められます。このラットにRGMaタンパク質の機能を阻害する中和抗体を静脈内注射することで、これらの病態を抑制できることがわかりました(図1)。
本研究成果により、既存の治療薬では十分に治療できないNMOに対して、RGMaの機能を阻害することで有効な治療法の開発に繋がることが期待されます。
本研究の成果は、英国科学誌「Scientific Reports」に、1月8日(月)(日本時間)に公開されました。
研究の背景
NMOでは視神経と脊髄に比較的短期間に強い炎症性の障害を生じ、多発性硬化症と比較してしばしば重篤な症状を呈します。視神経障害では最終視力0.1と視機能障害性が強く、1/3の症例で片眼が失明しています。脊髄炎では3椎体以上の大きな病変を生じるため、日常生活に大きな障害をきたす危険があります。NMOは再発性が高く、平均で年に1回再発します。NMOの治療として、急性期におけるステロイドの大量投与や血漿交換療法が有効と考えられていますが、高いコストや副作用のリスクがあります。再発を繰り返すと視力予後が極めて不良であるため、再発防止の目的で年単位にわたる持続的な少量ステロイド投与や免疫抑制薬の併用が必要になります。また、多発性硬化症の再発予防に有効なIFN-βが、NMOに対しては効果を示さないケースがあります。このように、現行のNMO治療法では投薬期間や副作用モニタリングが長期化するために、新しい治療薬の開発が待ち望まれています。
NMO患者の血清中では、抗AQP4抗体が検出されており、NMOの診断基準としてこの抗体の存在が含まれています。AQP4は中枢神経系のグリア細胞であるアストロサイトの足突起や上衣細胞、毛細血管内皮細胞などに発現しており、中枢の水代謝に関与しています。実験的に、抗AQP4抗体はアストロサイト障害性を示すことが報告されており、多発性硬化症の炎症性脱髄疾患とは異なる特異的な病態を示すと考えられています。
従来、NMOの病態研究では抗AQP4抗体をマウスやラットなどの齧歯類に投与する動物モデルが使用されてきました。従来のモデルでは、様々な部位に病変を生じるために、メカニズムを検証することが困難でした。今回、山下教授らのグループでは、患者由来の抗AQP4抗体を脊髄内に局所投与する新しいNMOモデル動物を作出し、NMOの病態解明や神経症状を緩和する手法の開発をすすめました。
NMO患者の血清中では、抗AQP4抗体が検出されており、NMOの診断基準としてこの抗体の存在が含まれています。AQP4は中枢神経系のグリア細胞であるアストロサイトの足突起や上衣細胞、毛細血管内皮細胞などに発現しており、中枢の水代謝に関与しています。実験的に、抗AQP4抗体はアストロサイト障害性を示すことが報告されており、多発性硬化症の炎症性脱髄疾患とは異なる特異的な病態を示すと考えられています。
従来、NMOの病態研究では抗AQP4抗体をマウスやラットなどの齧歯類に投与する動物モデルが使用されてきました。従来のモデルでは、様々な部位に病変を生じるために、メカニズムを検証することが困難でした。今回、山下教授らのグループでは、患者由来の抗AQP4抗体を脊髄内に局所投与する新しいNMOモデル動物を作出し、NMOの病態解明や神経症状を緩和する手法の開発をすすめました。
本研究の成果
研究グループでは、NMO患者由来の抗体を脊髄に局所投与した新たなNMOモデルラットを作成しました。患者由来の抗体を投与したラットでは神経症状を示す臨床スコアが悪化し、抗体投与部位周辺でアストロサイトの減少が見られました。このモデルラットに対して抗RGMa抗体を静脈内投与すると、神経症状の発症が遅れ、臨床スコアが改善し、神経症状が緩和することがわかりました(図1)。
抗RGMa抗体による神経症状改善の効果を検証するために組織学的な解析を行いました。NMOモデルラットの脊髄病変部位でみられるアストロサイトの減少が抑制されることがわかりました(図2)。また、NMOモデル動物では病変部位に炎症性細胞の集積が認められますが、抗RGMa抗体の投与によって、炎症性細胞の集積が抑制されることがわかりました。NMOの病態の一因として、神経軸索への障害が知られており、NMOモデルラットでも神経軸索の減少が認められました。一方、抗RGMa抗体を投与したNMOラットでは、神経軸索の減少が抑制され、病変部位で残存する軸索数が増加していることがわかりました(図3)。これらの知見から、抗RGMa抗体が炎症細胞の集積と軸索障害を抑制し、NMOの神経症状を緩和することが示唆されました。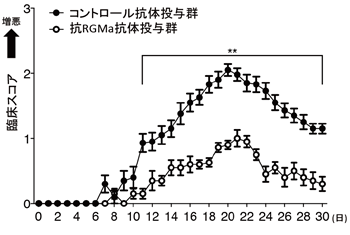
図1.抗RGMa抗体投与によるNMO神経機能スコアの改善
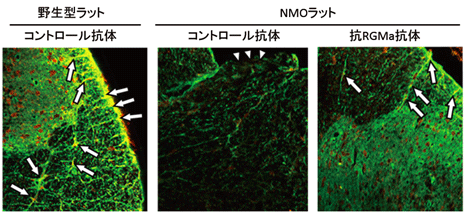
図2.NMOラットの脊髄内病変部位では、アストロサイト(緑)が減少する(写真中央、矢頭)。抗RGMa抗体によって、NMOラットでのアストロサイト減少が抑制される(写真右、矢印)。
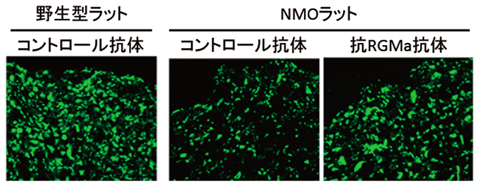
図3.NMOラットの脊髄内病変部位では、神経軸索(緑)が減少する(写真中央)。抗RGMa抗体によって、NMOラットでの軸索の減少が抑制される(写真右)。
抗RGMa抗体による神経症状改善の効果を検証するために組織学的な解析を行いました。NMOモデルラットの脊髄病変部位でみられるアストロサイトの減少が抑制されることがわかりました(図2)。また、NMOモデル動物では病変部位に炎症性細胞の集積が認められますが、抗RGMa抗体の投与によって、炎症性細胞の集積が抑制されることがわかりました。NMOの病態の一因として、神経軸索への障害が知られており、NMOモデルラットでも神経軸索の減少が認められました。一方、抗RGMa抗体を投与したNMOラットでは、神経軸索の減少が抑制され、病変部位で残存する軸索数が増加していることがわかりました(図3)。これらの知見から、抗RGMa抗体が炎症細胞の集積と軸索障害を抑制し、NMOの神経症状を緩和することが示唆されました。

図1.抗RGMa抗体投与によるNMO神経機能スコアの改善

図2.NMOラットの脊髄内病変部位では、アストロサイト(緑)が減少する(写真中央、矢頭)。抗RGMa抗体によって、NMOラットでのアストロサイト減少が抑制される(写真右、矢印)。

図3.NMOラットの脊髄内病変部位では、神経軸索(緑)が減少する(写真中央)。抗RGMa抗体によって、NMOラットでの軸索の減少が抑制される(写真右)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、既存の薬剤では治療の難しかったNMOに対して、RGMaを抑制する手法が効果を示す可能性があります。今後、NMOの神経症状を緩和する画期的な治療薬になることが期待されます。
特記事項
本研究成果は、2017年1月8日に英国科学誌「Scientific Reports」(オンライン)に掲載されました。
- タイトル:
- “Inhibition of RGMa alleviates symptoms in a rat model of neuromyelitis optica”
- 著者名:
- Kana Harada1, Yuki Fujita1,2, Tatsusada Okuno3,4, Shogo Tanabe2, Yoshihisa Koyama5, Hideki Mochizuki4, and Toshihide Yamashita1,2,6
- 大阪大学 大学院医学系研究科 分子神経科学
- 大阪大学 免疫学フロンティア研究センター 分子神経科学
- 大阪大学 微生物病研究所 感染病態分野
- 大阪大学 大学院医学系研究科 神経内科学
- 大阪大学 大学院医学系研究科 神経細胞生物学
- 大阪大学 大学院生命機能研究科 分子神経科学
なお、本研究は、AMED難治性疾患実用化研究事業の一環として行われました。
用語説明
- ※1 軸索再生阻害因子
- 神経細胞同士を繋ぐケーブルのような役割をはたしている神経軸索は、損傷を受けると再生が困難となる。軸索再生阻害因子とは、軸索再生を阻害する原因となる一連のタンパク質群である。
- ※2 Repulsive guidance molecule a(RGMa)
- 軸索再生阻害因子の一種。神経軸索伸長の阻害や免疫応答の制御など多様な機能を有することが知られているタンパク質。
- ※3 視神経脊髄炎(NMO)
- 免疫システムの異常によって、視神経と脊髄に強い炎症性の障害を生じる中枢神経系の自己免疫疾患。患者の血清中に抗AQP4抗体が存在する。視覚障害や運動障害を引き起こし、病態は再発と寛解を繰り返すことが多い。
- ※4 多発性硬化症
- 免疫システムの異常によって、脳や脊髄などの中枢神経系に炎症を引き起こす自己免疫疾患。神経軸索を周囲に巻き付いている髄鞘や神経軸索自体が障害をうける。
- ※5 アストロサイト
- 中枢神経系に最も多く存在するグリア細胞の一種。神経細胞への栄養供給や脳内の恒常性の維持に働くことが知られている。
- ※6 アクアポリン4
- 水分子を通過させる膜タンパク質で、水の輸送に関わっている。血管周囲やアストロサイトに強く発現している。NMO患者では抗アクアポリン4抗体が検出される。
本件に関する問い合わせ先
研究に関すること
山下 俊英(やました としひで)
大阪大学 大学院医学系研究科 分子神経科学 教授
報道に関すること
大阪大学 大学院医学系研究科 広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構 戦略推進部 難病研究課
関連リンク