2019-11-07 分子科学研究所
概要
自然科学研究機構生命創成探究センター(ExCELLS)/分子科学研究所の村木則文助教、青野重利教授、伊藤暁助教、奥村久士准教授、石井健太郎研究員、大阪大学大学院工学研究科の内山進教授らの研究グループは、金属酵素(ヒドロゲナーゼ)が活性を発現するための構造ユニットの組み上げに必須となる一酸化炭素が、生体内でどのようにして合成されているのかを明らかにしました。
本研究成果は、Nature Researchが発行する国際学術誌Communications Biologyに、2019年10月18日付でオンライン掲載されました。
研究の背景
水素ガスの酸化反応・プロトンの還元反応を触媒する酵素であるヒドロゲナーゼは、バクテリアなどによる水素代謝において中心的な役割を果たしている他、最近では燃料電池用触媒としての利用も期待されている金属酵素 [注1] です。ヒドロゲナーゼは、酵素中に含まれる金属イオンの違いにより、 [ニッケル・鉄]型、[鉄・鉄]型、 [鉄]型の三種に分類され、それぞれ異なる構造を有する金属錯体(図1)がタンパク質中に結合し、酵素の活性中心として機能しています。これら三種の酵素活性中心の構造は異なっていますが、ヒドロゲナーゼが活性を示すためには、いずれの場合も一酸化炭素(CO)が活性中心中の鉄イオンに配位していることが必須の条件となります。ここで用いられている一酸化炭素が、生体中の酵素反応によって合成されていることは分かっていましたが、その詳細については不明な状況でした。
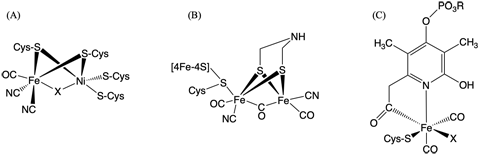
図1. (A) [ニッケル・鉄]型、(B) [鉄・鉄]型、(C) [鉄]型ヒドロゲナーゼにおける酵素活性中心の構造
研究の成果
本研究では、[ニッケル・鉄]型ヒドロゲナーゼが利用しているCOの生合成に関わる酵素(HypX)の結晶構造を決定し、HypXがこれまでに全く例の無い反応により一酸化炭素を合成していることを明らかにしました。HypXは二つのドメイン(N末ドメインとC末ドメイン)から構成されており、分子内部にはこれら二つのドメインにまたがる形で大きな空洞(キャビティー)が存在していました(図2)。また、C末ドメイン側のキャビティーには、補酵素A(coenzyme A: CoA)が結合していることも分かりました。
HypXのN末ドメインとC末ドメインでは、それぞれ異なる二つの化学反応が進行します。N末ドメインでは、反応基質としてN末ドメイン中のキャビティーに結合したホルミルテトラヒドロ葉酸からCoAへのホルミル基転移反応が進行します(図3中の反応ステップ1)。この時、キャビティー中のCoAは直鎖状に伸びたコンフォメーションを取り、CoAの末端にある-SH基はN末ドメインに結合したホルミルテトラヒドロ葉酸中のホルミル基の側に位置し、CoAへのホルミル基転移反応によりホルミル-CoAが反応中間体として生成します。生成したホルミル-CoAは、CoA分子の末端部分に存在するホルミル基が、HypXのC末ドメイン中の酵素活性サイトに位置するよう、キャビティー中で大きくそのコンフォメーションが変化します(図3中の反応ステップ2)。C末ドメインでは、ホルミル-CoAからのCO脱離反応が進行し、COとCoAが生成します(図3中の反応ステップ3)。
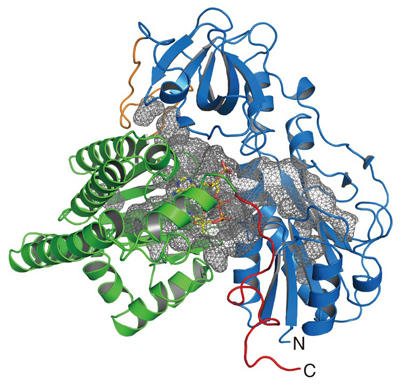
図2. HypXの結晶構造。 N末ドメインを青色、C末ドメインを緑色で示してある。HypX分子中に存在しているキャビティーを灰色の網目で示している。
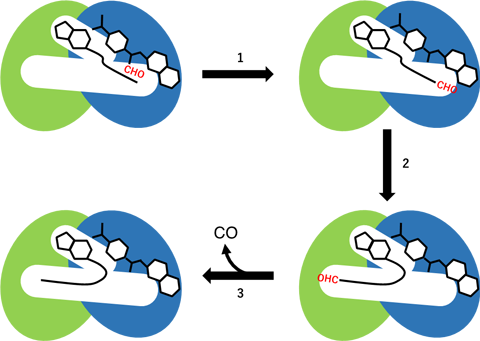
図3. HypXによるCO合成反応の反応スキーム(模式図)。 N末ドメインを青色、C末ドメインを緑色、ホルミル基を赤色で示してある。
本研究で明らかになったCO合成反応は、これまでに全く例の無い反応です。CoAは、生体中における脂肪酸代謝やクエン酸回路によるエネルギー代謝において機能する補酵素 [注2] としてよく知られていましたが、CoA(ホルミル-CoA)がCO生合成反応に関与しているということは、これまでに全く報告されていませんでした。よく知られた補酵素であるCoAの新規な生理機能として、本研究で初めて明らかにされたものです。
今後の展開・この研究の社会的意義
金属酵素の生合成反応機構、特にそれらの金属含有活性中心がどのような機構で構築されるのかについては、不明な点が多く残されています。本研究では、燃料電池用触媒としての利用も期待されている金属酵素であるヒドロゲナーゼが生合成される際、その活性中心部分を構築するために必須となるCOの生合成反応を触媒する酵素の構造を、世界で初めて明らかにしました。今後は、本研究で得られた成果を基に、ヒドロゲナーゼ生合成反応の全貌解明に向けた研究に取り組んで行きたいと考えています。
用語解説
[注1] 金属酵素:
金属イオン、あるいは金属錯体を分子中に含む酵素。
[注2] 補酵素:
タンパク質部分と可逆的に結合・解離する低分子量の有機化合物であり、酵素反応が進行するための必須因子であるもの。
論文情報
掲載誌:Communications Biology
論文タイトル: “Structural characterization of HypX responsible for CO biosynthesis in the maturation of NiFe-hydrogenase”(「NiFeヒドロゲナーゼ活性発現に必要なCO生合成を担うHypXの構造決定」)
著者: Norifumi Muraki, Kentaro Ishii, Susumu Uchiyama, Satoru G. Itoh, Hisashi Okumura, Shigetoshi Aono
掲載日:2019年10月18日(オンライン公開)
DOI:10.1038/s42003-019-0631-z
研究グループ
本研究は、自然科学研究機構生命創成探究センター(ExCELLS)/分子科学研究所および大阪大学が参加した共同研究です。
研究サポート
科学研究費補助金 基盤研究(B) (17H03093)
研究に関するお問い合わせ先
青野 重利(あおの しげとし)
自然科学研究機構 生命創成探求センター/分子科学研究所 教授
報道担当
自然科学研究機構・分子科学研究所
研究力強化戦略室 広報担当