2018-04-13 京都大学iPS細胞研究所(CiRA),国立研究開発法人 日本医療研究開発機構
ポイント
- 細胞の種類ごとに特異的に発現している遺伝子群が細胞らしさを維持している
- 細胞骨格遺伝子であるβアクチン注1)の働きを抑えると細胞らしさが失われる
- βアクチンはSrf(Serum Response Factor:血清応答因子)注2)を介して細胞らしさを調節している
要旨
池田隆研究員(京都大学CiRA未来生命科学開拓部門)、沖田圭介講師(同部門)および升井伸治講師(元CiRA同部門/現 京都府立医科大学特任准教授[産学公連携])らの研究グループは、分化した細胞がもつ細胞らしさ(細胞同一性)がどのようにして維持されているのか、そのメカニズムの一端を明らかにしました。
ヒトのからだはさまざまな種類の細胞から構成されています。一度分化した細胞はそれぞれ特徴的な遺伝子が働き、細胞同一性を維持しています。他の細胞へと変化することは通常はありません。分化した細胞に少数の遺伝子を導入すると他の細胞へ分化可能なiPS細胞ができる(初期化注3)される)ことが知られていますが、この初期化における細胞同一性を不安定化させるメカニズムは十分に分かっていませんでした。
升井講師らの研究グループは、初期化を阻害する遺伝子を網羅的に調べた結果、細胞の種類毎にその遺伝子は異なりますが、細胞骨格の遺伝子であるβアクチンはさまざまな細胞で共通して初期化を阻害する働きがあることを明らかにしました。また、βアクチンの働きを抑制すると、Srfという転写因子注4)が活性化され、細胞種に特徴的な遺伝子の働きが抑制されることがわかりました。Srfはすべての細胞種で働く転写因子であり、細胞外の環境をはじめ、さまざまな要因で活性化されます。今回の成果によって、いくつかの疾患の発症にSrfが関与している可能性が示されました。またSrfの働きを利用して、外部からの刺激によって細胞らしさ(細胞同一性)を変化させる細胞工学的な新技術の開発にも期待がもたれます。
この研究成果は2018年4月11日(英国時間)に「Nature Communications」で公開されました。
研究の背景
ヒトのからだの中には200種類以上の細胞があると言われていますが、それらの細胞内で働く遺伝子の組み合わせはそれぞれ異なります。遺伝子の調節部位に修飾が行われて、必要な遺伝子のみが働き、不必要な遺伝子は働かないようになっているため、通常は一度役割の決まった(分化した)細胞は他の種類の細胞へと変化することはありません。つまり、遺伝子の働き方のパターンが、細胞らしさを表しているともいえます。一方でiPS細胞のように、少数の遺伝子を細胞に加えるだけで、さまざまな細胞へと分化できる受精卵に近い状態の細胞(多能性幹細胞)へと初期化できることが報告されていますが、なぜそのように細胞らしさを維持する機能が抑制されて初期化が起こるのか、あるいはさまざまな種類の細胞においてどのようにして細胞らしさを維持しているのか、その詳細なメカニズムは分かっていませんでした。
研究グループは、遺伝子の働きを調節することで、初期化の効率(iPS細胞のコロニー数)に与える影響を調べました。
研究結果
1.βアクチンがさまざまな細胞で細胞らしさを維持している
研究グループはこれまでに研究が行われていた線維芽細胞(マウス胎仔由来)の他に、神経の細胞(神経前駆細胞)および肝臓の細胞(肝芽細胞)を用いて、初期化を妨げている遺伝子を網羅的に調べました。それぞれの細胞において初期化を妨げる遺伝子は異なり、ほとんど一致しませんでした。一方で、ほぼすべての細胞で働いているβアクチンに注目し、βアクチンの働きを抑制した状態で初期化を行うと、通常よりも多くのiPS細胞コロニー注5)ができることがわかりました(図1)。つまり、βアクチンが初期化を妨げ、細胞らしさの維持に働いていると考えられます。
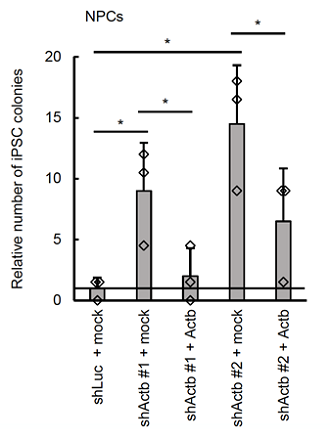
図1 βアクチンがiPS細胞化を妨げる
マウスが持っていないルシフェラーゼの働きを抑える遺伝子と遺伝子導入の担体を導入したコントロールの細胞(shLuc+mock)に比べて、βアクチンの働きを抑制したマウス神経系の細胞(shActb[βアクチンの働きを抑制する遺伝子]#1+mock、shActb#2+mock)ではiPS細胞のコロニーが増えた。この細胞にβアクチンを補充した細胞(shActb#1+ Actb、shActb#2+Actb)では補充前と比較してiPS細胞のコロニー数が減った。*:Studentのt検定により統計学的に差が認められたもの。(P<0.05)
2.βアクチンはSrfを介して細胞らしさを維持している
βアクチンがどのようにして初期化を防いでいるのかを調べるため、βアクチンの働きを抑制した細胞で、どのような遺伝子の働きが抑制されているのかを調べたところ、それらの遺伝子の多くがSrfというタンパク質により遺伝子の働きが調節されていることがわかりました。そこで神経の細胞からiPS細胞を作製する際に、Srfを過剰に働かせるとiPS細胞のコロニーが多数でき(図2左)、反対にSrfの働きを抑制するとコロニーの数が少なくなることがわかりました(図 2右)。また、Srfが神経や肝臓の細胞で細胞種特異的遺伝子の働きを抑制することも明らかにしました。
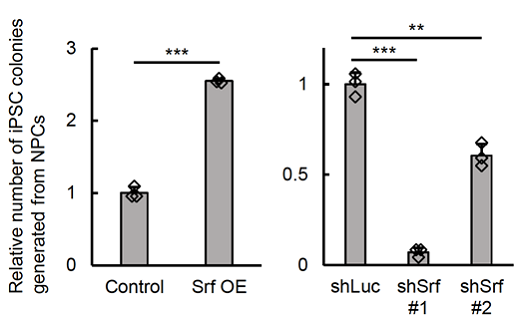
図2 SrfがiPS細胞コロニーを増加させる
左側:コントロール(Control)と比べて、Srfを過剰に働かせた神経系の細胞(Srf OE)ではiPS細胞コロニー数が多い。
右側:コントロール(shLuc)とくらべて、Srfを抑制した細胞(shSrf#1、shSrf#2)ではiPS細胞コロニー数が少ない。
Studentのt検定により統計学的な差が認められた。(**P<0.005, ***P<0.0005 )
まとめ
今回の研究から、Srfがさまざまな細胞種特異的な遺伝子を制御して、細胞らしさ(細胞同一性)の維持状態をコントロールしていることがわかりました。Srfはあらゆる種類の細胞でもともと働いていることが知られており、細胞外の環境など、さまざまな刺激によって活性化されます。こうしたSrfへの刺激により細胞らしさが失われる可能性が示されました。将来的には外部からの刺激などにより細胞らしさを変化させ、細胞の種類を変更する技術の開発や、細胞らしさの維持が関わるような疾患メカニズムの解明等につながると期待されます。
論文名と著者
論文名
“Srf destabilizes cellular identity by suppressing cell-type-specific gene expression programs”
ジャーナル名
Nature Communications
著者
Takashi Ikeda1,*, Takafusa Hikichi1, Hisashi Miura2, Hirofumi Shibata1,Kanae Mitsunaga1, Yosuke Yamada1,3, Knut Woltjen1,4, Kei Miyamoto5, Ichiro Hiratani2, Yasuhiro Yamada1,6,7, Akitsu Hotta1,7, Takuya Yamamoto1,7,8, Keisuke Okita1,* and Shinji Masui1*
- *責任著者
著者の所属機関
- 1.京都大学iPS細胞研究所(CiRA)
- 2.理化学研究所 多細胞システム形成研究センター(CDB)
- 3.京都大学医学部附属病院
- 4.京都大学白眉センター
- 5.近畿大学 生物理工学部
- 6.東京大学医科学研究所
- 7.京都大学物質—細胞統合システム拠点(iCeMS)
- 8.日本医療研究開発機構(AMED) AMED-CREST
本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 科学技術振興機構(JST)CREST
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
「再生医療用iPS細胞ストック開発拠点」 - 武田科学振興財団
- 内藤記念科学振興財団
- 世界トップレベル研究拠点プログラム(WPI)
- iPS細胞研究基金
- 日本学術振興会(JSPS)科学研究費補助金 若手研究(B)
- 日本学術振興会(JSPS)最先端研究開発支援プログラム(FIRST)
用語説明
- 注1)βアクチン
- 細胞の骨格を形成する物質の一つ。一つ一つのタンパク質は小さいが、多数が重合することで、アクチンフィラメントという線維をつくることができる。
- 注2)Srf(Serum Response Factor)
- 日本語で血清応答因子とも呼ばれる。細胞を培養する液体に含まれる血清由来の因子や硬さを始めとした細胞外からの刺激に応答して活性化する転写因子。
- 注3)初期化
- 分化した体を構成する細胞の核がリセットされ、受精卵のような発生初期の細胞核の状態に戻ること。初期化された核をもつ細胞は、無限に増殖し、かつ、さまざまな細胞へと変化する能力を持つ多能性幹細胞となる。
- 注4)転写因子
- 遺伝子に書かれた情報をmRNAへと写し取ることを「転写」といい、その転写の開始に関わる因子を転写因子という。遺伝子の働きを促進したり抑制したりする働きがある。
- 注5)コロニー
- 1つの細胞から増えた細胞集団のこと。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
国際広報室
和田濵
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課