アクチン重合制御の障害が早期発症型てんかんを引き起こす
2018-04-13 国立大学法人浜松医科大学,公立大学法人横浜市立大学,国立研究開発法人日本医療研究開発機構
概要
浜松医科大学医化学講座の中島光子准教授・才津浩智教授、横浜市立大学遺伝学講座の松本直通教授、昭和大学小児科学講座の加藤光広准教授らの共同研究グループは、アクチン動態を制御する重要な因子であるWAVE調節複合体の構成タンパクの一つであるCYFIP2の87番目のアミノ酸変異が、早期発症型のてんかん性脳症を引き起こす原因となることを発見しました。このアミノ酸変異によって、WAVE調節複合体の活性制御が障害されることが強く示唆され、てんかん性脳症の病態解明に寄与することが期待されます。
これらの成果は、米国の科学雑誌「Annals of Neurology」に3月13日に公表されました。
研究の背景
てんかんは最も頻度が高い神経疾患の一つであり、およそ1000人に6~8人がてんかんに罹患しているといわれています。日本国内においても約100万人のてんかん患者数が存在すると予想されています。特に乳幼児期に発症する早期発症型てんかんは脳神経系の発達に重大な影響を及ぼし、重度の精神運動障害や知的障害を併発する可能性があることから、患者およびその家族の生活に大きな影響を与えます。てんかんは外傷、感染症、脳出血、脳腫瘍など様々な原因が知られていますが、最も頻度の高い原因は遺伝子の異常によるものであるといわれています。特に早期発症型てんかんにおいては遺伝的要因の関与が強く示唆されていますが、その遺伝的背景は非常に多彩であり、近年の次世代シークエンス技術の発展によってその責任遺伝子が次第に明らかになりつつあります。
研究の成果
今回、研究グループは、早期発症型てんかんの原因遺伝子を探るため、699例の小児てんかん患者から採取した血液白血球からDNAを採取し、次世代シークエンサーを用いた全エクソーム解析*1を用いて疾患原因遺伝子の検索を行いました。その結果、4例でCYFIP2遺伝子のde novo変異*2を同定しました。4例で見つかった変異は、いずれもCYFIP2タンパクの87番目のアミノ酸が別のアミノ酸に置換される変異でした(参考図A)。4名の患者はいずれも6ヵ月以内に発症するてんかんとその後の重篤な精神運動発達遅滞を認めています。
CYFIP2遺伝子はCYFIP2タンパクをコードする遺伝子であり、CYFIP2タンパクはWAVEタンパクを含む4つのタンパク質と複合体(WAVE調節複合体)を形成することが知られています。WAVE調節複合体は、細胞運動の際に重要なアクチン動態を制御する中心的な因子であり、アクチン動態制御の異常によって脳神経系の異常をきたすことが知られています。通常の細胞内において、WAVE調節複合体は不活性化の状態で存在しています。この時、WAVEタンパク質のVCAと呼ばれる領域がCYFIP2タンパクに結合することによって、WAVE調節複合体の活性化が抑制されると考えられています(参考図B、左)。CYFIP2の87番目のアルギニンというアミノ酸は、WAVEタンパクのVCA領域との結合に非常に重要な役割を果たす部位に存在しており、我々の実験によってこのアミノ酸の変化によってVCA領域との結合が弱まってしまうことが示されました(参考図C)。その結果、CYFIP2変異体を有する患者においては、WAVE調節複合体の異常な活性化が引き起こされているのではないかと予想されました(参考図B、右)。そこで、野生型と変異型のCYFIP2タンパクを細胞に発現させて免疫染色を行ったところ、野生型に比べて変異型を発現させた細胞においては、アクチンの過剰な集積が確認されました(参考図D)。これらの結果から、CYFIP2変異体をもつ患者においてはWAVE調節複合体の過剰な活性化が引き起こされており、アクチン動態の制御に異常をきたしている可能性が考えられました。
注釈
- *1 全エクソーム解析:
- ゲノム上の全エクソン領域(タンパク質の配列を決定する遺伝子領域の全て)を分離した後、その塩基配列を次世代シークエンサーで決定する方法。
- *2 de novo変異:
- 両親兄弟には認められず、患者のみに認められる遺伝子変異。
今後の展開
本研究は、WAVE調節複合体の構成タンパクの変異がてんかんと関与していることを世界で初めて明らかにしました。本研究成果は、小児難治性てんかんの病態解明に貢献し、効果的な治療法の開発に寄与することが期待されます。
発表雑誌
Annals of Neurology
論文タイトル
De Novo Hotspot Variants in CYFIP2 Cause Early-Onset Epileptic Encephalopathy.
著者
Mitsuko Nakashima, MD, Mitsuhiro Kato, Kazushi Aoto, Masaaki Shiina, Hazrat Belal, Souichi Mukaida, Satoko Kumada, Atsushi Sato, Ayelet Zerem, Tally Lerman-Sagie, Dorit Lev, Huey Yin Leong, Yoshinori Tsurusaki, Takeshi Mizuguchi, Satoko Miyatake, Noriko Miyake, Kazuhiro Ogata, Hirotomo Saitsu and Naomichi Matsumoto
研究グループ
本研究は、浜松医科大学医化学講座、横浜市立大学遺伝学講座、昭和大学小児科学講座 との共同研究で、下記の助成により実施した成果です。
日本医療研究開発機構 難治性疾患実用化研究事業「希少難病の高精度診断と病態解明のためのオミックス拠点の構築」:研究代表者 松本直通
日本学術振興会科学研究費補助金 基盤研究(B)「乳幼児てんかん性脳症の遺伝要因と分子病態の解明」:研究代表者 才津浩智
日本学術振興会科学研究費補助金 基盤研究(C)「全エクソーム解析を用いた脳奇形疾患における体細胞変異の同定」:研究代表 中島光子
参考図
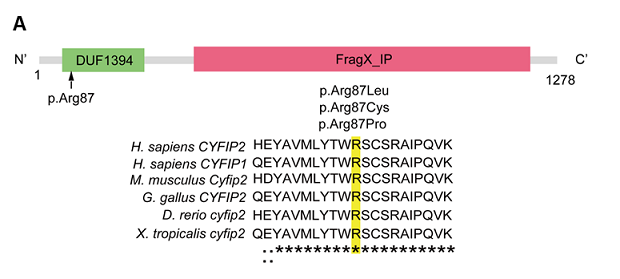
図A:患者で認められたCYFIP2遺伝子変異。3つの変異は同じアミノ酸(84番目のアルギニン)上で起こっており、このアミノ酸は哺乳類からゼブラフィッシュまで高度に保存されている。
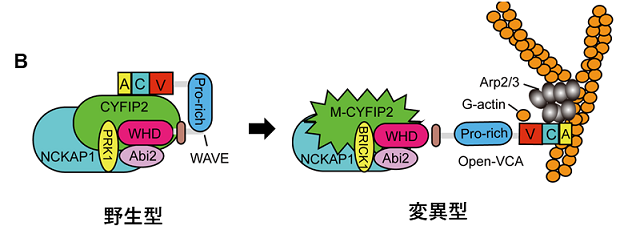
図B:WAVE複合体の模式図。正常な野生型ではWAVEタンパクのVCA領域が折りたたまれた状態で不活性化されているが、変異型ではVCA領域がCYFIP2タンパクから離れて活性化し、アクチン重合が促進されていると予想される。
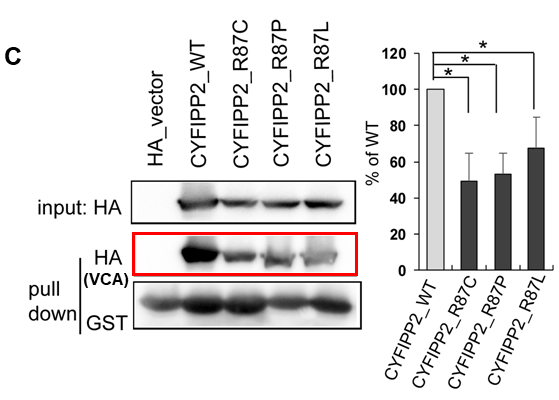
図C:正常CYFIP2に比べて(CYFIP2_WT)に比べて、変異体CYFIP2 (CYFIP2_R87C/R87P/R87L)はVCAタンパク質との結合が有意に弱くなっている(赤枠および右グラフ)。
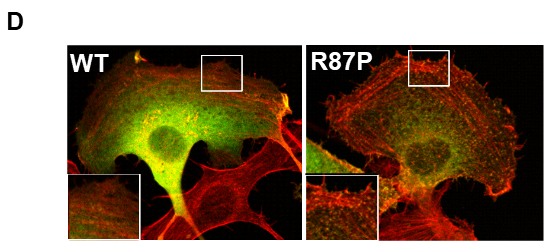
図D:正常(WT)およびCYFIP2変異体(R87P)を一過性発現させた細胞の免役染色像。変異体を発現させた細胞では、アクチン線維の過剰な集積を認めた。
本件に関するお問い合わせ先
国立大学法人浜松医科大学 医化学講座
准教授 中島 光子
公立大学法人横浜市立大学 学術院医学群 遺伝学
教授 松本 直通
国立研究開発法人日本医療研究開発機構 戦略推進部 難病研究課