2024-05-07 京都大学iPS細胞研究所
ポイント
- 卵母細胞注1)に発現しているリンカーヒストン注2)H1FOOを、初期化因子の導入と同時に、一過性に発現させる新たなiPS細胞の樹立方法を開発した。
- 本研究で開発した方法により、ヒトiPS細胞の樹立の効率が向上し、さらに、樹立したクローンの多分化能が向上するとともに、クローン間のトランスクリプトーム注3)やDNAメチル化注4)の不均一性が抑制されることを示した。
- 本研究で開発した方法により、着床前のエピブラスト注5)の状態により近い、高品質なナイーブ型注6)iPS細胞が樹立できることを示した。
1. 要旨
國富晃 研究員(当時:CiRA基盤技術研究部門、現在:米国グラッドストーン研究所 循環器疾患部門)と株式会社IDファーマらの共同研究グループは、初期化の過程にリンカーヒストンH1FOOを一時的に発現させることで、高品質なナイーブ型iPS細胞を樹立する方法を新たに開発しました。
研究グループは、卵母細胞に特異的に発現するリンカーヒストンH1FOOに、不安定化ドメイン(Destabilizing Domain: DD)注7)を融合したタンパク質H1FOO-DDを発現するセンダイウイルスベクター注8)を構築しました。H1FOO-DDを細胞に導入したところ、一過性の発現が認められました。
次に、4つの初期化因子(OCT4, SOX2, KLF4, LMYC: OSKL)とH1FOO-DDを細胞に導入したところ、初期化因子のみを導入した場合よりもiPS細胞の樹立効率が改善されました。H1FOOの一時的な発現は、初期化に関わる遺伝子群の転写を活性化するようにクロマチン構造を変化させることが確認されました。さらに、H1FOOの一時的な発現は、センダイウイルスベクターによる遺伝子導入による自然免疫応答注9)を抑えるFKBP1A遺伝子の発現を促進することで初期化効率を向上させることが判明しました。
本法により作製されたプライム型注10)およびナイーブ型のヒトiPS細胞をより詳細に解析した結果、4つの初期化因子のみを用いて樹立する従来のiPS細胞株で課題となっていた、トランスクリプトームやDNAメチル化の不均一性が改善され、より均質な細胞集団を樹立できていることがわかりました。また、本法により樹立したヒトiPS細胞は、プライム型では心筋細胞への分化能が高く、ナイーブ型では栄養外胚葉注11)への分化能が高いことがわかりました。さらに、H1FOOナイーブ型iPS細胞は、着床前エピブラストにみられるナイーブ型の細胞の特徴をよく反映していることが確認されました。
本研究成果は、2024年5月2日(アメリカ東部時間)にStem Cell Reports誌でオンライン公開されました。
2. 研究の背景
ナイーブ型ヒトiPS細胞はヒト初期胚における着床前エピブラストに非常に類似した特徴を持ち、現在広く用いられているプライム型よりも多くの種類の細胞に分化できることが知られています。また最近では、センダイウイルスベクターを用いて、プライム型の作製と同様の初期化因子OCT4、SOX2、KLF4、CMYCもしくはLMYCをヒトの皮膚線維芽細胞注12)や末梢血単核球注13)に導入することにより、ナイーブ型iPS細胞を体細胞から直接樹立する方法が報告されています。しかし、ヒトiPS細胞はプライム型およびナイーブ型のいずれも依然として作製効率が低く、樹立したiPS細胞ごとの遺伝子発現、DNAメチル化、分化能が均一ではないという問題があり、特にナイーブ型に関してはこれらの問題を改善する方法はほとんど報告されていません。
3. 研究結果
1)リンカーヒストンH1FOOの一過性の発現を誘導するH1FOO-DDの構築
ヒトiPS細胞の樹立に用いられる初期化因子として、4つの転写因子OCT4, SOX2, KLF4, CMYCが最もよく知られています。この初期化因子のうち、CMYCをLMYCに変更することで、より質の高いiPS細胞が作製できることが報告されています。また、マウスでは、卵母細胞にのみ特異的に発現するリンカーヒストンh1fooが、iPS細胞の樹立効率を高めることが報告されています。
本研究では、これらの知見をもとに、ヒトの卵母細胞で特異的かつ多く発現しているH1FOOを、4つの転写因子OCT4, SOX2, KLF4, LMYC(OSKL)と同時に体細胞に導入することで、より質の高いヒトiPS細胞を作製することを試みました。
ヒト卵母細胞内に存在するH1FOOは、受精後、急速に消失することが知られています。この現象を再現するため、本研究では、H1FOO遺伝子に不安定化ドメイン(Destabilized Domain: DD)を融合したH1FOO-DDをセンダイウイルスベクターを用いてヒトの皮膚線維芽細胞に導入し、H1FOOが発現した後、迅速に分解消失するようにしました(図1)。
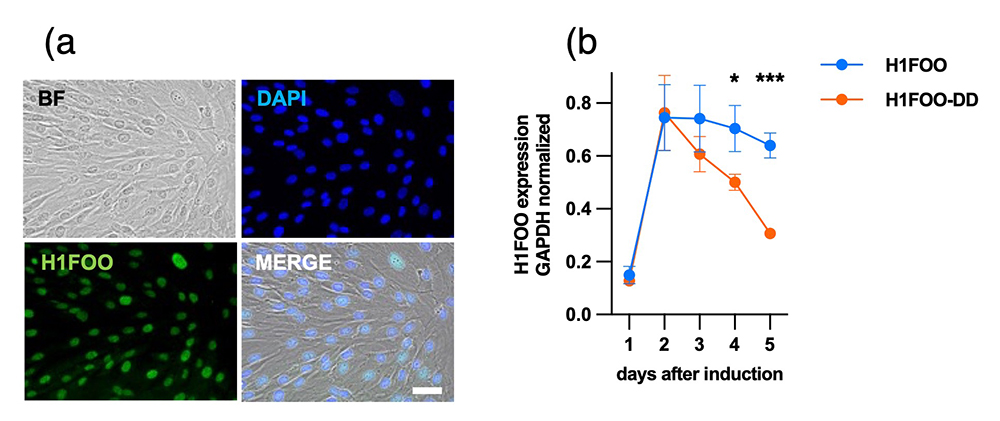
図1 H1FOO-DDは細胞内でより早期に分解除去される
(a) ヒト皮膚線維芽細胞(HDF)に強制発現させたH1FOO (スケールバーは50μm)。
(b) H1FOO-DDはH1FOOと比べてより早く発現量が低下する。
2)H1FOO-DDはプライム型およびナイーブ型のiPS細胞の樹立効率を高める
センダイウイルスベクターを用いて、ヒト皮膚線維芽細胞(HDF)もしくはヒト末梢血単核球(PBMC)にH1FOO-DDと初期化因子OSKLを同時に発現させた(OSKLH)ところ、OSKLのみを発現させた場合と比較して、iPS細胞の樹立効率がプライム型とナイーブ型いずれにおいても有意に改善しました(図2)。

図2 OSKLHはOSKLよりも高いiPS細胞樹立効率を示す
(a) プライム型iPS細胞の樹立効率。
(b) ナイーブ型iPS細胞の樹立効率。
3)H1FOO-DDは初期化の早期にクロマチン構造を変化させ、初期化関連遺伝子の転写を促進する
初期化過程において、H1FOO-DDがどのような働きをしているかを解明するため、シングルセルRNA-seq注14)およびシングルセルATAC-seq注15)による解析を行いました。その結果、OSKLHを導入した細胞では、OSKLを導入した細胞と比べて、遺伝子導入後の早期から初期化の完了している細胞の割合が多いことが判明しました。
また、OSKLHを導入した細胞群のシングルセルATAC-seq解析では、KLF/SP転写因子群、POU転写因子群など、初期化に関わる転写因子と結合するDNA配列が多く検出され、これらの転写因子が作用しやすいようにクロマチン構造が変化していることが示唆されました(図3)。
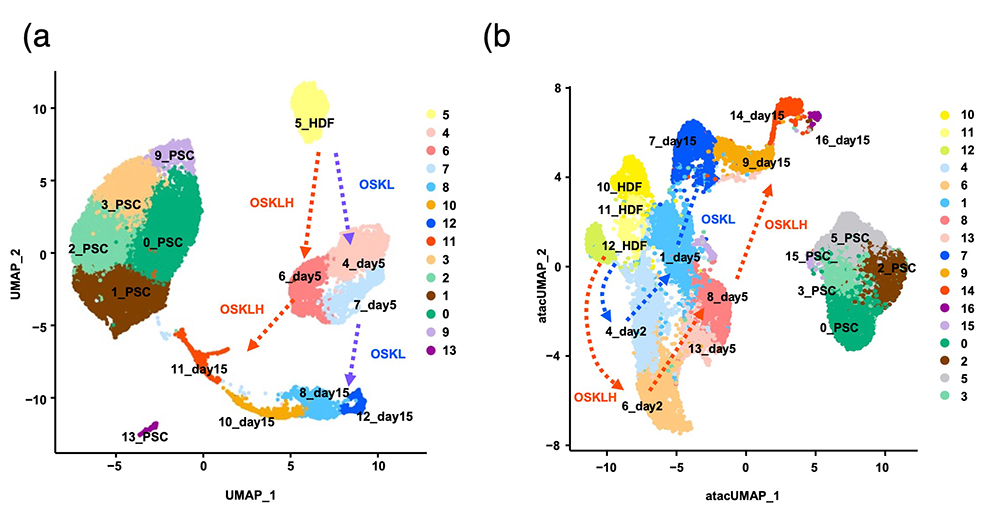
図3 OSKLHは初期化効率を向上させる
(a) シングルセルRNA-seqの解析結果。各細胞の遺伝子発現パターンによるクラスタリング。
(b) シングルセルATAC-seqの解析結果。各細胞のクロマチン状態によるクラスタリング。
4)H1FOO-DDはFKBP1Aの発現を介して自然免疫応答を抑制し、初期化効率を向上させる
OSKLHを発現させた細胞とOSKLのみを発現させた細胞の遺伝子発現を比較したところ、OSKLHではFKBP1Aという転写因子の発現が有意に上昇していました。検証の結果、FKBP1Aは、遺伝子導入時に用いるセンダイウイルスベクターの細胞内への取り込みに伴い引き起こされる自然免疫応答を抑制し、細胞の炎症反応やアポトーシス注16)を抑制することで、iPS細胞の樹立効率や多分化能を高める作用があることが明らかになりました(図4)。
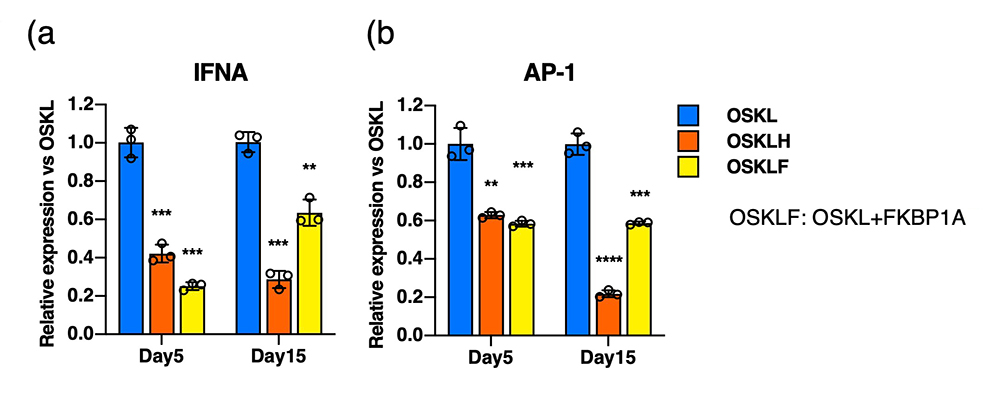
図4 FKBP1Aは自然免疫応答およびアポトーシス関連遺伝子の発現を抑制する
(a) 代表的な自然免疫応答因子の一つであるIFNαの発現量。
(b) 代表的なアポトーシス関連遺伝子の一つであるAP-1の発現量。
5)H1FOO-DDは樹立したiPS細胞のクローン間の遺伝子発現とDNAメチル化の不均一性を改善する
OSKLHを導入して樹立したiPS細胞(OSKLH-iPS細胞)と、OSKLのみを導入して樹立したiPS細胞(OSKL-iPS細胞)のクローン(細胞株)をプライム型とナイーブ型で複数作製し、それらのトランスクリプトームとゲノム上のDNAメチル化部位を調べたところ、どちらの場合もOSKL-iPS細胞と比較してOSKLH-iPS細胞のほうがクローン間のトランスクリプトームおよびDNAメチル化の不均一性が顕著に低いことが判明しました(図5)。
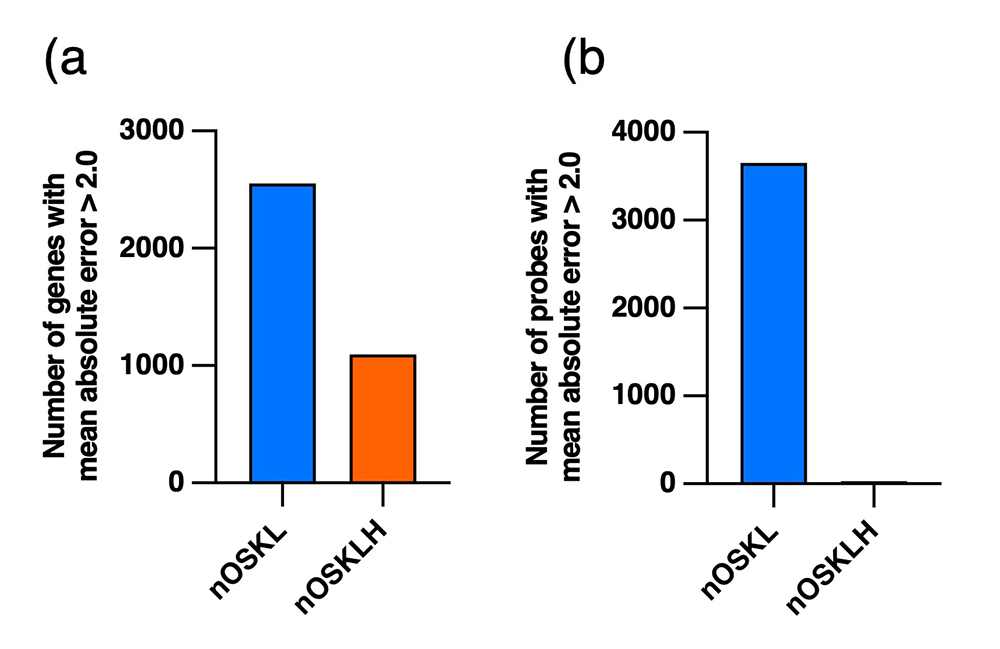
図5 OSKLHはiPS細胞クローン間のトランスクリプトームおよび
DNAメチル化の不均一性を改善する
(a) ナイーブ型OSKLH-iPS細胞とOSKL-iPS細胞において、クローン間で発現量に一定以上の
ばらつきがあった遺伝子の数。
(b) ナイーブ型OSKLH-iPS細胞とOSKL-iPS細胞において、クローン間でメチル化に一定以上の
ばらつきがあったDNAメチル化部位の数。
6)H1FOO-DDはプライム型およびナイーブ型のヒトiPS細胞の多分化能を改善する
プライム型のOSKLH-iPS細胞とOSKL-iPS細胞をさまざまな分化細胞に分化させて多分化能を比較したところ、OSKLH-iPS細胞はOSKL-iPS細胞と比較して心筋細胞に分化しやすいことが判明しました。またナイーブ型でも同様に比較したところ、OSKLH-iPS細胞は栄養外胚葉に分化しやすいことが判明しました(図6)。
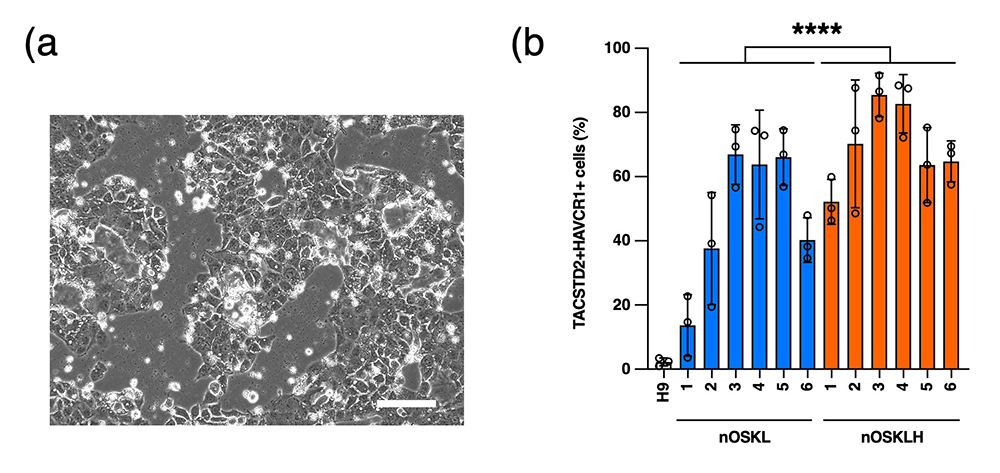
図6 ナイーブ型OSKLH-iPS細胞の栄養外胚葉への分化能
(a) 栄養外胚葉に分化したナイーブ型OSKLH-iPS細胞(スケールバーは200μm)
(b) ナイーブ型OSKL-iPS細胞とOSKLH-iPS細胞の全分化誘導後細胞における栄養外胚葉細胞の割合の比較
7)ナイーブ型OSKLH-iPS細胞は、着床前エピブラストにより近い性質を持つ
ナイーブ型多能性幹細胞はプライム型よりもエネルギー代謝が活発であることが知られています。ナイーブ型のOSKLH-iPS細胞とOSKL-iPS細胞の代謝機能を比較したところ、OSKLH-iPS細胞のほうがより代謝が活発でした。
女性由来の体細胞では、2本のX染色体注17)のうち片方からの遺伝子の転写が不活化されていますが、初期化によりナイーブ型多能性幹細胞を樹立すると、体細胞で不活性化されていたX染色体が着床前エピブラストに非常に類似した形に再活性化されます。そこで、ナイーブ型のOSKLH-iPS細胞とOSKL-iPS細胞のX染色体の活性度を調べたところ、OSKLH-iPS細胞では2本のX染色体が両方とも着床前エピブラストに非常に類似した状態に活性化している細胞の割合が多いことが判明しました(図7)。
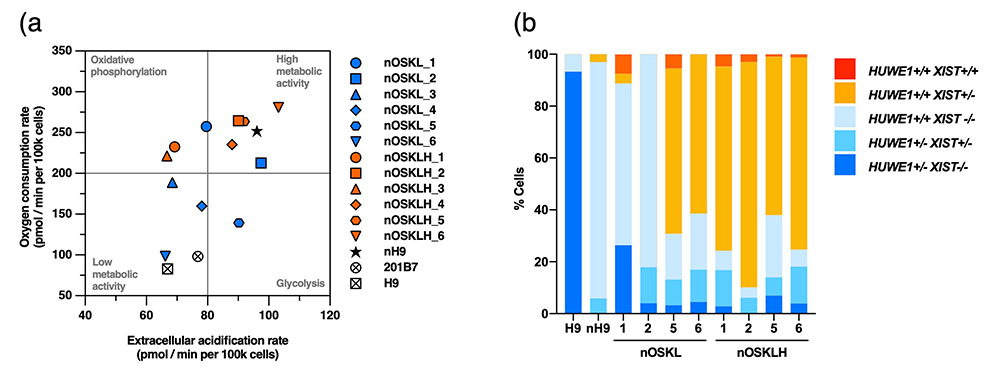
図7 ナイーブ型OSKLH-iPS細胞におけるナイーブ型多能性幹細胞の特徴
(a) 代謝活性の指標であるミトコンドリア活性と解糖活性の測定結果。右上に位置するほど双方の活性が高いことを示す。
(b) X染色体活性の比較。赤色とオレンジ色が、両方のX染色体が着床前エピブラストに近い状態へと活性化している細胞の割合。
4. まとめ
本研究では、初期化因子としてH1FOOを発現させる新たな手法を確立し、より均一かつ質の高いナイーブ型ヒトiPS細胞を体細胞から効率よく樹立できることを示しました。ナイーブ型ヒト多能性幹細胞はプライム型では分化できない細胞種にも分化できることから、近年、ヒト初期胚の研究に多く用いられており、本法はこれらの研究の発展に貢献することが期待されます。また、この技術はプライム型ヒトiPS細胞の樹立においても、従来では解決が困難であった細胞株間の不均一性を改善する可能性が示されました。今後、自家iPS細胞作製や、それを用いたさまざまな疾患モデリング、創薬、細胞治療の取り組みを一層進展させることが期待されます。
5. 論文名と著者
- 論文名
H1FOO-DD promotes efficiency and uniformity in reprogramming to naive pluripotency - ジャーナル名
Stem Cell Reports - 著者
Akira Kunitomi1,2*, Ryoko Hirohata1,3, Mitsujiro Osawa1,8, Kaho Washizu2, Vanessa Arreola2,9, Norikazu Saiki1,10, Tomoaki M Kato1,3, Masaki Nomura1,3, Haruko Kunitomi2, Tokiko Ohkame1,11, Yusuke Ohkame1,12, Jitsutaro Kawaguchi4, Hiroto Hara4, Kohji Kusano4, Takuya Yamamoto1,5,6, Yasuhiro Takashima1, Shugo Tohyama7, Shinsuke Yuasa7, Keiichi Fukuda7, Naoko Takasu1,3, Shinya Yamanaka1,2,3
*:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- グラッドストーン研究所 循環器疾患部門
- 京都大学iPS細胞研究財団
- 株式会社IDファーマ
- 京都大学ヒト生物学高等研究拠点
- 理化学研究所革新知能統合研究センター iPS細胞連携医学的リスク回避チーム
- 慶應義塾大学医学部 循環器内科
- サイアス株式会社
- スタンフォード大学
- 東京医科歯科大学
- 大阪行岡医療専門学校長柄校
- 鳥取大学
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」
- iPS細胞研究基金
- 日本学術振興会 科研費
7. 用語説明
注1)卵母細胞
卵子の元となる細胞
注2)リンカーヒストン
DNAはコアヒストンタンパク質の複合体に巻き付いてヌクレオソームと呼ばれる構造を形成する。ヌクレオソームが数珠状に連なった構造をクロマチンと呼ぶ。リンカーヒストンはヌクレオソームの間の領域のDNA(リンカーDNA)に結合し、クロマチンの構造を変化させる。
注3)トランスクリプトーム
ゲノムDNAを鋳型にして合成された細胞内の全ての転写産物(全RNA)。
注4)DNAメチル化
ゲノム上のシトシン(C)とグアニン(G)が連続するCG配列などで、主にシトシン塩基にメチル基が付加される化学反応。メチル基が付加されるCG配列の領域は細胞の種類によって異なり、ゲノム上のDNAメチル化のパターンと遺伝子の発現パターンは相関がある。哺乳類の個体発生に必須で、その異常は白血病などのがん発生の原因となることが知られている。
注5)エピブラスト
着床前後の胚に存在する細胞のうち、将来、胎児となり、体を構成する細胞。
注6)ナイーブ型
着床前のエピブラストに類似した性質をもつ多能性幹細胞の状態。2014年に初めてナイーブ型ヒトiPS細胞の樹立が報告された。
注7)不安定化ドメイン(Destabilizing Domain: DD)
この配列が融合した遺伝子から合成されたタンパク質は、細胞内でプロテアソーム(タンパク質分解酵素複合体)により速やかに分解される。細胞内のタンパク発現を調整する手法として2006年に報告された。
注8)センダイウイルスベクター ベクターとは遺伝子の運び屋であり、研究者が設計した配列の遺伝子を細胞内へ導入し、細胞の機能を改変することができる。ウイルスを利用したベクターの多くは、遺伝子導入効率は高い一方で、細胞毒性やゲノム障害性をもつという問題がある。しかし、センダイウイルスベクターは遺伝子が標的細胞の核内に侵入せず染色体に組み込まれないという特長をもち、iPS細胞樹立の安全性や導入効率に優れている。なお、本研究で用いたセンダイウイルスベクターは、ウイルスゲノム配列に改変を加えており、高温培養を行うことで細胞内から迅速に除去される性質を獲得している。
注9)自然免疫応答
特定の病原体に対する特異的な反応(獲得免疫応答)ではなく、異物や非自己分子全般を標的とする免疫応答。これにより細胞の初期化を阻害する炎症反応やアポトーシスなどが引き起こされる。
注10)プライム型
着床後の胚に類似した性質をもつ多能性幹細胞の状態。2007年に山中教授らの研究グループにより世界で初めて公表されたヒトiPS細胞はプライム型に分類される。
注11)栄養外胚葉
胚盤胞の外側に位置する細胞。胎盤細胞の発生の出発点となり、将来胎盤を作る細胞。
注12)皮膚線維芽細胞
皮膚の真皮層に存在し、皮膚の保湿、弾性力維持、細胞外基質の産生などを担う細胞。iPS細胞作製に最もよく用いられる細胞のひとつ。
注13)末梢血単核球
単球やリンパ球など球状の核をもち、免疫に関係する細胞のこと。
注14)RNA-seq(RNAシーケンス)
詳細なトランスクリプトーム解析により網羅的に細胞の遺伝子発現レベルを調べる手法。
注15)ATAC-seq(ATACシーケンス)
改変された酵素を用いてDNAを切断し、クロマチンが緩んでいる(オープンクロマチン)領域を網羅的に検出する方法。転写因子が結合する部位の予測など、遺伝子発現調節のメカニズムを調べるために有用な手法。
注16)アポトーシス
個体をより良い状態に保つために引き起こされるプログラムされた細胞死。生物の発生過程で不要となった細胞や、内部に異常を起こした細胞で起こりやすい。
注17)X染色体
ヒトにおいて生まれてくる子供の性を決定する2つの性染色体(XとY)のうちの1つ。女性の細胞にはX染色体が2本あり、ほとんどの体細胞で片方のX染色体から遺伝子が転写されないように、発生過程において2本のうち1本が細胞ごとにランダムに不活化される。