2021-04-19 京都大学iPS細胞研究所
ポイント
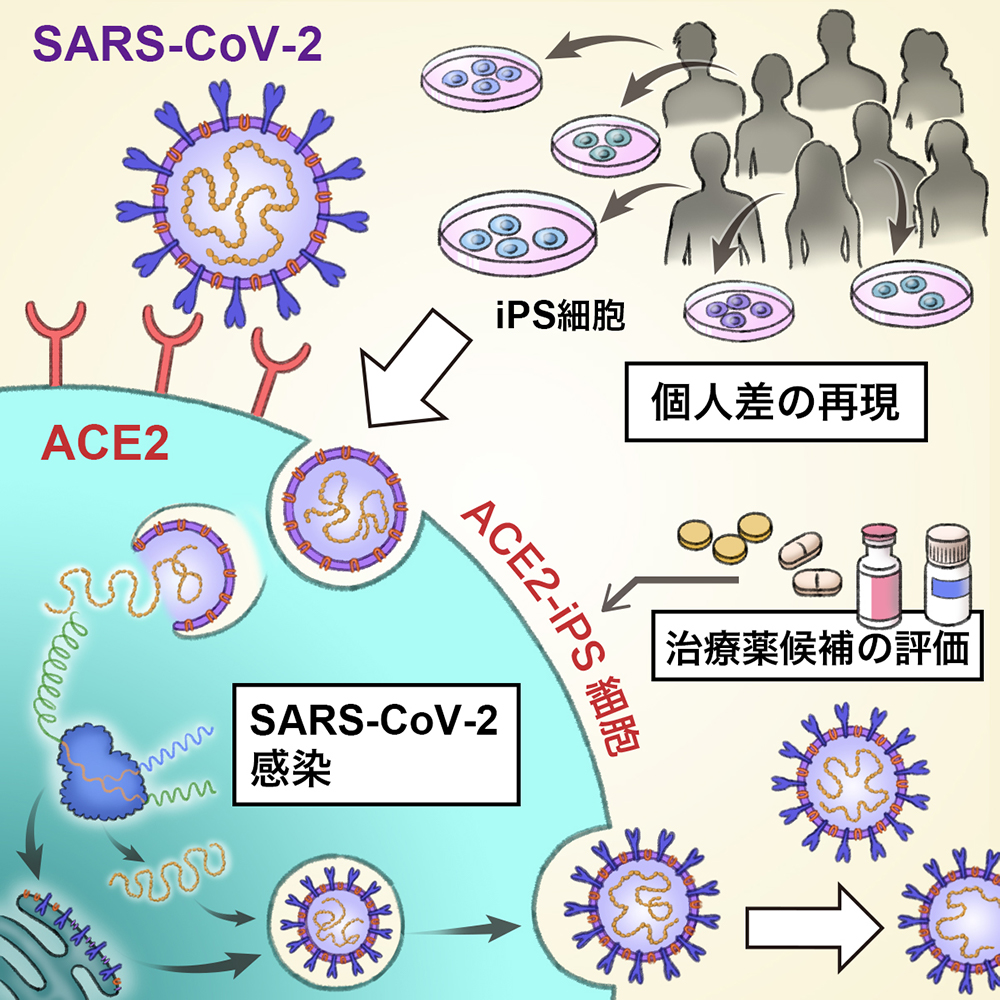
- SARS-CoV-2注1)がヒトiPS細胞に感染するにはACE2注2)の発現が必要であることを明らかにした。
- ACE2-iPS細胞を用いてSARS-CoV-2の生活環注3)の再現に成功した。
- ACE2-iPS細胞を用いてCOVID-19注4)治療薬候補を評価可能であった。
- ACE2-iPS細胞はSARS-CoV-2感染の個人差を再現可能であった。
1. 要旨
個々人の遺伝的背景の相違は、新型コロナウイルス感染症(COVID-19)の重症度の違いを生む主要な原因の一つです。ヒトiPS細胞はあらゆる個人から樹立可能であり、元のドナーの遺伝情報を引き継ぎます。したがって、ヒトiPS細胞がSARS-CoV-2感染モデルとして使用できれば、SARS-CoV-2感染の個人差を体外で再現できるようになると期待されています。しかし、新型コロナウイルス(SARS-CoV-2)は未分化ヒトiPS細胞には感染しません。 そこで、そこで、佐野 絵美 教務補佐員(CiRA増殖分化機構研究部門)、高山 和雄 講師(CiRA同部門)らの研究グループは、アデノウイルスベクター(Adベクター)を用いてSARS-CoV-2受容体アンギオテンシン変換酵素2(ACE2)を発現したヒトiPS細胞(ACE2-iPS細胞)を作製することによって、未分化ヒトiPS細胞においてもSARS-CoV-2が高効率に感染・複製できるようにしました。感染したACE2-iPS細胞において、SARS-CoV-2 ヌクレオカプシド(N)タンパクの発現、ERGIC注5)内でのウイルス粒子の出芽・子孫ウイルスの産生、細胞融合、二重膜小胞 (DMV)注6)の存在を確認しました。また、ACE2-iPS細胞においてCOVID-19治療薬候補の評価を行ったところ、レムデシビルやEIDD-2801、インターフェロンβの強い抗ウイルス効果を確認しました。さらに、8名(うち男性4名、女性4名)のドナーより樹立したACE2-iPS/ES細胞においてSARS-CoV-2感染実験を行ったところ、男性から樹立したiPS/ES細胞の方がウイルス産生能が高いことを明らかにしました。ACE2-iPS細胞はSARS-CoV-2感染の個人差を再現できるだけでなく、遺伝的背景の相違によるCOVID-19の個人差の原因を明らかにするツールとして有用だと考えます。
この研究成果は2021年4月16日(米国時間)に「iScience」でオンライン公開されました。
2. 研究の背景
COVID-19の感染者と死者は現在も増え続けています。COVID-19の症状は個人差が大きいことが知られています。近年、遺伝的背景の相違はSARS-CoV-2感染とCOVID-19重症度の個人差を生む主要な原因の一つであると報告されています。SARS-CoV-2に感染した20-30%の患者は、重篤な症状を呈しますが、COVID-19重症患者に対する治療法を開発するためには、重症化の原因を明らかにする必要があります。しかし、SARS-CoV-2感染の個人差を再現可能なモデルはほとんど開発されていません。これまでにVero細胞注7)やオルガノイドを含む培養細胞やハムスター等の実験動物がSARS-CoV-2感染モデルとして用いられておりますが、個人差の再現は容易ではありません。
ヒトiPS細胞は自己複製能と多能性を有する細胞であるだけでなく、あらゆる個人から樹立可能です。また、ヒトiPS細胞はドナーの遺伝情報を引き継ぐため、遺伝子疾患モデルとして広く使用されています。多くの個人から樹立されたヒトiPS細胞パネルは、多様な遺伝的背景をもつヒトの集団を反映しているため、SARS-CoV-2感染の個人差を再現できるリソースになります。そこで、本研究では、ヒトiPS細胞を用いてSARS-CoV-2感染とその個人差を再現できるか試みました。
SARS-CoV-2感染は細胞のACE2やTransmembrane protease, serine 2(TMPRSS2)注8)発現に依存していることが報告されています。II型肺胞上皮細胞や線毛細胞、咽頭上皮細胞、腸管上皮細胞はACE2やTMPRSS2を高発現しているため、これらの細胞に対してSARS-CoV-2が高効率に感染します。これまでにヒトiPS細胞から分化したII型肺胞上皮細胞や腸管上皮細胞においてSARS-CoV-2が感染可能であることが報告されています。しかし、ヒトiPS細胞からの分化誘導には長期間(3週間以上)要し、ヒトiPS細胞株間で分化誘導効率が異なることが多いため、ヒトiPS細胞分化細胞を用いてドナー間の違いを大規模に調査することは困難です。そこで、未分化ヒトiPS細胞においてSARS-CoV-2感染実験が可能になれば、多くのヒトiPS細胞を用いた感染実験を容易に実施できます。しかし、未分化ヒトiPS細胞はACE2の発現量が低く、SARS-CoV-2は全く感染しません。そこで、未分化ヒトiPS細胞にACE2を過剰発現させることによって、SARS-CoV-2の高効率な感染・複製が観察できるようにしました。本研究では、ACE2を発現したヒトiPS細胞が、SARS-CoV-2感染における個人差を研究するためのモデルとして使用できることを示しました。
3. 研究結果
1) SARS-CoV-2は未分化ヒトiPS細胞には感染しない
まず、SARS-CoV-2が未分化ヒトiPS細胞に感染するか調べました。未分化ヒトiPS細胞にSARS-CoV-2を感染させたところ、ヒトiPS細胞のコロニーの形態変化は見られず、細胞培養上清中のウイルスゲノムおよび感染性ウイルスの産生も検出されませんでした。また、未分化マーカーおよび自然免疫応答関連マーカーの遺伝子発現レベルも変化しませんでした。さらに、SARS-CoV-2Nタンパク質の発現は検出されませんでした。以上の結果から、SARS-CoV-2が未分化ヒトiPS細胞に感染しないことが示されました。
2) SARS-CoV-2がヒトiPS細胞に感染するにはACE2の発現が必要である
ACE2およびTMPRSS2はSARS-CoV-2感染に重要な因子であることが知られているため、Adベクターを用いて未分化ヒトiPS細胞でACE2およびTMPRSS2を過剰発現させました。ACE2の過剰発現したiPS細胞(ACE2-iPS細胞)において、高効率なSARS-CoV-2粒子の放出が確認できました(図1)。一方で、TMPRSS2を過剰発現させてもSARS-CoV-2粒子の放出は観察されませんでした。また、ACE2-iPS細胞がSARS-CoV-2に感染してから2日後に細胞融合が観察され、4日後には多くの細胞が死んでいました。以上の結果から、SARS-CoV-2が未分化ヒトiPS細胞に感染するためにはACE2発現が必要であることが示されました。
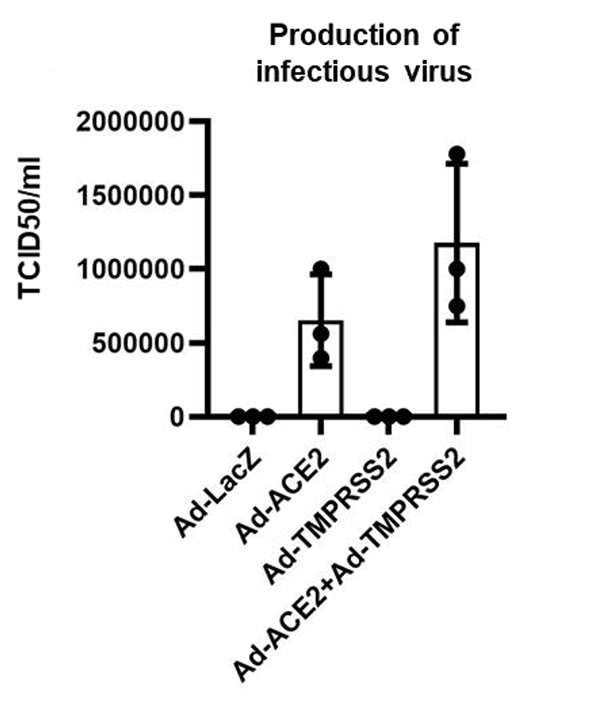
(図1) Adベクターを用いてLacZ、ACE2およびTMPRSS2を未分化iPS細胞に過剰発現させ、上清中の感染性ウイルス量を、TCID50アッセイによって測定。ACE2を過剰発現したiPS細胞(ACE2-iPS細胞)において、高い感染性ウイルス量が測定された。
3) SARS-CoV-2に感染したACE2-iPS細胞における解析
SARS-CoV-2に感染したACE2-iPS細胞を透過型電子顕微鏡(TEM)により確認すると、細胞膜近くのウイルス粒子(図2)や、ERGICにおけるSARS-CoV-2粒子も観察されました。また、感染したACE2-iPS細胞においてDMVも観察されました。 DMVは、ウイルスRNA合成の場と言われています。これらの構造は、感染していないACE2-iPS細胞では観察されませんでした。以上の結果から、SARS-CoV-2の生活環がACE2-iPS細胞で観察できることが示唆されました。
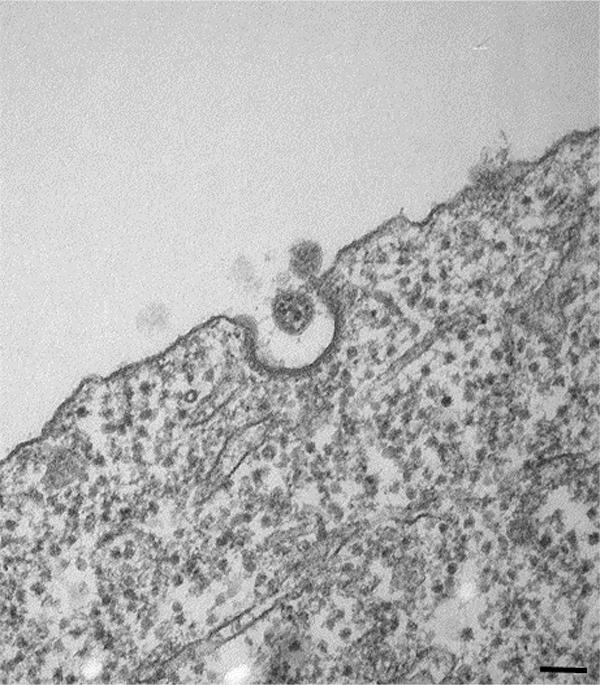
(図2) 感染したACE2-iPS細胞のTEM画像。
細胞膜の近く(黒い矢印)ウイルス粒子が観察されました。
次に、非感染・感染iPS細胞における遺伝子およびタンパク質発現を解析しました。SARS-CoV-2に感染したACE2-iPS細胞において、細胞内ウイルスゲノムが検出されました。また、SARS-CoV-2感染により、未分化マーカーまたは自然免疫応答関連マーカーの遺伝子発現レベルに変化はありませんでした。さらに、内胚葉、中胚葉、外胚葉マーカーの遺伝子発現レベルも変化しませんでした。免疫染色の結果、SARS-CoV-2 N蛋白質が感染2日後にACE2-iPS細胞で強く発現していることが確認できました(図3)。
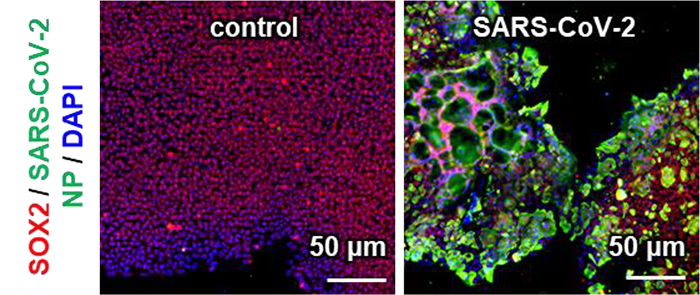
(図3) SARS-CoV-2非感染・感染ACE2-iPS細胞におけるSARS-CoV-2 N蛋白質(緑)、
OCT3/4(赤)、およびSOX2(赤)の免疫染色結果。DAPI(青)で核染色。
4) ACE2-iPS細胞を用いたCOVID-19治療薬候補の評価
ACE2-iPS細胞が薬物スクリーニングに使用可能かを検討しました。COVID-19臨床試験で使用されている8つの治療薬候補を対象とした評価を実施しました。様々な濃度の治療薬候補を添加した後、培養上清中のウイルスゲノムコピー数を測定しました(図4)。結果、8つの治療薬候補の中で、レムデシビルの抗ウイルス効果が最も強いことが確認できました。一方、クロロキンとファビピラビルはウイルス複製を阻害せず、イベルメクチンは細胞毒性が高いことが判明しました。RNA依存性RNAポリメラーゼ(RdRp)阻害剤であるレムデシビルとEIDD-2801、TMPRSS2阻害剤であるカモスタットとナファモスタットが、ACE2-iPS細胞において抗ウイルス効果を示すことが確認されました。したがって、ACE2-iPS細胞はCOVID-19治療薬候補を評価可能なツールであることが確認できました。
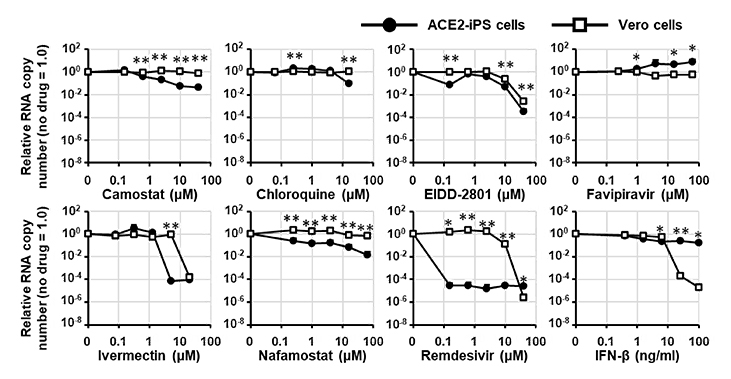
(図4) ACE2-iPS細胞とVero細胞に、各種治療薬候補存在下でSARS-CoV-2感染させた後、
細胞培養上清中のウイルスゲノムコピー数を測定しました。
レムデシビル(下段右から2列目)の抗ウイルス効果が最も強いことが確認できました。
5) 複数ドナーより樹立したACE2-iPS/ES細胞株でのSARS-CoV-2感染実験
8人のドナーから樹立されたヒトACE2-iPS/ES細胞を使用してSARS-CoV-2感染実験を行いました。ウイルスの複製効率はACE2-iPS/ES細胞株間で異なっており(図5A)、興味深いことに、男性由来のACE2-iPS/ES細胞のウイルス複製能力は女性由来のACE2-iPS/ES細胞のウイルス複製能力よりも高いことが確認できました(図5B)。これは、ACE2-iPS/ES細胞を用いることでSARS-CoV-2に対する感受性の性差が再現できることを示唆しています。
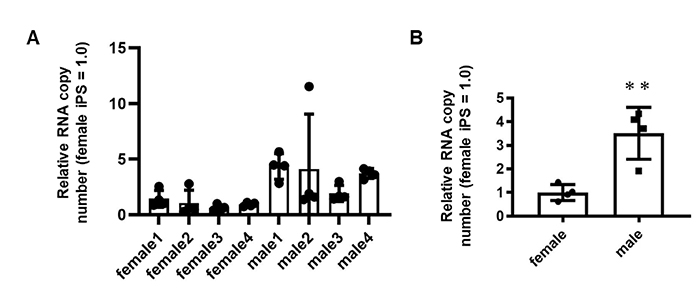
(図5) ACE2を発現した女性由来ES/iPS細胞株(4株)と男性由来ES/iPS細胞株(4株)にSARS-CoV-2を感染させました。
(A) 培養上清中のウイルスゲノムコピー数を測定しました。
(B) 培養上清中のウイルスゲノムコピー数を、女性由来iPS/ES細胞と男性由来iPS/ES細胞間で比較しました。
4. まとめ
本研究では、ACE2-iPS細胞においてSARS-CoV-2の生活環を再現できることを示しました。また、ACE2-iPS細胞を用いてTMPRSS2阻害剤やRdRp阻害剤の抗ウイルス効果を確かめることができました。さらに、8ドナーのACE2-iPS/ES細胞を用いて、SARS-CoV-2粒子の産生能に差があることを確認できました。今後、ヒトiPS 細胞パネルを用いることによって、性別だけでなく、人種や血液型の違いがSARS-CoV-2感染に及ぼす影響を調べることが可能になると期待されます。ゲノム配列情報を取得しているiPS細胞パネルを用いてSARS-CoV-2感染実験を行うことによって、SARS-CoV-2感染およびCOVID-19重症化の責任遺伝子変異が特定できるようになると期待されます。
5. 論文名と著者
- 論文名
Modeling SARS-CoV-2 infection and its individual differences with ACE2-expressing human iPS cells - ジャーナル名
iScience - 著者
Emi Sano1*, Sayaka Deguchi1, Ayaka Sakamoto1, Natsumi Mimura1, Ai Hirabayashi2,3, Yukiko Muramoto2,3, Takeshi Noda2,3, Takuya Yamamoto1,4,5,6, Kazuo Takayama1**
*:筆頭著者、**:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学 ウイルス・再生医科学研究所
- 国立研究開発法人科学技術振興機構 戦略的創造研究推進事業(CREST)
- 京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)
- 理化学研究所革新知能総合研究センター(AIP)
- 国立研究開発法人日本医療研究開発機構(AMED)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 京都大学基金 iPS細胞研究基金
- COVID-19 Private Fund (山中研究室への寄付金)
- 京都大学 ウイルス感染症・生命科学先端融合的共同研究拠点
- 公益財団法人 アステラス病態代謝研究会
- 公益財団法人 千里ライフサイエンス振興財団
- 公益財団法人 三菱財団
- 国立研究開発法人科学技術振興機構 CREST
- 国立研究開発法人日本医療研究開発機構
7. 用語説明
注1) SARS-CoV-2
新型コロナウイルス感染症を引き起こすウイルスの名称。重症急性呼吸器症候群(SARS:severe acute respiratory syndrome)コロナウイルス(CoV)の関連株。
注2) ACE2
アンジオテンシン変換酵素Ⅱ(Angiotensin-converting enzyme 2)。SARS-CoV-2の受容体。
注3) 生活環
ウイルスが細胞に感染し、ウイルス自身の遺伝子を複製させ、感染性ウイルス粒子を作って、放出させる一連の現象のこと。
注4) COVID-19
新型コロナウイルス感染症の正式名称。CO=「corona」、VI=「virus」、D=「disease」。
注5) ERGIC(Endoplasmic Reticulum-Golgi Intermediate Compartment)
核膜の外壁とつながっている小胞体とゴルジ体の中間区間をさす。
注6) 二重膜小胞(Double Membrane Vescicle: DMV)
感染細胞の二重膜小胞内には2本鎖RNAが検出されることから、二重膜小胞はウイルスRNA合成の場と考えられている。
注7) Vero細胞
アフリカミドリザルの腎臓上皮細胞に由来した細胞株。広範囲のウイルスの感染を受けやすいため、 SARS-CoV-2を含むウイルスの研究に幅広く使われる。
注8) TMPRSS2
Ⅱ型膜貫通型セリンプロテアーゼ(transmembrane protease, serine 2)。SARS-CoV-2のSタンパクを切断することで宿主細胞への侵入を促進する。