2024-03-28 京都大学iPS細胞研究所
ポイント
- パーキンソン病をはじめとするαシヌクレイノパチー関連認知症に関する神経変性の機序には不明な点が多い。
- α-シヌクレイン遺伝子変異を有するパーキンソン病患者さん由来の大脳皮質神経細胞では、MAPキナーゼ注1)であるERK1/2とJNKによるシグナル経路が活性化していることを明らかにした。
- それぞれの経路の選択的阻害薬を投与すると、大脳皮質神経細胞死が抑制されることを示した。
1. 要旨
鈴木英文(京都大学大学院医学研究科脳病態生理学講座臨床神経学、理化学研究所バイオリソースセンター(BRC)iPS創薬基盤開発チーム研究生、京都大学iPS細胞研究所(CiRA)増殖分化機構研究部門非常勤研究員)、髙橋良輔(京都大学大学院医学研究科脳病態生理学講座臨床神経学教授)、井上治久(理化学研究所BRC iPS創薬基盤開発チームチームリーダー、CiRA増殖分化機構研究部門教授、理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム客員主管研究員)らの研究グループは、認知症を来すαシヌクレイノパチーのひとつである家族性パーキンソン病の患者さんから作製したiPS細胞を用いて、神経細胞死を引き起こす分子メカニズムを解明しました。本研究成果は、神経難病であるパーキンソン病やレビー小体型認知症に対する疾患修飾薬注2)の開発に貢献することが期待されます。
研究チームは、α-シヌクレイン遺伝子変異を有する家族性パーキンソン病の患者さんからiPS細胞を樹立し、大脳皮質神経細胞に分化させて解析に用いました。患者さん由来の神経細胞では、健常者由来の神経細胞と比べて原因タンパク質であるα-シヌクレイン注3)の異常凝集体が増加し、顕著な神経細胞死が観察されました。さらに、ERK1/2経路とJNK経路が活性化していることを見出し、それぞれの経路の選択的阻害薬の投与により神経細胞死が抑制されました。
本研究は、2024年3月6日に科学雑誌『Molecular Brain』オンライン版に掲載されました。
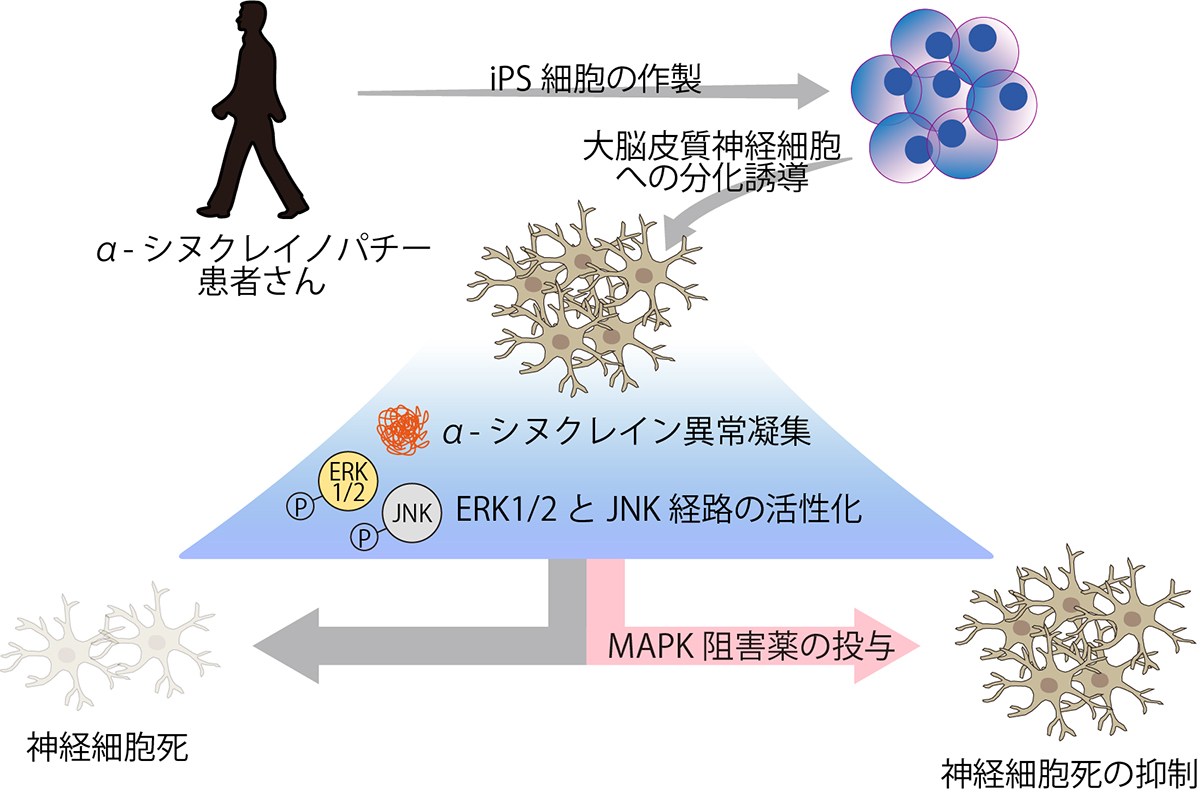 研究の概要図
研究の概要図
2. 研究の背景
αシヌクレイノパチー関連認知症は、パーキンソン病を含むαシヌクレインというタンパク質が蓄積する神経変性疾患で、アルツハイマー病に次いで患者さんの数が多い認知症です。加齢が発症要因の一つであるため、今後さらに患者数が増加し続けることが見込まれます。しかし、現在のところ病気の進行を食い止めることができる根治的な治療法はなく、対症療法が治療の中心です。
パーキンソン病は動作緩慢、静止時振戦、筋強剛といった特徴的な運動症状が前景に立ちますが、患者さんのうち約80%は認知機能障害をきたします。認知機能障害は運動症状と並び、患者さんおよび介護者である家族の生活の質を損なう主な要因です。パーキンソン病などαシヌクレイノパチーにおける認知症では、大脳皮質神経細胞の変性と異常凝集したα-シヌクレインタンパク質の蓄積がみられることが知られています。しかし、大脳皮質神経細胞がなぜ変性するのか、その機序についてはほとんど解明されていません。また、認知症の主な原因であるレビー小体型認知症はパーキンソン病と同様に異常凝集したα-シヌクレインタンパク質の蓄積がみられます。レビー小体型認知症は、パーキンソン病と同様に患者さんが増えている一方で、現在の治療は対症療法やリハビリテーションが中心となっています。α-シヌクレイン遺伝子変異を有する家族性パーキンソン病の患者さんの大脳皮質神経細胞死のメカニズムを解明することは、パーキンソン病だけでなくレビー小体型認知症にも進行抑制効果を示す根治的な治療法の開発に貢献することが期待されます。
3. 研究結果
本研究では、まずα-シヌクレインをコードするSNCA遺伝子にA53T変異をもつ家族性パーキンソン病注4)患者さんの体細胞からiPS細胞を樹立し、高効率な分化誘導法を用いて認知症の発症に関わる大脳皮質神経細胞を作製しました。患者さん由来iPS細胞と健常者由来iPS細胞それぞれから分化した大脳皮質神経細胞を解析したところ、患者さん由来の大脳皮質神経細胞では、健常者由来の大脳皮質神経細胞と比べて異常凝集したα-シヌクレインタンパク質の増加、神経突起の伸張障害、神経細胞死の増加がみられることがわかりました(図1)。
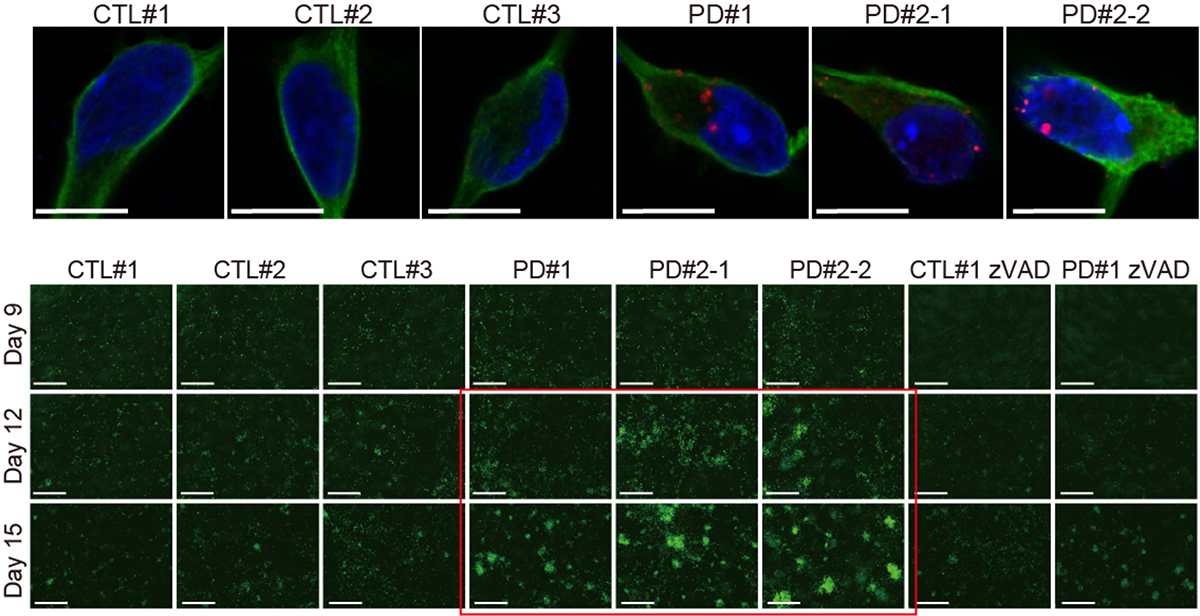 図1 iPS細胞から誘導した大脳皮質神経細胞の特性解析
図1 iPS細胞から誘導した大脳皮質神経細胞の特性解析
(上段)健常者由来(CTL#1、CTL#2、CTL #3)と家族性パーキンソン病患者さん由来(PD#1、PD#2-1、PD#2-2)の大脳皮質神経細胞の共焦点顕微鏡画像。家族性パーキンソン病患者さん由来の大脳皮質神経細胞ではα-シヌクレインの異常凝集体(赤色)が増加している。神経細胞は緑色で、核は青色で染色されている。
(下段)大脳皮質神経細胞を経時的に観察したところ、家族性パーキンソン病患者さん由来のiPS細胞からの分化誘導において、分化開始後12日目(Day 12)、15日目(Day 15)に細胞死の一形態であるアポトーシスを起こした細胞(緑色)が増加する(赤枠)。zVADはアポトーシス阻害薬であるz-VAD-FMKの略。
次に、患者さん由来の大脳皮質神経細胞でなぜこれらの変化が観察されたのかを詳しく調べるため、網羅的な遺伝子発現を解析しました。その結果、MAPキナーゼ経路に関連する遺伝子群の発現が変動していることが判明し、生化学的な解析から、MAPキナーゼ経路のうち、特にERK1/2経路とJNK経路が患者さん由来の大脳皮質神経細胞で活性化していることを見出しました。
さらに、活性化しているERK1/2経路とJNK経路を抑制することで神経細胞死を抑えられるか検証した結果、それぞれの経路に作用する選択的阻害薬の投与により、患者さん由来の大脳皮質神経細胞の細胞死が抑制されました(図2)。
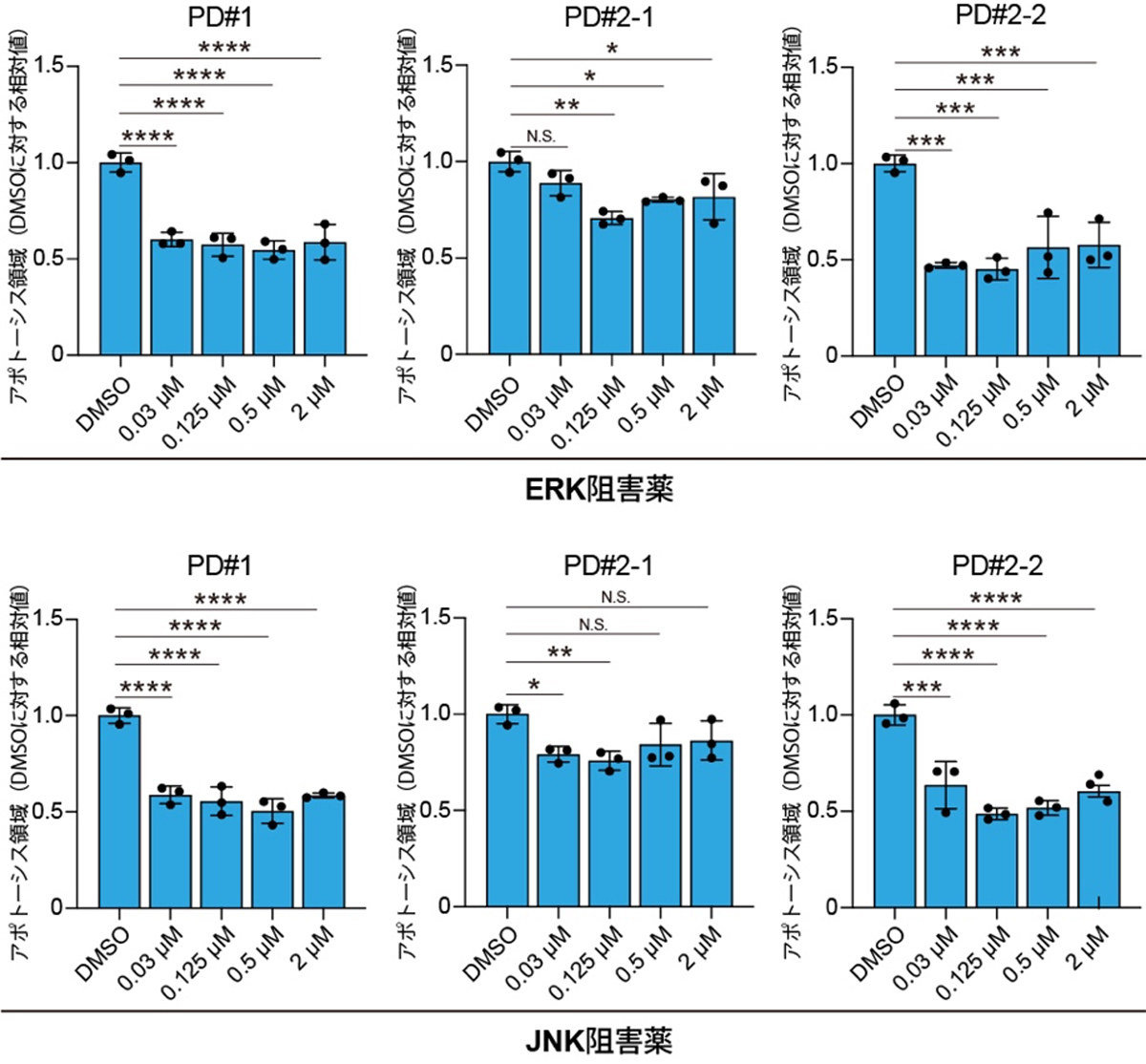 図2 ERK1/2阻害薬とJNK阻害薬による神経細胞死の改善
図2 ERK1/2阻害薬とJNK阻害薬による神経細胞死の改善
家族性パーキンソン病患者さん由来の大脳皮質神経細胞に選択的ERK1/2阻害薬(上段)、選択的JNK阻害薬(下段)を投与することによって、アポトーシスが有意に抑制される。
4. まとめと展望
本研究ではパーキンソン病患者さん由来の大脳皮質神経細胞においてERK1/2経路とJNK経路が活性化していることを発見し、これらの分子経路を抑制することで神経細胞死が改善されることを示しました。
本研究の成果はαシヌクレイノパチー関連認知症の分子病態の一端を明らかにしたもので、将来的に新たな治療法の開発につながる可能性が期待されます。
5. 論文名と著者
- 論文名
Mutant α-synuclein causes death of human cortical neurons via ERK1/2 and JNK activation - ジャーナル名
Molecular Brain - 著者
Hidefumi Suzuki1,2,3, Naohiro Egawa1,2,3, Keiko Imamura2,3,4, Takayuki Kondo2,3,4, Takako Enami3,4, Kayoko Tsukita2,3, Mika Suga2,3, Yuichiro Yada2,3, Ran Shibukawa2, Ryosuke Takahashi1,*, Haruhisa Inoue2,3,4,*
*責任著者 - 著者の所属機関
- 京都大学大学院医学研究科脳病態生理学講座臨床神経学(脳神経内科)
- 理化学研究所バイオリソースセンター(BRC)iPS創薬基盤開発チーム
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)[JP23bm1323001, JP22bm0804034, JP23bm1423014, JP23bm1423012]
- JSPS科研費 [JP21H02807, JP20K07968, JP23K06827]
- 上原記念生命科学財団研究助成金
- キヤノン財団研究助成プログラム
7. 用語説明
注1)MAPキナーゼ
分裂促進因子活性化タンパク質(mitogen-activated protein)をリン酸化する酵素の総称。ERK1/2やJNKのほかに、p38などが含まれる。細胞の増殖や分化、発生など、さまざまな機能を担っている。
注2)疾患修飾薬
病気の症状を緩和する対症療法とは異なり、根本的な原因に作用することによって発症や進行を抑制する治療薬のこと。パーキンソン病を含め、多くの神経難病において疾患修飾薬の開発が希求されている。
注3)α-シヌクレイン
神経細胞に多く存在し、神経伝達物質の輸送などの役割を果たす。生理的には単量体で存在しているが、異常凝集すると細胞毒性を発揮すると考えられ、パーキンソン病やレビー小体型認知症などを発症する要因となる。
注4)家族性パーキンソン病
遺伝子異常に起因して発症するパーキンソン病。パーキンソン病の大部分は孤発性であるが、約10%が家族性パーキンソン病である。現在までに20個以上の原因遺伝子が知られている。α-シヌクレインA53T変異は稀な変異であるが、孤発性の患者さんと類似する臨床像と病理像を示すため、孤発性と共通の機序で発症していると考えられている。