2021-05-18 順天堂大学,日本医療研究開発機構
概要
順天堂大学大学院医学研究科耳鼻咽喉科学の神谷和作 准教授、福永一朗 非常勤助教らの研究チームは、遺伝性難聴1*の中で最も頻度の高いGJB2(コネキシン26;CX26)変異型難聴2*の原因となる内耳ギャップ結合3*形成細胞をヒトのiPS細胞から作る技術開発により、遺伝性難聴の病態の再現に成功しました。患者iPS細胞から作成した内耳細胞では、難聴発症の原因となるギャップ結合の物質輸送能の顕著な低下が確認できました。これまでの研究で同チームはマウスiPS細胞での疾患モデル細胞の開発を成功させました。本研究ではその方法を発展させることで、患者由来のヒトiPS細胞からの疾患モデル細胞開発と病態の再現を世界で初めて成功させました。今回開発した方法により、個々の難聴遺伝子変異に対応した大規模な薬剤スクリーニングや遺伝子治療開発が可能となり、難聴研究の臨床応用を実現させる大きな成果と言えます。本研究は英国科学誌「Human Molecular Genetics」のオンライン版に2021年5月17日付けで掲載されました。
本研究成果のポイント
- ヒトiPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞を作製する方法を開発
- GJB2変異患者由来iPS細胞を用いて難聴の分子病態を再現
- 遺伝性難聴に対する薬剤スクリーニングや遺伝子治療の開発に期待
背景
聴覚障害は出生児1,000人に1人の割合で発症し、先天性疾患の中で最も高頻度に発生する疾患の一つで、その半数以上は遺伝子変異を原因とする遺伝性難聴です。中でもGJB2変異型難聴は、遺伝性難聴の50%以上もの割合を占めており、世界で最も多いタイプの遺伝性難聴として知られています。GJB2遺伝子が産生するCX26は、内耳の細胞間のイオン輸送を行うギャップ結合の構成要素の一つであり、内耳リンパ液のイオン組成を保つことにより音の振動を神経活動へ変換する重要な分子ですが、その変異によりギャップ結合の構造が保てず難聴になります。現時点では、本疾患に対する根本的な治療法や治療薬は存在せず、その開発が求められています。この遺伝性難聴では、iPS細胞などの多能性幹細胞からCX26ギャップ結合を形成する内耳細胞群、とくに蝸牛支持細胞(図上)の作製が最も重要です。本研究チームは、これまでにマウスiPS細胞から内耳細胞群を作成し病態の再現に成功していますが、ヒトiPS細胞においてはGJB2遺伝子がコードするCX26による巨大ギャップ結合を形成する内耳細胞の作成技術はありませんでした。
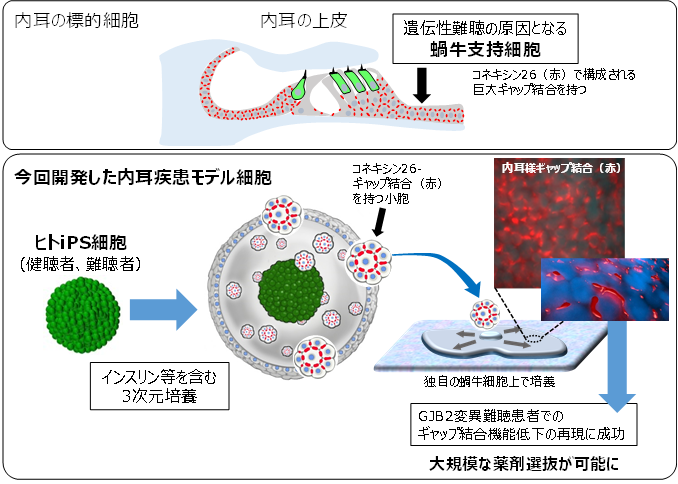
図:遺伝性難聴の標的となる内耳細胞と今回開発した内耳疾患モデル細胞上: 内耳における難聴の標的細胞。世界で最も多いGJB2変異型難聴の標的細胞はコネキシン26で構成されるギャップ結合を持つ蝸牛支持細胞。
下:今回開発された内耳疾患モデル細胞。インスリン等を含む3次元培養と独自の蝸牛細胞上での2次元培養を組み合わせ、内耳と同様のギャップ結合を持つ疾患モデル細胞が作製された。GJB2変異型難聴患者由来のiPS細胞から作製した内耳細胞ではギャップ結合機能の低下が再現された。
この疾患モデル細胞を用いることにより大規模な薬剤スクリーニングや遺伝子治療の開発が期待できる。
研究チームはこれまでマウスiPS細胞から内耳同様にギャップ結合を均一に形成する細胞シートの作製法を開発しました(特許取得)。この方法により難聴モデル細胞を作製し、世界で最も多いGJB2変異型難聴の病態をマウス細胞で再現することに成功しています。しかし、ヒトiPS細胞から同様の難聴モデル細胞を作製することは困難であり、特に重要なGJB2変異型難聴患者由来のiPS細胞で病態を再現することはこれまで成功していませんでした。
内容
今回、研究チームはマウスiPS細胞での内耳細胞作製法を改良し、ヒトiPS細胞においてもギャップ結合のネットワークを形成する内耳支持細胞群(蝸牛支持細胞)の作製を試みました。
研究チームはまずヒトiPS細胞を外胚葉に分化させるSFEBq法(無血清凝集浮遊培養法)の過程で、CX26を最も多く発現する三次元培養の条件を選抜しました。特にインスリンを添加した培養法でCX26発現が顕著に増加しました。この三次元培養には他の細胞も混在するため、CX26ギャップ結合が形成される細胞塊を分離し、独自に開発した蝸牛細胞上で培養しました。この培養法により、CX26によるギャップ結合を形成する細胞シートが作製できました。作製した細胞シートのギャップ結合は内耳と同様に細胞間で物質を輸送する能力を持ちました。さらに、疾患モデル細胞としての機能を確認するため、日本人に典型的なGJB2遺伝子変異を持つ難聴患者のiPS細胞から内耳細胞を作成したところ、難聴発症の原因となるギャップ結合の物質輸送能の顕著な低下が再現できました(図下)。
本研究で開発したヒトiPS細胞の内耳分化誘導法はiPS細胞から内耳ギャップ結合形成細胞を作製する有効な技術であり、GJB2変異型遺伝性難聴の疾患モデル細胞として、難聴遺伝子変異に対応した大規模な薬剤スクリーニングや遺伝子治療開発への応用が見込まれます。
今後の展開
今回研究チームが開発したヒトiPS細胞から内耳ギャップ結合形成細胞を作製する方法は、これまで根本的治療法の存在していない世界で最も多いタイプの遺伝性難聴の病態を再現できることから、医薬品開発におけるモデル利用を可能とし、難聴研究の臨床応用を実現させる上での大きな成果であると考えます。さらに、研究チームが開発したギャップ結合の薬剤スクリーニング法(特許出願済)や独自の遺伝子治療用ベクター技術を組み合わせることにより、これまで実現されていなかった根本的治療法の開発が期待できます。
研究チームは既に日本人に認められる上位3位までのGJB2変異のiPS細胞を樹立しています。今後はさらに多様なGJB2変異型を持つ遺伝性難聴患者のiPS細胞の樹立と分化誘導により、様々な変異型に応じた遺伝性難聴疾患モデル細胞を作製し、薬剤開発や再生医療を含めた総合的な難聴治療法の開発を目指していきます。
用語説明
- 1* 遺伝性難聴
- 先天性難聴は世界中で出生児1000人に1人の割合で発症し、最も多い先天性障害の一つである。その半数以上は遺伝子に原因を持つ遺伝性難聴とされている。
- 2* GJB2(コネキシン26)変異型難聴
- コネキシン26(CX26)は、遺伝子GJB2(Gap Junction Protein, Beta-2)により合成され、内耳のギャップ結合を構成する主要タンパク質の一つ。GJB2の変異は世界で最も高頻度に検出され、遺伝性難聴の原因と考えられている。 GJB2変異による遺伝性難聴は、感音性難聴であり、我が国では遺伝性難聴の50%以上もの割合を占めるとされ、常染色体劣性と常染色体優性の遺伝形式が確認されている。
- 3* ギャップ結合
- コネキシン26は細胞膜で6個の集合体により分子の通り道を作り、隣の細胞の集合体と連結してギャップ結合を作る。このギャップ結合は分子量約1,000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
原著論文
本研究はHuman molecular genetics誌のオンライン版で(2021年5月17日付)先行公開されました。
- タイトル
- Modeling Gap junction beta 2 gene-related deafness with human iPSC
- タイトル(日本語訳)
- ヒトiPS細胞からのGJB2変異型難聴のモデル化
- 著者
- Ichiro Fukunaga, Yoko Oe, Keiko Danzaki, Sayaka Ohta, Cheng Chen, Kyoko Shirai, Atsushi Kawano, Katsuhisa Ikeda, Kazusaku Kamiya
- 著者(日本語表記)
- 福永一朗1)、大江洋子1)、檀崎敬子1)、太田沙弥香1)、陳城1)、白井杏湖2)、河野淳2)、池田勝久1)、神谷和作1)
- 著者所属
- 1)順天堂大学医学部耳鼻咽喉科学講座、2)東京医科大学耳鼻咽喉科
- DOI
- 10.1093/hmg/ddab097
研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発代表者 神谷和作)、AMED次世代治療・診断実現のための創薬基盤技術開発事業(研究開発代表者 神谷和作)、文部科学省科学研究費 基盤研究B (課題番号18H02953、17H04348) 、基盤研究C(課題番号19K09914)、挑戦的研究(萌芽)(課題番号20K21662)、私立大学戦略的研究基盤形成支援事業、武田科学振興財団などの支援を受け行われました。
なお、本研究にご協力いただいた皆様には深謝いたします。
お問い合わせ先
研究内容に関するお問い合せ先
順天堂大学大学院医学研究科 耳鼻咽喉科学
准教授 神谷 和作(かみや かずさく)
順天堂大学に関するお問い合せ先
順天堂大学 総務局総務部 文書・広報課
担当:長嶋 文乃(ながしま あやの)
AMEDの事業についてのお問い合せ先
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 遺伝子治療研究開発課
難治性疾患実用化研究事業 担当
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当