バイオマーカー分子を指標とした自動病理診断の実現へ
2018-04-19 慶應義塾大学 医学部,日本医療研究開発機構(AMED),科学技術振興機構(JST)
慶應義塾大学の末松 誠 客員教授(本務:日本医療研究開発機構 理事長)、同医学部 医化学教室の山本 雄広 専任講師らの研究グループは、富士フイルム株式会社 先端コア技術研究所の塩田 芽実 研究員、納谷 昌之 研究主幹らとの共同研究により、表面増強ラマンイメージング(Surface-enhanced Raman Spectroscopy imaging:以下、SERS imaging)を用いて、マウス凍結病理組織切片におけるがん部と非がん部の代謝プロファイリング解析を行い、両者の違いを統計的に分析することによって、がんの所在を非標識・無染色で自動的に可視化することに成功しました。
SERS imagingは金のナノ粒子をランダムに敷き詰めた特殊基板に近赤外レーザー光を照射することによって発生する近接場光(強力な電磁場の増強スポット)を利用し、基板上の生体試料に含まれる各種の代謝物の原子間振動を反映するラマン散乱光注1)を増強して、代謝物の2次元画像として検出する先端技術です。
がん細胞には細胞増殖や細胞死の制御に関わる硫黄原子を含有する機能分子が豊富に含まれており、それらは金ナノ粒子と相互作用することによって固有の原子間振動を反映したラマン散乱光を発生させます。ラマン散乱光を画像化することで生体試料の2次元上のどの位置に機能分子が存在するか可視化することができます。これまではがん細胞の形態や核の特徴に着目した組織染色により病理診断を実施されてきましたが、検体処理過程に生じる酸化などが正確な解析を困難にする原因でした。研究グループは、がん部と非がん部のSERS imagingを用いることによって非標識・無染色の凍結組織でがん部の検出を可能としました。
病理医の診断所見とラマン散乱光のプロファイリング所見のマッチングによる解析技術は、がんの質的自動病理診断の実現につながる道を開きました。
本研究成果は、2018年4月19日(英国標準時)に英国科学誌「Nature Communications」のオンライン速報版で公開されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(ERATO) 末松ガスバイオロジープロジェクト(2009~2014、研究総括 末松 誠:当時)および、日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域(研究開発総括 清水 孝雄)※における研究開発課題「代謝システム制御分子の系統的探索による治療戦略創出と創薬展開」(研究開発代表者 加部 泰明)により実施されました。
※本研究開発領域は、2015年4月の日本医療研究開発機構の発足に伴い、科学技術振興機構(JST)より移管されたものです。慶應義塾大学の末松 誠 客員教授は、AMED-CRESTの研究費を受給しておりません。
がんは遺伝子変異によって、自らの生存に有利な各種の代謝物を生成し、周囲の非がん組織と異なる代謝特性を示します。また活発に周囲の正常組織から自らの生存に必要な代謝物を収奪し増殖していることが、近年の研究で明らかにされてきました。そのような代謝物の中でもグルタチオン注2)やシステイン注3)、硫化水素などの硫黄を含む代謝物(含硫代謝物)は強力な抗酸化物質として、がん細胞の生存、増殖や薬剤耐性などに関与することが示唆されていますが、実態は明らかではありませんでした。
一方、がんの病理診断は主として染色や抗体による標識を施した組織試料を病理の専門家が光学顕微鏡で調べることによって行われます。生化学的な自動補助診断技術の開発は、病理医の業務の負担軽減につながるだけでなく、抗がん剤に対する耐性の有無や悪性度の判定など、がんの患者さんに資する「質的診断」に役立つ可能性があります。そこで本共同研究ではがんに固有の多様でかつ多数の代謝物の分子情報を包括的に把握する方法としてSERS imagingを利用することを検討しました。
SERS imagingは金のナノ粒子をランダムに敷き詰めた特殊基板に近赤外レーザー光を照射することによって発生する近接場光を利用し、代謝物の原子間振動を反映するラマン散乱光を増強することで、生体試料中の代謝物を2次元画像として検出する先端技術です。
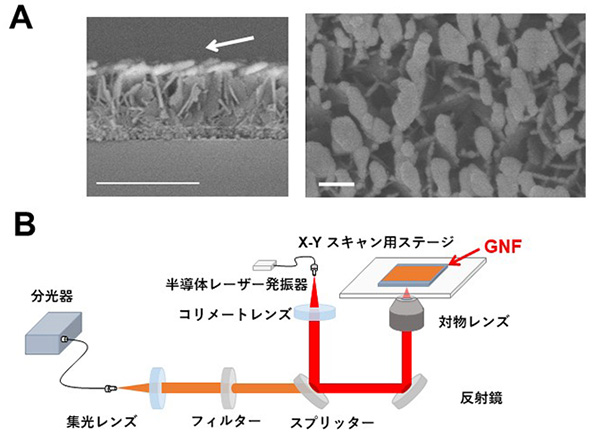
本研究では、富士フイルム株式会社が金ナノ粒子の自己組織化を利用し、世界に先駆けて開発したSERS基板【図1:ソラマメ状の金ナノ粒子:Gold-nanofève(GNF)がランダムに配列した基板】を用い、数センチ角の病理組織中の代謝物について、発生するラマン散乱光を高感度・高解像度で画像化する技術を確立しました。
この技術を用い、ヒト大腸がん細胞株を免疫不全マウスの脾臓に移植してできる異種移植肝転移モデルと、共同研究者である慶應義塾大学 医学部 先端医化学研究所の佐谷 秀行 教授らが開発した、Ink4a/Arfノックアウトマウス由来の神経幹細胞にH-RasV12遺伝子を導入後に移植して発生する同種神経膠芽腫モデルの、2つの実験モデルで得られるラマン散乱光のスペクトル上にあるピーク(以下、SERS信号)を、がん部、非がん部で詳細に分析しました。これらのモデルのがん組織は実際のヒトの悪性腫瘍と同様の複雑な様相となっています。
異種移植大腸がんモデルのがん部を含む組織切片のSERS imagingを隣合った切片の質量分析イメージングのデータと照合することにより298cm-1のSERS信号がシステインから生成される還元型グルタチオン(GS)を、978cm-1が同じくシステインから生成されるヒポタウリン(HT)を反映するSERS信号であることを特定しました(図2)。
画像上で行ったがんの診断所見(図2上段 がん部は暗い部分)と照らし合わせた結果、大腸がん肝転移モデルではがん部にグルタチオンが豊富に検出できる一方(図2中段)、ヒポタウリン注4)はむしろがんの外側の肝臓実質に存在することが分かりました(図2下段)。
この結果から、多数の代謝物から検出される原子間振動の、がん部と非がん部の特徴の違いに基づき、がんの所在を検出できる可能性が示されました。
そこで研究グループは、複数の代謝物のSERS信号をがん部、非がん部で区別して統計的に分析し、それぞれの部位に特異的なSERS信号を多数抽出しました。さらに、これらの特異的な信号をバイオマーカー・シグニチャーとして利用し、これを病理医によるがん部、非がん部の診断結果のセットと共に「教師データ」としてSERS imagingを解析する画像処理技術を開発しました。この技術は、がん部と非がん部の境界判定が難しい神経膠芽腫(グリオブラストーマ)モデルにおいても、未知の検体のどこにがんが存在するかを自動的に抽出することができました(図3上段)。
また、このモデルのがん部で高いピークを示す化合物の同定を行ったところ、485cm-1のSERS信号に対応する活性硫黄であるポリスルフィドと、726cm-1のSERS信号に対応するヒポキサンチンやイノシン1リン酸(IMP)などのアデニン環含有代謝物が、神経膠芽腫のがん部に豊富に含まれることが明らかになりました(図3下段)。
この技術創出により、熟練した病理医が診断したがん部、非がん部におけるSERS信号を「教師データ」として収集することが可能になり、未知の凍結組織切片を用いて非標識・未染色で自動的にがん部を抽出することができる、自動診断支援システムへの展開の可能性が開かれました。
SERS imaging技術は生体を構成する低分子化合物の全体像を捉えることのできる新しいメタボロミクス解析技術であり、生化学的なアプローチによる補助診断技術となる可能性があります。また、多数の検体を短時間かつ簡便に解析できるこの技術をがんの質的診断に応用することで、がんの術中迅速診断の自動化や境界領域の病変に対する補助診断として活用できる可能性があります。さらに本技術は、がんの代謝プロファイリングデータに基づく化学療法や放射線療法などの治療法の最適化にも資する可能性があり、今後の展開が期待されます。
![]()
図1
金ナノ粒子の造形技術により作られたGNF基板(A:左が側面像、右が上面像)とGNFを用いたSERS imagingのシステム(B)。Aの矢印は金を蒸着させた方向を示す。白く光っている部分が「そらまめ状」の金ナノ粒子であり、それを上から見た写真が右になる。Aのバーは左が500nm、右が100nm。
![]()
図2
SERS imagingによるヒト大腸がん肝転移モデルにおけるグルタチオン(GS)、ヒポタウリン(HT)の組織内検出。
AF:自家蛍光像 バーは1mm
![]()
図3
マウス神経膠芽腫(グリオプラストーマ)モデルにおけるSERS imagingとがん部自動検出。病理医がヘマトキシリン・エオジン染色像(H-E上段左)で検鏡して得られた「教師データ」で描出したがん部(上段中央)の画像検出に基づき、がん部、非がん部に特異的なSERSシグナルを統計的に抽出し、がん部の自動抽出を行った(上段右)。がん部に顕著に認められる代謝物として活性硫黄種であるポリスルフィドとヒポキサンチン、イノシン1リン酸(IMP)などに含まれるアデニン環含有代謝物が同定された。ポリスルフィドは強力なレーザーを用いる質量分析では分解するため検出できなかった。バーは上段が2mm、下段が0.5mm。
- 注1)ラマン散乱光
- インドの物理学者であるラマンにより発見された。光が物質に入射した際に入射光と異なる波長をもつ微弱な散乱光。
- 注2)グルタチオン
- 3つのアミノ酸からなる結合体。還元型と酸化型があり、還元型が多いとがん細胞が死ににくくなる。
- 注3)システイン
- がん細胞は細胞外にあるシスチンを細胞表面にあるCD44という接着分子と複合体を形成することにより安定化する。システインは容易に酸化され、ジスルフィド結合を形成してシスチンとなる。シスチンの結合が加水分解すると2分子のシステインとなる。
- 注4)ヒポタウリン
- タウリンの生合成における中間体。がん細胞の酸化ストレスを軽減する役目の一端を担い、がん細胞の生存に必要な物質。
タイトル:“Gold-nanofève surface-enhanced Raman spectroscopy visualizes hypotaurine as a robust anti-oxidant consumed in cancer survival”
(金ナノ粒子を利用した表面増強ラマンイメージングにより明らかにされた抗酸化物質ヒポタウリンを介したがんの生存戦略)
著者名:塩田 芽実、納谷 昌之、山本 雄広、菱木 貴子、谷 武晴、高橋 裕之、久保 亜紀子、小池 大輔、伊藤 真衣、大村 光代、加部 泰明、杉浦 悠毅、平岡 伸介、森川 隆之、田久保 圭誉、推名 健太郎、長島 秀明、オルテア・サンペトレアン、永野 修、佐谷 秀行、山添 昇吾、渡邊 裕之、末松 誠
加部 泰明(カベ ヤスアキ)
慶應義塾大学 医学部医化学教室 専任講師
日本医療研究開発機構 基盤研究事業部 研究企画課
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
富士フイルム株式会社 コーポレートコミュニケーション部
慶應義塾大学 信濃町キャンパス 総務課(鈴木・山崎)
科学技術振興機構 広報課