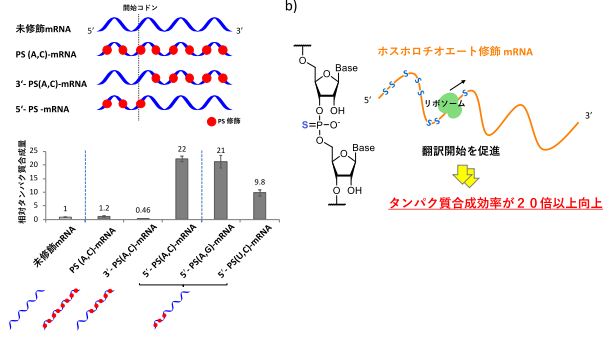
すぐに効いて副作用のない精神・神経疾患の治療法としての応用に期待
2020-07-07 量子科学技術研究開発機構,京都大学霊長類研究所,慶應義塾大学医学部,日本医療研究開発機構
発表のポイント
- 脳に導入した「スイッチ」の役割をする人工受容体1)にのみ作用する作動薬デスクロロクロザピン(以下、DCZ)2)を開発した。
- DCZはこれまでの作動薬に比べ約1/100の量で効果を発揮。
- DCZを全身に投与して前頭葉の「スイッチ」を切ることでサルの記憶機能を繰り返し変化させることに世界で初めて成功した。
- 基礎研究や精神・神経疾患の病態理解が進むとともに、安全ですぐに効果を発揮する治療法の開発につながるなど応用が期待される。
概要
国立研究開発法人量子科学技術研究開発機構(理事長平野俊夫、以下量研という)量子医学・医療部門放射線医学総合研究所脳機能イメージング研究部(グループリーダー南本敬史)、国立大学法人京都大学霊長類研究所(所長湯本貴和)、米国ノースカロライナ大学、米国マウントサイナイ医科大学、および慶應義塾大学医学部(内科学〈神経〉教室教授中原仁)らの共同研究グループは、既存薬よりも性能と安全性を大幅に高めた人工受容体作動薬候補DCZを開発しました。
記憶や意思決定などの脳の機能は担当する多くの脳神経細胞の活動によって生み出されます。また神経細胞の活動が不調になると、精神・神経疾患にみられる様々な症状を引き起こす原因になります。脳機能や疾患の理解のために、実験動物の神経細胞に「スイッチ」の役割を担う人工受容体を導入し、その人工受容体のみに作用する薬(作動薬)を投与することで特定の神経細胞の働きをオン/オフする手法が用いられています。しかし、この手法で用いられる代表的な作動薬は、作用するまで時間が掛かる、標的以外の受容体に働いて有害な作用(副作用)をもたらすなど、その有効性や安全性に疑念が生じていたことから、これらの課題を克服する新しい作動薬の開発が急務でした。
今回の人工受容体作動薬DCZの開発によって、既存作動薬の約1/100の量で標的の神経細胞の「スイッチ」を安全かつ素早く切り替えられるようになりました。さらに、記憶を担当するサルの前頭前野3)の神経細胞に「スイッチ」を導入し、DCZを投与することで記憶を繰り返し「オフ」にすることに世界で初めて成功しました(図1)。
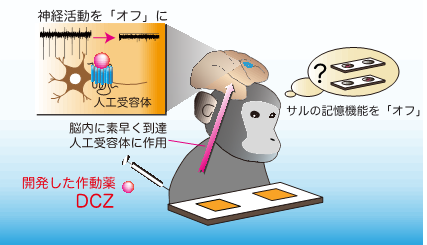
図1:本研究の概要図
本研究成果は、代表的な実験動物であるマウスや、ヒトへの応用前段階の試験で重要視されるサルでの有効性が確認できたことから、今後、脳機能や精神・神経疾患の基礎研究に大きく貢献することが期待されます。また臨床応用の観点からも意義は極めて大きく、例えばてんかんの治療では、異常興奮の原因となる神経細胞にだけ「スイッチ」を導入し、症状が出始めた時にすぐにDCZを投与することで、素早くかつ副作用を起こさずに症状を緩和する、などといった応用が考えられます。
本研究は、日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム」、JSPS科研費JP15H05917新学術領域「多元質感知」等における成果を一部活用したもので、「Nature Neuroscience」のオンライン版に(2020年7月7日(火)0:00(日本時間))に掲載予定です。
研究の背景と目的
私たちの記憶や意思決定などさまざまな高次脳機能は、たくさんの神経細胞が協調して働くことで実現されています。神経細胞の活動が不調になると、精神・神経疾患等で認められるさまざまな症状を生じると考えられます。したがって脳機能の仕組みを理解したり、症状を改善する方法を探るためには、特定の神経細胞の活動を変えてどのような機能が変化するかを明らかにすることが非常に重要です。
特定の神経細胞の活動を変化させる手法の一つとして、化学遺伝学(chemogenetics)4)という手法が用いられています。この手法は標的の神経細胞集団に「スイッチ」の役割をする人工受容体を発現させ、人工受容体のみに作用してスイッチをオン/オフする薬(作動薬)を全身に投与することで標的の神経細胞の活動を一定時間だけ変化させるものです。大掛かりな装置を必要としないなど、その簡便さから化学遺伝学は世界中の多くの研究者に利用され、基礎研究だけでなく、疾患の理解や治療法開発などへの応用も期待されています。しかし、化学遺伝学で用いられている代表的な作動薬である酸化クロザピン(Clozapine N-oxide、以下、CNO)は、脳内への到達率が悪いため作用まで時間がかかることに加え、到達率の悪さを補うために大量に投与されたCNOの一部が体内で変換されて別の物質(代謝物)に代わり、それが脳内に元から備わる様々な受容体に働くことで有害な作用(副作用)をもたらすことが近年報告されていました。そのため基礎から臨床応用を目指す上で、有効性や安全性への疑念を払拭することが急務とされていました。
今回研究グループは新しい作動薬DCZを開発し、その有効性と安全性を動物実験により確認しました。
研究の手法と成果
1.DCZは素早く脳に到達して人工受容体にのみ結合する
まず、DCZが脳にすばやく移行し人工受容体に結合するかを確認しました。実験には、線条体5)という脳部位の右側にだけ人工受容体を発現するサルを用いました(図2A)。DCZを放射線で標識して静脈から投与しPET6)測定を行ったところ、人工受容体を発現する部位において特に高い信号がみられ、DCZがこの部位に集積することがわかりました(図2B)。また比較としてこれまでの人工受容体作動薬であるCNOの放射性薬剤を静脈から投与したところ、脳内での信号はほとんどなく、脳にわずかにしか到達しないことが確認できました(図2B)。同様の結果はマウスにおいても確認できました。
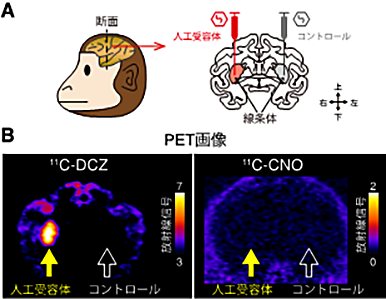
図2:脳内人工受容体への素早い集積の可視化A:標的人工受容体(赤色)とコントロールとしてCNOが結合しない別の人工受容体(灰色)を発現するウイルスベクター7)を投与した部位。
B:PETによって得られた薬剤から放射される信号の集積画像。
また、DCZ投与後の脳内にはCNOで見られたような代謝物は検出されませんでした。マウスについても同様の結果が確認できました。これらのことからDCZは脳へ速やかに到達して高い濃度が持続する一方、代謝物は脳には移行しないため高い有効性と安全性を有すると考えられました。
2.DCZによって素早くピンポイントに神経活動を変えることができる
次に人工受容体を発現する神経細胞の活動がDCZによって変化するかを確認するため、興奮性の人工受容体と神経活動に伴い蛍光を発するタンパク質(蛍光カルシウムプローブ)をマウス大脳皮質の神経細胞に発現させました。神経活動を反映する蛍光強度の変化を二光子顕微鏡8)で測定しながらDCZを微量投与したところ(図3A)、蛍光強度は投与後すぐに増加を始め10分後には最大となりました。この活動は2時間以上持続し4時間後には元に戻っていました(図3B赤)。この活動の増加はCNOを100倍量投与した場合(図3B青)に比べ十分に早く、強いことが確認できました。また、人工受容体を持たない神経細胞の活動にはDCZは影響しないことが確認できました(図3B黒)。
サルにおいても同様の結果が確認でき、DCZは人工受容体を通じてねらった神経細胞の活動を速やかにピンポイントで変化させることが示されました。
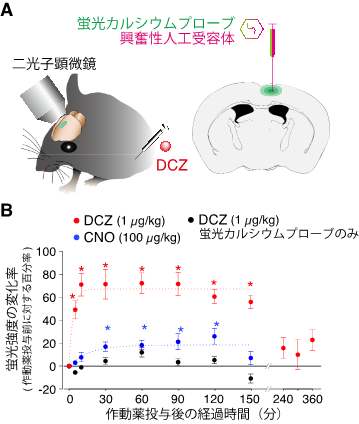
図3:微量DCZ投与による素早い神経活動操作A:マウスに興奮性人工受容体および蛍光カルシウムプローブを発現するウイルスベクターを投与した脳部位。
B:二光子顕微鏡で測定した蛍光強度変化率の時間推移。人工受容体を発現するマウスではDCZの微量投与後すぐに蛍光強度は増加し、10分後には最大となり150分後まで続きました(赤)。CNOはDCZの100倍量を投与しても、蛍光強度の増加はDCZと比べ小さくかつ遅くなりました(青)。またDCZそのものは神経活動に影響せず、人工受容体が発現しない神経細胞の活動変化はみられませんでした(黒)。
3.DCZと人工受容体「スイッチ」でサルの記憶機能をオフに
DCZと人工受容体の組み合わせで動物の脳機能を一定時間、繰り返し操作できるかを確かめるため、サルの記憶機能のひとつである作業記憶9)を「オフ」にすることを試みました。作業記憶を担当することが知られている脳部位の前頭前野の神経細胞に、抑制型(オフ型)の人工受容体を導入し、その様子をPET測定で画像化することで確認しました(図4A)。作業記憶を評価するためのテスト(図4B)では、サルが見ている前で左右の穴のどちらかにエサを入れて蓋をし、待ち時間の間カーテンを引いて目隠しをした後、サルにエサが入っている穴を当てさせます。DCZがない条件では、サルはエサが入っている穴をおおむね正しく選び、その正答率は待ち時間10秒でも約80%でした(図4C青)。これに対し、DCZを投与すると待ち時間10秒での正答率が約50%、つまり当てずっぽうで答えるレベルにまで低下し(図4C赤)記憶が保てなくなりました。またDCZ投与の翌日には正答率はDCZなしのレベルに戻っており、DCZの効果は24時間以内に消失することを確認しました。
このようにDCZの微量投与により人工受容体を介してサルの前頭前野などの大きな脳部位の神経活動を抑制し、その脳部位が担当する機能を一時的に「オフ」にできることが確認できました。
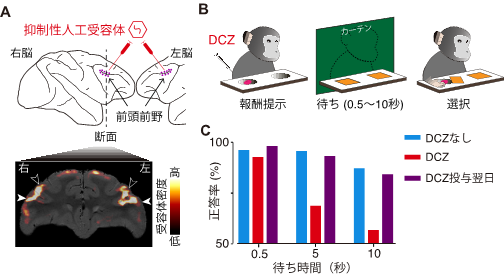
図4:DCZを用いた前頭前野の神経活動操作による作業記憶の低下A:人工受容体を発現するウイルスベクターを投与した部位とPETから得られた人工受容体密度分布画像。
B:記憶テストの模式図。
C:遅延時間ごとの正答率。DCZ投与時(赤)は待ち時間が長くなるほど正答率が大きく低下しました。またDCZ投与翌日(紫)には正答率がコントロールの水準(溶媒・青)に回復しました。
今後の展開
開発した作動薬DCZは、これまでの代表的な作動薬と比べて100分の1の量で神経活動を繰り返し安全に調節できることが実証されました。代表的な実験動物であるマウスや、ヒトへの応用前段階の試験で重要視されるサルでの有効性が確認できたことから、今後、脳機能や精神・神経疾患の基礎研究に大きく貢献することが期待されます。例えば、うつ病で見られる脳活動状態を作り出すモデル動物をつくることで、治療薬などを開発するなどの応用が考えられます。さらに、基礎研究から得られた知見をもとに、精神・神経疾患の画期的な遺伝子治療法を進める際にも、即効性が高く副作用リスクの少ないDCZは有力な候補薬物であり、臨床応用の観点からも本研究成果の意義は極めて大きいと考えられます。例えば、てんかんの症状の原因となる異常活動を示す神経細胞にのみ「オフ」にする人工受容体を導入し、症状が出たときだけDCZを投与してすぐに症状を緩和する、などといった応用が考えられます。
用語解説
- 1)人工受容体
- 本来生体内に存在する受容体(内因性受容体)に遺伝子変異を入れることにより作られた、人工の受容体。内因性受容体に神経伝達物質(リガンド)が結合することで神経細胞の活動が変化します。一方、人工受容体は、生体内に存在するいかなるリガンドも結合せず、特定の人工リガンド(作動薬)のみが結合して神経活動が変化します。今回、神経細胞の「スイッチ」として導入した人工受容体には、興奮(オン)型・抑制(オフ)型の2種類があり、ともにこれまでの作動薬である酸化クロザピン(Clozapine N-oxide、略称はCNO)と今回開発したデスクロロクロザピン(略称はDCZ)が結合します。
- 2)デスクロロクロザピン(Deschloroclozapine)
- 今回開発した作動薬の名称。略称はDCZ。
- 3)前頭前野
- 系統発生的にヒトで最もよく発達した脳部位で、思考や創造性などを担う脳の最高中枢と言われる。作業記憶も前頭前野が担う機能の1つ。
- 4)化学遺伝学(chemogenetics)
- 遺伝子変異等によって作られた人工受容体と、生体内に存在する受容体には作用しない人工の作動薬の組み合わせによって神経活動を操作する研究手法。
- 5)線条体
- 脳深部にある領域で、運動機能や意思決定などに関与することが知られています。
- 6)PET
- 陽電子断層撮影法(Positron Emission Tomography)の略称。ポジトロン核種(11C、13N、15O、18F等)で標識したPET薬剤を体内に投与し、特定の体の部位に集積したり体内物質に結合したりするPET薬剤から放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量を測定して画像化する方法
- 7)ウイルスベクター
- 細胞への遺伝子導入を目的に、ウイルスが持つ細胞への感染性を利用し、病原性に関する遺伝子に代わり外来の目的遺伝子を組み込んだもの。遺伝子治療にも応用されています。
- 8)二光子顕微鏡
- 対物レンズを通して2つの光(光子)を焦点付近に集中して照射し、それによって励起され放出された蛍光を捉えるレーザー走査型蛍光顕微鏡の1種。対物レンズの焦点付近のみ励起するため高い解像度の画像が得られ、また波長の長い光を用いることから条件によっては1.6mm程度の深さまで生体脳から画像を得ることができます。
- 9)作業記憶
- 情報を一時的に保ちながら操作する機能。例えばメモにある電話番号をサッと覚え、電話を手に取り番号をプッシュするまでの数秒間記憶するように、情報を使うまで一時的に記憶にとどめるような機能をいいます。
論文について
- タイトル:
- Deschloroclozapine, a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys
- 著者:
- Yuji Nagai1,10, Naohisa Miyakawa1,10, Hiroyuki Takuwa1, Yukiko Hori1, Kei Oyama1, Bin Ji1, Manami Takahashi1, Xi-Ping Huang2,8, Samuel T. Slocum2, Jeffrey F. DiBerto2, Yan Xiong3, Takuya Urushihata1, Toshiyuki Hirabayashi1, Atsushi Fujimoto1, Koki Mimura1, Justin G. English2, Jing Liu3, Ken-ichi Inoue4,5, Katsushi Kumata6, Chie Seki1, Maiko Ono1, Masafumi Shimojo1, Ming-Rong Zhang6, Yutaka Tomita7, Jin Nakahara7, Tetsuya Suhara1, Masahiko Takada4, Makoto Higuchi1, Jian Jin3, Bryan L. Roth2,8,9, Takafumi Minamimoto1
- 所属:
-
- Department of Functional Brain Imaging, National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology
- Department of Pharmacology, University of North Carolina at Chapel Hill School of Medicine
- Mount Sinai Center for Therapeutics Discovery, Departments of Pharmacological Sciences and Oncological Sciences, Tisch Cancer Institute, Icahn School of Medicine at Mount Sinai
- Systems Neuroscience Section, Primate Research Institute, Kyoto University
- PRESTO, Japan Science and Technology Agency
- Department of Radiopharmaceuticals Development, National Institute of Radiological Sciences, National Institutes for Quantum and Radiological Science and Technology
- Department of Neurology, Keio University School of Medicine
- Division of Chemical Biology and Medicinal Chemistry, Eshelman School of Pharmacy, University of North Carolina at Chapel Hill
- National Institute of Mental Health Psychoactive Drug Screening Program (NIMH PDSP), Department of Pharmacology, University of North Carolina at Chapel Hill Medical School
- These authors contributed equally.
お問い合わせ先
研究内容について
国立研究開発法人量子科学技術研究開発機構
量子医学・医療部門 放射線医学総合研究所 脳機能イメージング研究部
グループリーダー 南本敬史
研究員 永井裕司
主任研究員 宮川尚久
報道対応
国立研究開発法人量子科学技術研究開発機構
経営企画部 広報課 中禎弘
慶應義塾大学 信濃町キャンパス総務課 鈴木・山崎
AMED事業について
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課