2020-09-19 東京大学,日本医療研究開発機構
発表者
中西真(東京大学医科学研究所 癌防御シグナル分野 教授)
城村由和(東京大学医科学研究所 癌防御シグナル分野 助教)
発表のポイント
- 老化細胞のマーカーとしてp16遺伝子(注1)を利用することで、世界で初めてマウスの個体内で老化細胞を同定し、その性質を明らかにしました。
- 老化細胞は、マウス個体内の様々な臓器に存在し、増殖せずに数ヶ月単位で個体から除去されることがわかりました。肝臓・腎臓から老化細胞を除去すると、非アルコール性脂肪性肝炎(NASH、注2)が顕著に改善することも判明しました。
- 本研究成果により、人間の老化原因のさらなる解明や、抗加齢療法の開発に貢献することが期待されます。
発表概要
細胞は様々なゲノムストレスを受けると、不可逆的な増殖停止を示す老化細胞に誘導されることが知られています。これまで老化細胞の性質については、個体から同定する方法がないため培養細胞系を用いた解析が行われてきました。最近の研究では、老化細胞を加齢個体から除去すると加齢性変化が抑制され、様々な老年病の発症を予防し改善することが示されています。しかし老化細胞が個体内のどこにあるのか、またそれらの性質はどうなっているのかなどの詳細なメカニズムについては不明なままでした。
東京大学医科学研究所に所属する博士課程1年、大森徳貴大学院生、博士課程3年、王德瑋大学院生、城村由和助教、中西真教授(癌防御シグナル分野)、山田泰広教授(先進病態モデル研究分野)、古川洋一教授(臨床ゲノム腫瘍学分野)、井元清哉教授(健康医療インテリジェンス分野)らの研究グループは、老化細胞のマーカー遺伝子であるp16遺伝子に着目し、世界で初めて、一細胞レベルで老化細胞を検出・解析可能なマウスを作製しました。その結果、様々な臓器において老化細胞は存在し、増殖はしないものの加齢に伴いその数が増大することがわかりました。またシングルセルRNA-seq(注3)解析から、老化細胞は臓器や細胞の種類に依存して多様な性質を示すことが明らかになりました。さらに老化細胞の除去により、非アルコール性脂肪肝炎(NASH)による脂肪化や炎症が顕著に改善されました。
本研究成果により、老化を制御する分子基盤が明らかとなり、さらには加齢現象のみならず“がん”や“動脈硬化”などの様々な老年病の予防・治療技術の開発が期待されます。
本研究成果は、2020年9月18日(米国東部夏時間)に、米国の国際医科学雑誌「Cell Metabolism」オンライン版に公開されます。
発表内容
これまでの研究から、老化細胞は個体老化に大きく関わっていることが示唆されていました。しかし加齢個体のどこに老化細胞が存在するのか、その起源はどのような細胞か、それらの細胞内動態や性質はどうなっているのかなどへの問いはほとんど解明されておらず、大きな謎となっていました。
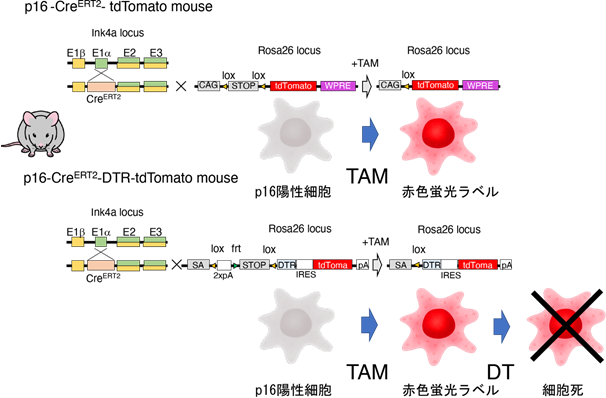
本研究グループでは、世界で初めて老化細胞を一細胞レベルで標識可能なマウスの作製に成功しました。このマウスは、老化細胞のマーカー遺伝子であるp16遺伝子プロモーターの下流にCreERT2リコンビナーゼ(注4)遺伝子を挿入したp16-CreERT2マウスと、CreERT2リコンビナーゼ活性依存的に赤色の蛍光タンパク質であるtdTomatoを発現するRosa26-CAG-lsl-tdTomatoマウスを交配し、タモキシフェン(TAM)依存的に老化細胞を赤色蛍光で標識することで、1細胞レベルの検出・単離が可能となりました(図1)。
中年期に入ったマウスにTAMを投与し、老化細胞を標識したところ、腎臓・肺・肝臓・心臓・脳・小腸・大腸といった解析した全ての臓器において老化細胞が検出されました。次に、老化細胞が加齢に伴って、どのように変化するか調べたところ、個々の老化細胞は増殖していないものの、全ての臓器において、その数が加齢に伴い顕著に増加することがわかりました。老化細胞の生体内における半減期を調べたところ、臓器により違いがあるものの約2~4ヶ月程度であることが明らかになりました。
次に、TAM処理したマウスの肝臓と腎臓から老化細胞を単離して、シングルセルRNA-seq解析を行ったところ、ほとんど全ての種類の細胞集団に頻度の違いはあるものの、老化細胞が存在していることが判明しました。肝臓においては、老化細胞は肝類洞壁内皮細胞(LSECs、注5)において多く同定され、また一部クッパー(Kupffer)細胞(注6)にも認められました(図2)。
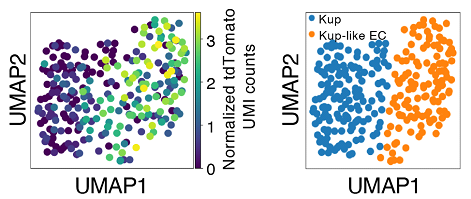
興味深いことに、クッパー細胞において老化細胞が多く存在する画分はクッパー細胞とLSECsの両方の性質を持った新たな細胞集団(クッパー様EC細胞)であることもわかりました。NASHを誘導した肝臓ではLSECs画分やクッパー画分の老化細胞が顕著に増加し、とりわけ老化クッパー細胞においてサイトカイン(注7)シグナルの増強や、細胞接着性の促進などが見られました。腎臓においても老化細胞はほとんど全ての種類の細胞集団に認められましたが、近位尿細管、あるいは遠位尿細管上皮細胞に多く認められました。これらの老化細胞は細胞の種類に依存して性質が多様でありましたが、多くは加齢性変化とよく相関するものでした。
最後に老化細胞の標識と除去を目的として、p16-CreERT2マウスとCreERT2リコンビナーゼ活性依存的にジフテリア毒素(注8)受容体(DTR)を発現するRosa26-CAG-lsl-DTR-tdTomatoマウスを交配し、ジフテリア毒素(DT)依存的にtdTomato赤色蛍光標識された老化細胞を除去可能なマウスを樹立しました。これまでNASH肝臓の脂肪化や炎症細胞浸潤に老化細胞が関わっていることが示唆されておりましたが、実際にNASH肝臓からDT投与により老化細胞を除去すると、脂肪化や炎症が改善することが明らかとなりました(図3)。
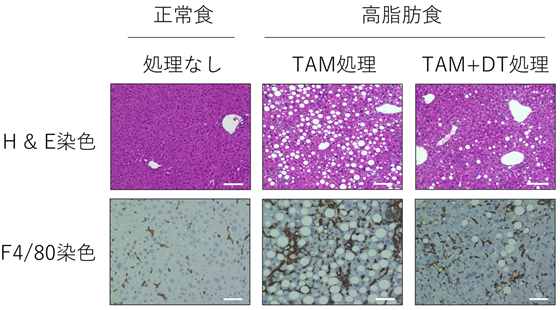
本研究成果により、生体内の老化細胞は、起源となる細胞種類や刺激により多様であることが示されました。個体の加齢現象は多様性に富んでいることがよく知られており、このことは臓器・組織における老化細胞の多様性や、蓄積率の違いにより説明できる可能性があります。今後さらに詳細に解析することで、各臓器・細胞における老化の原因や機能低下を制御する分子基盤が明らかになることが期待されます。また老化細胞を除去する新たな技術の開発を通じて革新的な抗加齢療法や、老年病の予防・治療薬の開発にもつながることが期待されます。また老化細胞の蓄積は加齢に伴うがん発症を促進することが予想されており、本研究で作成したマウスは、なぜ加齢に伴ってがんになりやすくなるのかを解明する強力なツールとなります。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の老化メカニズムの解明・制御プロジェクト、革新的がん医療実用化研究事業、および日本学術振興会(JSPS)科学研究費助成事業(JP26250027、JP22118003、JP16K15239、JP18H05026m、JP19H03431、JP20H04940、and JP 16H06276)の研究助成により実施されました。
発表雑誌
- 雑誌名
- 「Cell Metabolism」(2020年9月18日オンライン版)
- 論文タイトル
- Generation of a p16 reporter mouse and its use to characterize and target p16hight cells in vivo
- 著者
- Satotaka Omori#, Teh-Wei Wang#, Yoshikazu Johmura*, Tomomi Kana, Yasuhiro Nakano, Taketomo Kido, Etsuo A Susaki, Takuya Nakajima, Shigeyuki Shichino, Satoshi Ueha, Manabu Ozawa, Kisho Yokote, Soichiro Kumamoto, Atsuya Nishiyama, Takeharu Sakamoto, Kiyoshi Yamaguch, Seira Hatakeyama, Eigo Shimizu, Kotoe Katayama, Yasuhiro Yamada, Satoshi Yamazak, Kanako Iwasaki, Chika Miyoshi, Hiromasa Funato, Masashi Yanagisawa, Hiroo Ueno, Seiya Imoto, Yoichi Furukawa, Nobuaki Yoshida, Kouji Matsushima, Hiroki R Ueda, Atsushi Miyajima, and Makoto Nakanishi* (#共同第一著者、*共同責任著者)。
- DOI
- 10.1016/j.cmet.2020.09.0006
- URL
- https://doi.org/10.1016/j.cmet.2020.09.0006
用語解説
- (注1)p16遺伝子
- 細胞周期の進行を制御する、CDK4およびCDK6キナーゼを特異的に阻害するタンパク質。老化細胞で特異的に発現増加することから、老化細胞マーカーとして利用されている。
- (注2)非アルコール性脂肪肝炎(NASH)
- アルコール非依存的に肝臓に脂肪が蓄積し炎症や線維化が起きてしまう疾病。進行すると肝硬変や肝臓がんになる。
- (注3)シングルセルRNA-seq
- 一細胞ごとにmRNAの発現量を検出する手法。
- (注4)CreERT2リコンビナーゼ
- エストロゲン類似体であるタモキシフェン(TAM)が結合することで、核内に移行され、DNA上のLoxP配列を認識し、部位特異的組換えを起こす。
- (注5)肝類洞壁内皮細胞(LSECs)
- 肝臓の類洞に沿って存在する扁平な細胞で、類洞壁を形成する。類洞内皮細胞と肝細胞の間の空間で類洞を流れてきた血液と、肝細胞との間で物質の交換が行われる。
- (注6)クッパー(Kupffer)細胞
- 肝臓類洞内に存在するマクロファージの一種で、異物を貪食し、腸管からの内毒素を処理する役割を持つ。
- (注7)サイトカイン
- 細胞間の情報伝達に用いられる低分子タンパク質。
- (注8)ジフテリア毒素
- タンパク質の合成阻害により細胞死を誘導する。
お問い合わせ先
研究に関すること
東京大学医科学研究所 癌防御シグナル分野
教授 中西真(なかにしまこと)
報道に関すること
東京大学医科学研究所 国際学術連携室(広報)
清水麻子
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課