2021-02-24 京都大学iPS細胞研究所
ポイント
- 筋萎縮性側索硬化症(ALS)注1)の検知・診断を速やかに行うことは重要である。
- 本研究では、iPS細胞から作製した健常者の運動ニューロンとALS患者さんの運動ニューロンを高精度に弁別する人工知能モデルの構築に成功した。
- 本研究で構築したDeep LearningとALS iPS細胞による疾患予測テクノロジーは、運動ニューロンの微かな変化を検知し、診断をサポートするとともに、 将来的なALSの治療促進と克服につながる可能性が期待される。
1. 要旨
今村恵子(理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム(上田修功チームリーダー)客員研究員、京都大学CiRA増殖分化機構研究部門特定拠点講師)、矢田祐一郎(理化学研究所バイオリソース研究センター(BRC) iPS創薬基盤開発チーム特別研究員、京都大学CiRA増殖分化機構研究部門共同研究員)、井上治久(理化学研究所AIP iPS細胞連携医学的リスク回避チーム客員主管研究員、京都大学CiRA増殖分化機構研究部門教授、理化学研究所BRC iPS創薬基盤開発チームチームリーダー)らの研究グループは、人工知能のひとつであるDeep Learningという手法を用いて、健康な人のiPS細胞から作製した運動ニューロンとALS患者さんから作製した運動ニューロンを高精度に見分ける人工知能モデルの構築に成功しました。Deep learningとALS iPS細胞を用いた疾患予測テクノロジーは、運動ニューロンの微かな変化を検知し、ALSの診断をサポートするとともに、将来的なALSの治療促進と克服につながる可能性が期待されます。
この研究成果は2021年2月18日午後7時 (日本時間)に米国科学誌「Annals of Neurology」でオンライン公開されました。
2. 研究の背景
ALSは進行性に筋力低下を来す難治性の運動ニューロン疾患です。ALSの臨床診断は、筋力低下や腱反射の亢進などの神経学的所見に基づいて行われますが、これらの所見は病状が進行するまで顕在化しないことが少なくありません。ALSでは、承認されている治療法や、今後新たに開発されるであろう更なる有効な治療法のためにも、速やかな診断が重要であると考えられます。さらに、運動ニューロンの微かな変化を検知することは、速やかな修復を行うために必要です。本研究では、ALS患者さんのiPS細胞から作製した運動ニューロンの画像を用いたDeep LearningによるALSの予測に取り組み、ALSの診断をサポートするテクノロジーの開発を目指しました。
3. 研究結果
1) Deep LearningとiPS細胞由来運動ニューロンを用いたALSを予測する人工知能モデルの構築
健康な人15人とALS患者さん15人のiPS細胞から運動ニューロンを作製し、その運動ニューロンの写真を用いて人工知能に学習させ、ALSの患者さんの運動ニューロンを見分けるモデルを作製しました(図1)。
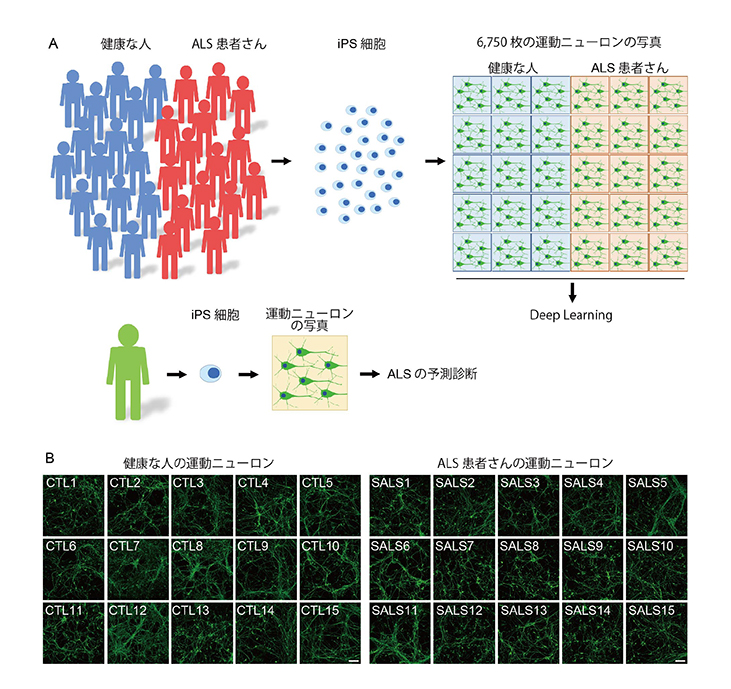
図1. ALS予測のための人工知能モデルの構築
A. ALS予測の人工知能モデルの概念図
B. iPS細胞から作製した運動ニューロンの写真の例
2)予測精度と臨床情報との関連
作製したモデルは高い精度でALS患者さんの運動ニューロンを見分けることができることが分かりました。また、人工知能が運動ニューロンのどの部分をみて判断しているかについて、Grad-CAMという方法で調べたところ、運動ニューロンの細胞体と神経突起に注目していることが分かりました。また、その見分ける精度と患者さんが病気に罹患されていた期間(罹病期間)の長さとの間には関連がみられ、病気の期間が長い患者さんの運動ニューロンの方が人工知能が見分けやすい傾向にあることが分かりました(図2)。
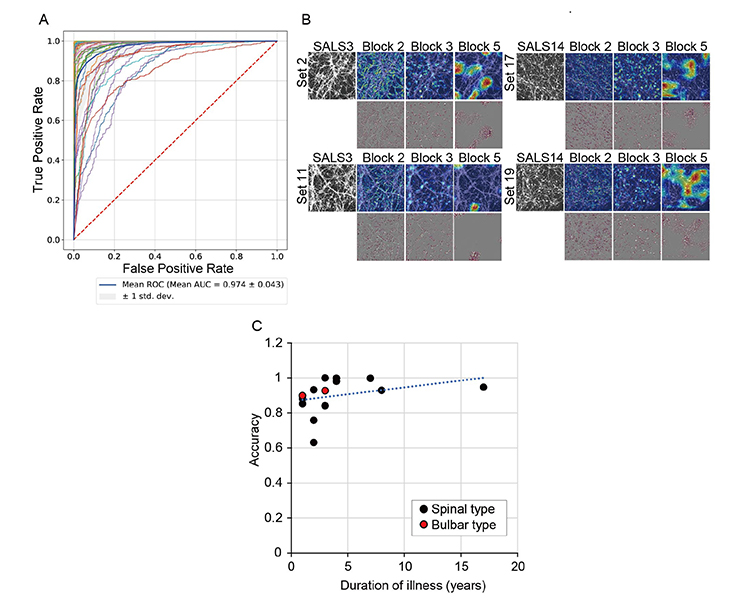
図2. ALS予測の精度
A. ALS予測能力についてAUC0.97注2)の高い精度を示した。
B. 人工知能が運動ニューロンの細胞体と神経突起に注目している様子。
C. 予測精度と患者さんの病気に罹病期間との関連。
4. まとめ
Deep LearningとiPS細胞由来運動ニューロンを用いた、ALSを予測する人工知能モデルを構築しました。本研究は新しいモデルの実証研究ですが、Deep learningはoverfitting注3)などのいくつかの解決すべき課題も残っており、今後、より多くの情報を拡充した研究が必要と考えられます。本研究成果は、今後の人工知能とiPS細胞のテクノロジー融合による疾患予測と克服に貢献することが期待されます。
5. 論文名と著者
- 論文名
Prediction Model of Amyotrophic Lateral Sclerosis by Deep Learning with Patient Induced Pluripotent Stem Cells - ジャーナル名
Annals of Neurology - 著者
Keiko Imamura1)2)3) #, Yuichiro Yada2)3) #, Yuishin Izumi4), Mitsuya Morita5), Akihiro Kawata6), Takayo Arisato7), Ayako Nagahashi1)2), Takako Enami1)2), Kayoko Tsukita2)3), Hideshi Kawakami8), Masanori Nakagawa9), Ryosuke Takahashi10), Haruhisa Inoue1)2)3)11)*
# Equal contribution, *Corresponding author - 著者の所属機関
- 理化学研究所 革新知能統合研究(AIP)センター
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所 バイオリソース研究センター(BRC)iPS創薬基盤開発チーム
- 徳島大学大学院医歯薬学研究部 臨床神経科学分野
- 自治医科大学 神経内科学
- 東京都立神経病院 神経内科
- 国立病院機構南九州病院 脳神経内科
- 広島大学原爆放射線医科学研究所 分子疫学
- 京都府立医科大学 神経内科
- 京都大学大学院医学研究科医学部 脳神経内科
- 京都大学医学部附属病院 先端医療研究開発機構(iACT)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 科研費(18K18452)
- Uehara Memorial Foundation
7. 用語説明
注1)筋萎縮性側索硬化症(ALS)
運動神経細胞が選択的に変性・消失していく原因不明の疾患。筋萎縮と筋力低下が主な症状で、進行すると上肢の機能障害、歩行障害、嚥下障害、呼吸障害などを生じる。病気を起こすメカニズムは詳しく知られておらず、まだ十分な治療法はない。約5%が家族性で、そのうちの約20%にSOD1遺伝子変異を伴う。その他、TDP-43遺伝子変異やC9orf72遺伝子内のくり返し配列の伸長などの遺伝要因が知られている。
注2)AUC(Area Under Curve)
人工知能の評価指標として用いられる。0から1までの値をとり、人工知能の能力が高いほど1に近づく。
注3)overfitting
訓練データに対しては学習できているが、未知のデータに対しては適合できていない状態。