2021-04-13 基礎生物学研究所,広島大学
基礎生物学研究所生殖細胞研究部門の吉田松生教授、広島大学大学院統合生命科学研究科 の中村隼明助教、英国ケンブリッジ大学のBenjamin D. Simons教授らからなる国際共同研究グループは、マウスの精子幹細胞を用いて、移植された幹細胞が組織を再生するプロセスの詳細を明らかにすると共に、幹細胞の運命を制御して組織再生の効率を飛躍的に向上させることに成功しました。
我々の体には、様々な細胞を作り出すおおもととなる「組織幹細胞」が存在し、その働きによって組織や臓器が維持されています。また、組織幹細胞を他の個体に移植すると組織を再生することができます。血液を作る造血幹細胞や皮膚の幹細胞の移植は、治療に応用されています。これまで、移植後の組織再生を指標として、組織幹細胞の数や能力を調べる研究が多く行われてきました。しかし、組織幹細胞がどのように振る舞うことで組織を再生するのか、謎に包まれていました。
本研究では精子幹細胞を持たない不妊マウスの精巣に、正常なマウスの精子幹細胞を移植し、それら一つ一つの運命を追跡する実験を行いました。得られた結果を数理モデルを用いて解析して、再生のプロセスを調べました。その結果、宿主の組織に生着した幹細胞の大部分が、細胞死を起こしたり、幹細胞を再生産せずに精子へと分化することで、短時間で組織から消えてしまうことを発見しました。確率的(ランダム)に生き残ったごく一部の組織幹細胞だけが、組織の再生を担っていたのです。これは、幹細胞の数は少ないけれど、一つ一つが効率良く組織を再生するという、従来の考え方とは大きく異なる結果です。この発見に基づいて、精子幹細胞を移植した後に、幹細胞の分化を阻害する薬剤を一時的に投与すると、再生に寄与する幹細胞の数が増え、最終的な再生の効率が飛躍的に向上しました。その結果、通常は姙性を回復できない少数の幹細胞を移植した宿主マウスに、自然交配で産仔を得られる正常な繁殖能を回復させることができました。
「移植された組織幹細胞は確率的な運命を辿り、その運命は制御することができる」という新しい概念は、他の組織幹細胞による組織再生の理解にも貢献すると期待されます。さらに、がん治療によって障害を受けた生殖機能を回復する治療や、希少な動物の遺伝資源の保全などに応用されることが期待されます。
本研究成果は,米国東部時間2021年4月12日午前11時(日本時間13日午前0時)にCell Stem Cell誌(電子版)に掲載されます。
【研究の背景】
多細胞動物の組織の多くは、「組織幹細胞」によって長期間安定的に維持されています。組織幹細胞は自分自身と同じ幹細胞を作る(自己複製と言います)と共に、分化細胞を生み出すことができます。また、組織幹細胞を移植することで、障害された組織の形態と機能を再生できることが知られています。血液を作り続ける造血幹細胞の移植 (骨髄移植) は、白血病の根治療法として確立されています。精子を作り続ける「精子幹細胞」の移植は、1994年にマウスで開発されました。その後、家畜やサルで成功例が報告されています。精子幹細胞の移植法は、不妊治療や動物遺伝資源の保全への応用が期待されています。
しかし、精子幹細胞移植の効率が現状では低いために、実用化への障壁となっています。また、組織幹細胞の活性を定量する指標として、移植した後の組織再生が広く用いられています。しかし、組織再生のプロセスにおいて、移植された組織幹細胞がどのように振舞うのかは、謎に包まれたままでした。このため、精子幹細胞の移植効率を改善する手がかりを得ることは困難でした (図1)。
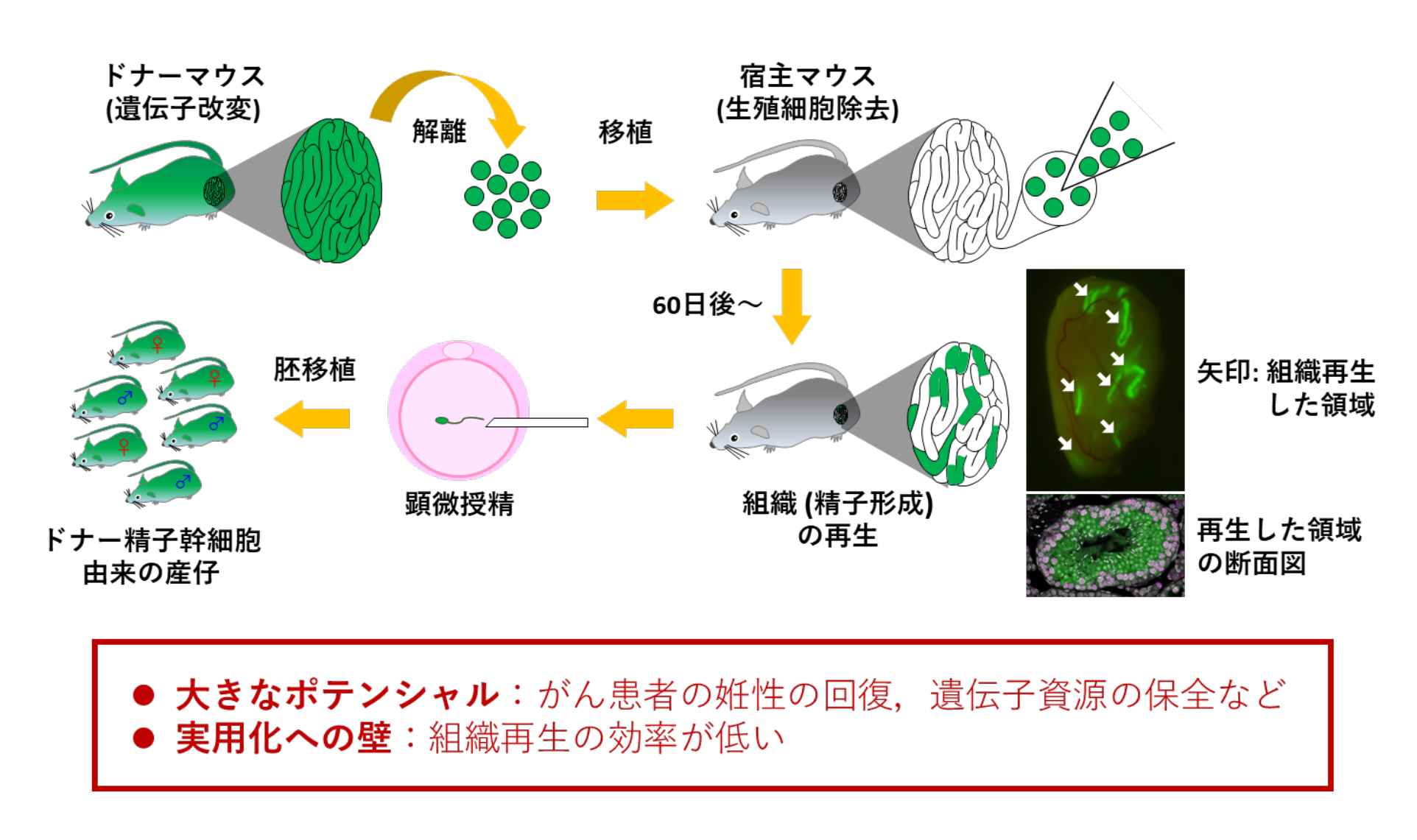
図1. 精子幹細胞の移植法の概要と現状
全身で緑色蛍光タンパク質(GFP)を発現するマウス (ドナー) の精巣の細胞を1つずつバラバラにして、薬剤によって生殖細胞を除去した不妊マウス (宿主) の精巣内へ移植します。移植60日後には、宿主の精巣内にドナー由来の幹細胞から組織再生した領域が観察されます (矢印で示す緑色の領域)。再生した領域から採取した精子を用いて顕微授精することで、ドナー幹細胞に由来する産仔が得られます。しかし、この実験条件では宿主が作る精子の数が少ないため、自然交配で産仔を得ることは困難でした。
【研究の成果】
本研究では、移植された精子幹細胞一つ一つの振る舞いを明らかにしました。さらにその運命を制御して最終的な移植効率を改善することに成功しました。
① 幹細胞の潜在能力を持つ細胞のごく一部だけが確率的に組織を再生する
精子幹細胞を緑色蛍光タンパク質 (GFP)で標識し、生殖細胞を除去する薬剤を投与して不妊となった宿主マウスに移植しました。その後、移植された精子幹細胞の運命を詳細に調べました。具体的には、移植後2~180日目まで、一つ一つの幹細胞が何個の幹細胞と何個の分化細胞を生み出したかを多数計測して、数理統計モデルを用いて解析しました。その結果、移植直後には多数の幹細胞が生着するものの、その後、自己複製、分化、細胞死を確率的 (ランダム) に起こすことがわかりました。その結果、当初生着した幹細胞の大部分が自己複製することなく消失し、最終的に再生に貢献した幹細胞は数十分の一に過ぎませんでした。これは、「精子幹細胞は特別な能力を持っていて、数は少ないけれど、一つ一つが効率良く組織を再生する」という従来の考え方とは大きく異なります (図2左、中)。
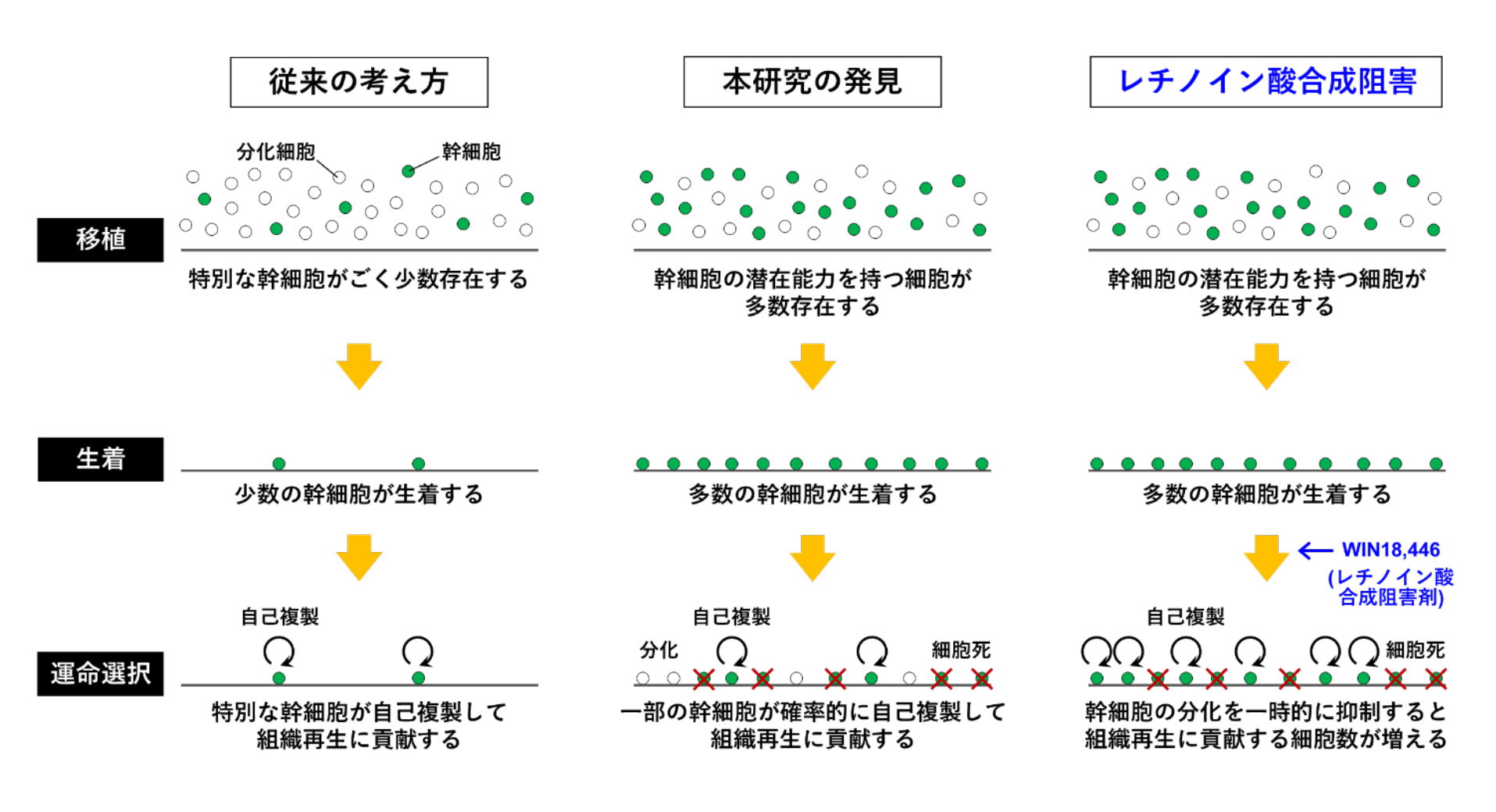
図2. 移植後の精子幹細胞の振る舞い
② 移植された幹細胞の運命を制御することができる
以上の発見から、移植された幹細胞の運命を操作できれば、再生の効率が向上するのではないかと考えました。そこで、幹細胞を移植した宿主マウスに、精子への分化を抑制する薬剤(レチノイン酸合成阻害剤 WIN18,446) を一時的に投与したところ,自己複製が促進されて再生に貢献する幹細胞の数が5~10倍増加しました (図2右)。さらに,従来の方法では姙性を回復できない条件(図1)でWIN18,446を投与すると,自然交配によって通常と変わらない数の産仔が得られました (図3)。
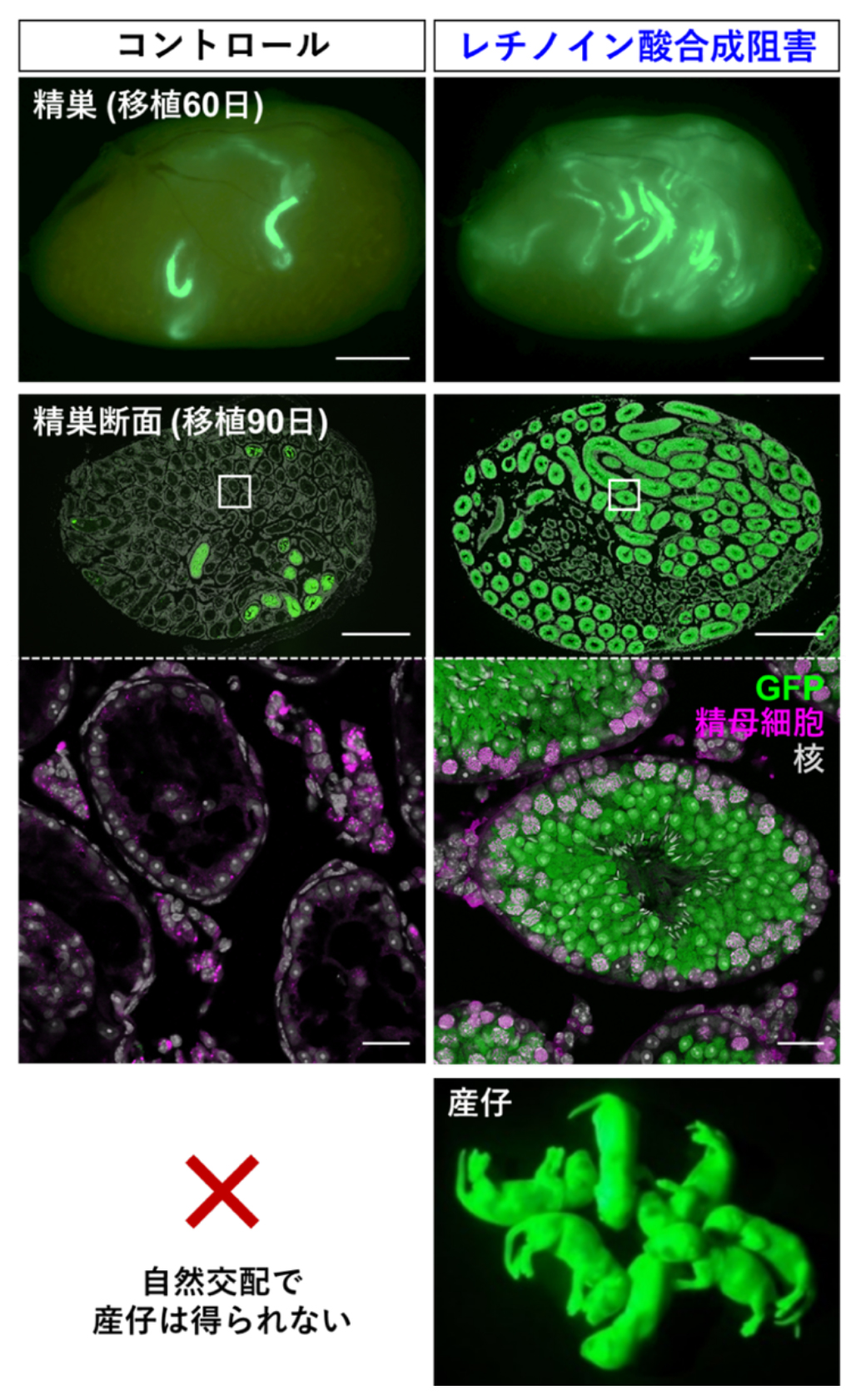
図3. 移植した精子幹細胞の運命を制御して組織再生の効率を向上させる方法
全身でGFPを発現するドナーマウスの精巣の細胞を不妊宿主マウスの精巣へ移植しました。この条件では、従来の方法では十分に精子形成が再生しないため、自然交配による姙性は回復できません(コントロール)。一方、宿主にWIN18,446を一時的に投与すると、移植60日後には精子形成を再生した領域が5~10倍増加しました。移植90日後には精巣の広い範囲で活発に精子が作られていました。さらに、自然交配によって健康な産仔が得られました。
【今後の展望】
本研究では、永く「ブラックボックス」となってきた、幹細胞が組織を再生するプロセスを、一細胞レベルで明らかにしました。今後、精子幹細胞研究の基盤となるとともに、他の組織幹細胞の研究にも影響を与えると期待されます。
また、精子幹細胞の移植効率を向上させる方法論を提示したことで、男性不妊治療や希少な動物の遺伝資源の保全などへの応用が期待されます。特に、思春期前に発症したがん患児の姙性を、治療後に回復することに貢献することが期待されます (図4)。
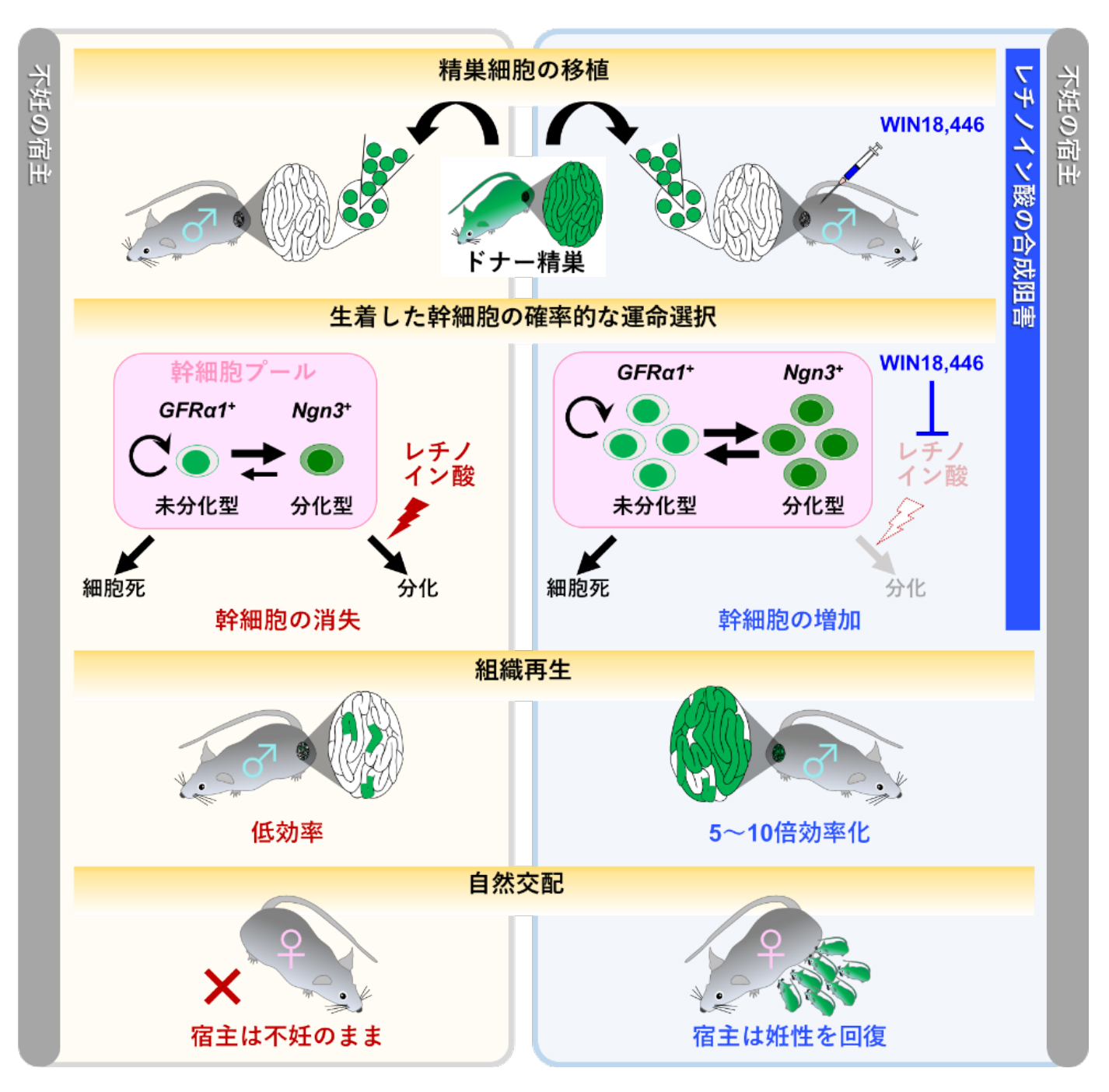
図4. 本研究のまとめ
【発表雑誌】
掲載誌: Cell Stem Cell (米国の幹細胞専門科学誌)
掲載日: 米国東部時間2021年4月12日午前11時(日本時間4月13日午前0時)
論文タイトル: Transient suppression of transplanted spermatogonial stem cell differentiation restores fertility in mice.
(和訳) 移植した精子幹細胞の一過的な分化抑制により不妊マウスの姙性が回復する
著者: Yoshiaki Nakamura (中村 隼明), David J. Jörg, Yayoi Kon (今 弥生), Benjamin D. Simons, Shosei Yoshida (吉田 松生)
DOI: https://doi.org/10.1016/j.stem.2021.03.016
【研究グループ】
基礎生物学研究所、広島大学、ケンブリッジ大学からなる研究グループによる研究成果。
【研究サポート】
本研究は,以下をはじめとする研究費の支援を受けて行われました。
文部科学省科学研究費補助事業(科研費)
· 新学術領域研究「配偶子産生」(課題名:マウス配偶子産生におけるGSCの制御機構の解明)
· 新学術領域研究「配偶子インテグリティの構築」(課題名:個体発生における生殖細胞集団のレパートリー動態の解明)
日本学術振興会科学研究費助成事業(科研費)
· 基盤研究A(課題名:分化する予定運命を転換して精子形成を再生する潜在的幹細胞の解析)
· 挑戦的萌芽研究(課題名:ドナー精子幹細胞の大量死メカニズムの解明による効率的移植技術の開発)
· 若手研究(B)(課題名:精細管内移植後におけるマウス精子形成幹細胞のホーミング機構の解明)
· 特別研究員奨励費(課題名:移植効率の向上を目指した精子幹細胞の宿主内ダイナミクスの解明)
日本医療研究開発機構(AMED)
· 再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)」国際共同研究(課題名:Harnessing spermatogonial stem cell flexibility to increase transplantation efficiency)
· 革新的先端研究開発支援事業(AMED-CREST)「機能低下」領域(課題名:精子形成を支える幹細胞のホメオスタシスと機能低下)
【研究に関するお問い合わせ先】
基礎生物学研究所 生殖細胞研究部門
教授 吉田 松生(ヨシダ ショウセイ)
広島大学 大学院統合生命科学研究科
助教 中村 隼明(ナカムラ ヨシアキ)
【報道担当】
基礎生物学研究所 広報室
広島大学 財務・総務室広報部 広報グループ