2021-08-19 生理学研究所
概要
山梨大学大学院総合研究部医学域薬理学講座 小泉修一教授の研究チームは、眼圧をコントロールする新しい分子を見いだしました。研究では、同薬理学講座の篠崎陽一准教授及び濱田健太郎さん(医学科5年)が中心的な役割を果たし、東京都医学総合研究所 原田高幸参事研究員、生理学研究所超微形態研究部門/自治医科大学解剖学講座 大野伸彦教授、山梨大学大学院総合研究部 総合分析実験センター 瀬川高弘講師、山梨大学大学院総合研究部眼科学講座 柏木賢治教授らが協力しました。研究チームは、マウスを使った実験によって「ATP[1]」とその「受容体[2]」であるP2Y1受容体の活性化が眼圧を低下させるために重要な役割を果たしていることを発見しました。P2Y1受容体を欠損させると、眼圧は慢性的に上昇して「緑内障[3]」に類似した症状が引き起こされました。今回の発見により、P2Y1受容体を活性化する薬剤が新たな緑内障治療薬の標的となり得る事、及び本受容体の異常が緑内障発症リスクを上昇させる原因の1つである可能性が示されました。本研究内容は、薬理学分野の最高峰雑誌である英国薬理学雑誌(British Journal of Pharmacology)に掲載されました。
背景
緑内障は、日本における中途失明原因第一位の疾患で世界的にも失明原因の高位の疾患です。日本の有病率は40歳以上で5%[4]と言われており、その割合は加齢に伴いさらに上昇します。緑内障の発症や進行の最大のリスク因子として、眼内の圧力が高い「高眼圧[5]」が知られています。この高眼圧が、眼内の神経細胞である「網膜神経節細胞(RGC)[6]」を傷害することで失明に至ると考えられています。従って緑内障の治療には、眼圧を低下させる点眼薬が主に使われています。既に複数の眼圧降下点眼薬が存在しますが、様々な副作用、単一の薬剤では効果が不十分な場合があること、薬剤の効果が徐々に減弱または消失する事がある、などの問題から、新たな眼圧降下作用を持つ薬剤の開発が喫緊の課題となっています。
眼圧は、「眼房水[7]」と呼ばれる眼内の体液の産生と排出が精密にバランスを取る事で正常な状態が保たれています。様々な要因によって、このバランスが崩れると、眼圧値が異常になります。従って、様々な眼圧降下薬が緑内障治療薬として用いられていますが、上述のような理由から、新たな治療薬候補が活発に探索されています。研究チームは、緑内障患者の眼房水に含まれる細胞外ATP量やその分解が異常になっている点に着目し、細胞外ATP受容体が新たな緑内障治療の標的となりうるのではないか、と仮説を立てました。
研究成果
研究チームは様々な薬剤の検討を行った結果、正常なマウス(野生型マウス)においてP2Y1受容体を選択的に活性化させるMRS2365を点眼すると眼圧が低下する事を発見しました(図1)。次に、P2Y1受容体が発現する部位を調べたところ、眼房水の産生及び排出に関わる組織の両方に発現する事が分かりました(図2)。眼房水の産生に関わる部位である毛様体突起では、表層の無色素上皮にP2Y1受容体が発現しており、同じ領域に水の移動に関わる「アクアポリン4[8]」が発現していました。P2Y1受容体活性化がアクアポリン4を抑制し、結果として眼房水の産生を減少させることで眼圧が低下することが解りました (図3)。一方、眼房水の排出に関わる部位である線維柱帯では、P2Y1受容体は「内皮型一酸化窒素合成酵素(eNOS)[9]」と同じ位置に存在していました(図2C)。P2Y1受容体がeNOSを活性化して排出系の組織を緩め、眼房水の排出効率を上昇させることで眼圧が低下することが解りました。つまり、P2Y1受容体は眼房水の産生低下及び排出促進の両方を制御することで、強力に眼圧を低下させる作用があることが解りました。
研究チームは、このようなP2Y1受容体の生理的な機能が損なわれることが、緑内障発症の大きな病因である、と仮説を立てて更に検証しました。P2Y1受容体を持たないマウス(P2Y1KOマウス)の安静時の眼圧を計測したところ、3(若年期), 6(青年期)及び12ヵ月齢(中年期)のいずれの月齢においても正常なマウスに比べて顕著に眼圧が高い事が分かりました(図4)。上述の通り、高眼圧は主要な緑内障リスクであるため、3ヶ月齢のP2Y1KOマウスのRGC脱落を評価しました。3ヶ月齢では、既に眼圧は高いものの、RGC数は正常なマウスと同等で、RGCは傷害されていないと考えられました。一方、12ヶ月齢では、RGC数は顕著に減少し、RGCを含む神経線維層が菲薄化し、さらに視覚機能が低下するなど、緑内障の症状に類似した症状を示しました(図5)。つまり、P2Y1受容体機能低下と加齢により、緑内障が発症することが明らかとなりました。
本研究は、文部科学省の科学研究費助成事業・学術変革領域研究(A)「グリアデコーディング」(研究代表者:小泉修一)、基盤研究(A)「網膜グリア細胞による眼の生理機能及び病態制御機構の解明」(小泉修一)、国立研究開発法人科学技術振興機構(JST)-戦略的創造研究推進事業(CREST)「非標識神経伝達物質イメージセンサによる可視化システム構築と脳機能の時空間解析」(分担研究者:小泉修一)、新学術領域・学術研究支援基盤形成「先端バイオイメージング支援プラットフォーム」(被支援者:篠崎陽一、支援者:大野伸彦)、挑戦的萌芽研究、基盤研究(C)、基盤研究(B)、高齢者眼疾患研究財団、三菱財団、公益財団法人武田科学振興財団及び山梨大学先端脳‐免疫研究助成による支援を受けて行われました。
今後の期待
今回の結果より、P2Y1受容体が眼房水の産生抑制にも排出促進にも関係し、眼圧を強力に低下させる作用があることが明らかとなりました。従って全く新しく、有望な緑内障治療薬として、P2Y1受容体を効果的に活性化する、または発現を上昇させる薬剤の開発が期待されます。
図および説明
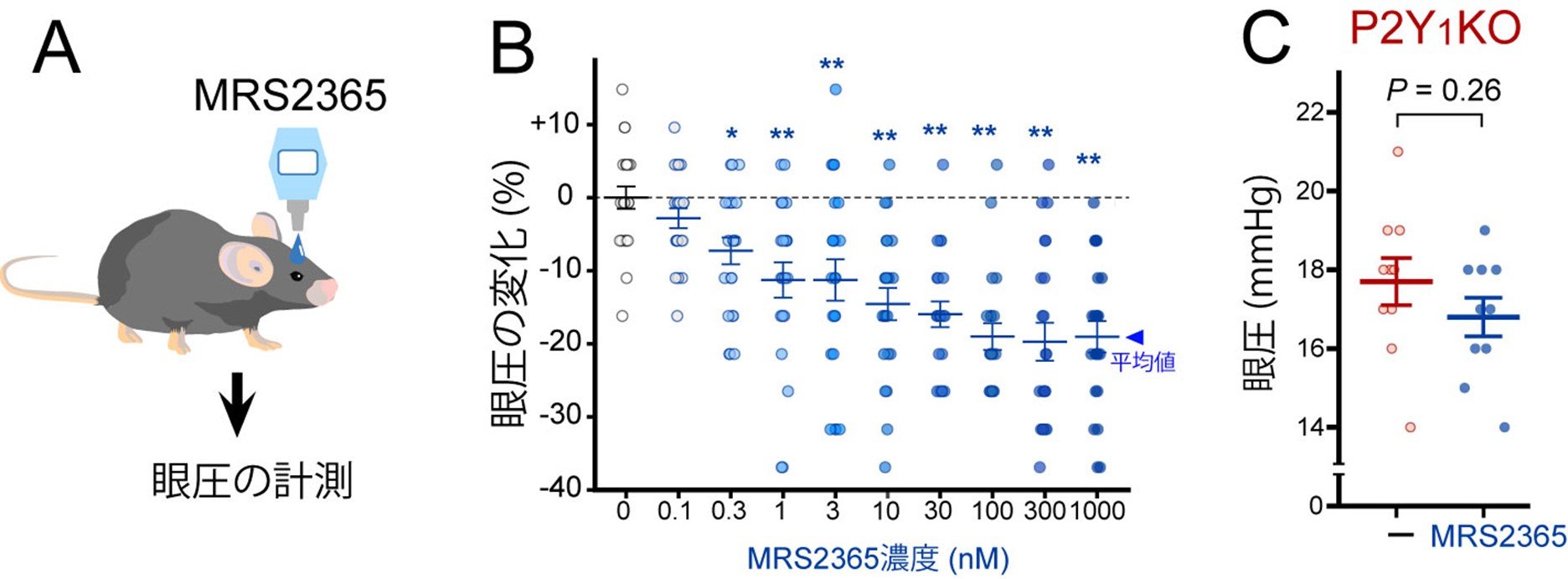
図1. MRS2365の点眼により眼圧が低下する
(A)各種薬剤を点眼し、眼圧の変化を検討したところP2Y1受容体を活性化するMRS2365が眼圧を低下させる事を発見しました。(B)様々な濃度のMRS2365を点眼してその効果を比較したところ、眼圧が最も大きく低下する濃度は300ナノモーラー(nM)でした。(C)P2Y1KOマウスに対してMRS2365を点眼しても顕著な眼圧降下作用はありませんでした。
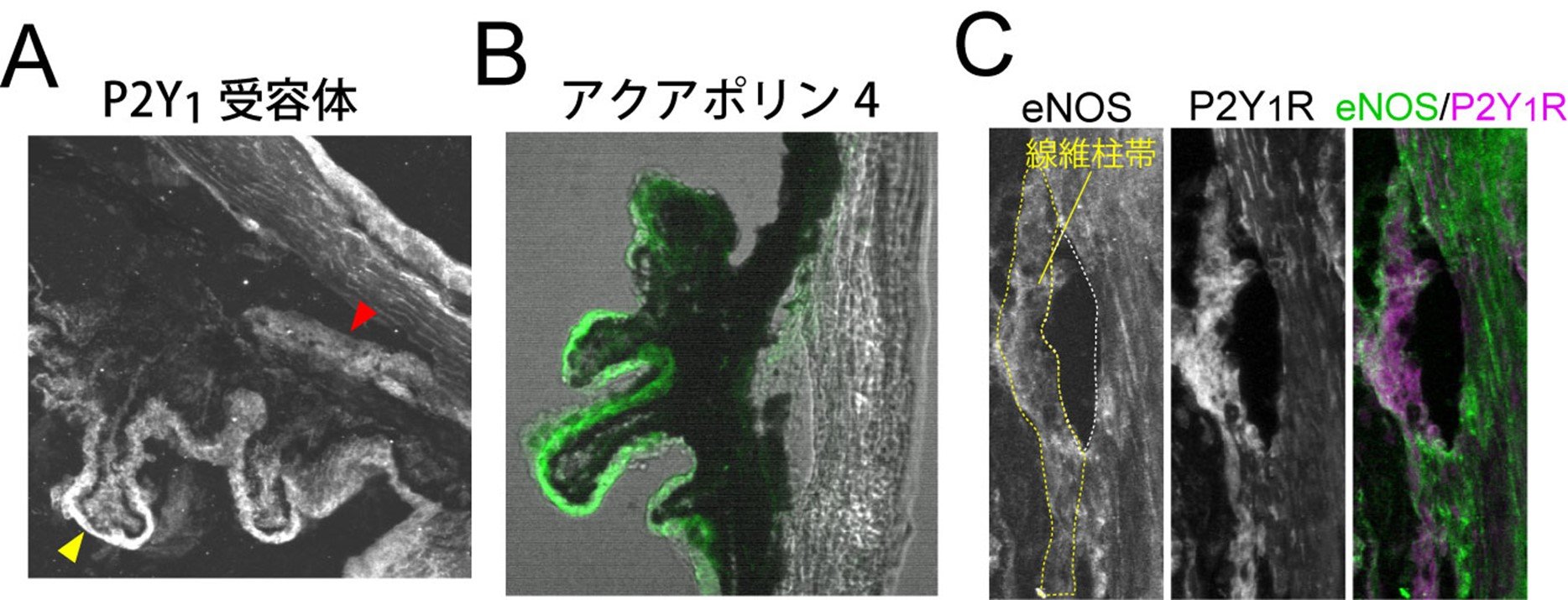
図2. P2Y1受容体の発現部位
(A) P2Y1受容体が眼のどの部位に発現するかを検討したところ、眼房水の産生に関わる毛様体突起(黄色矢印)と眼房水の排出に関わる線維柱帯(赤色矢印)に発現する事が分かりました。(B)毛様体突起のP2Y1受容体が発現する表層には、水を透過して眼房水の産生に関わるアクアポリン4が発現していました。(C)線維柱帯では内皮型一酸化窒素合成酵素(eNOS)が発現していました。
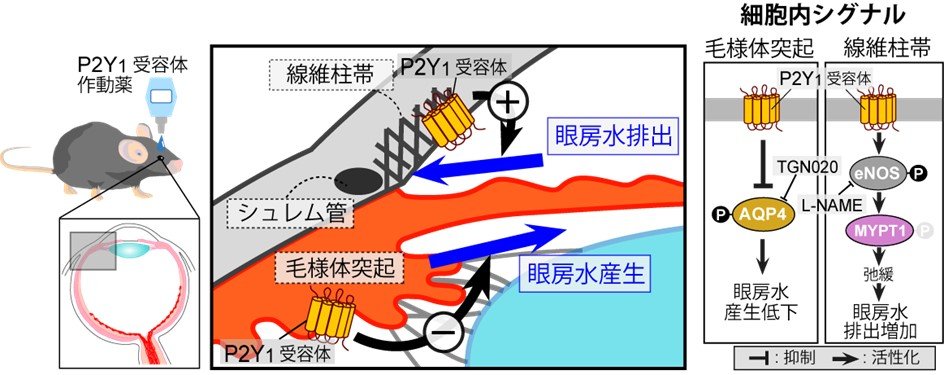
図3. 眼房水産生・排出系におけるP2Y1受容体と下流シグナルの概要
毛様体突起ではP2Y1受容体活性化はアクアポリン4(AQP4)を抑制して眼房水産生を低下させると考えられました。一方、線維柱帯ではP2Y1受容体活性化はeNOSを活性化して眼房水の排出を促進すると考えられました。
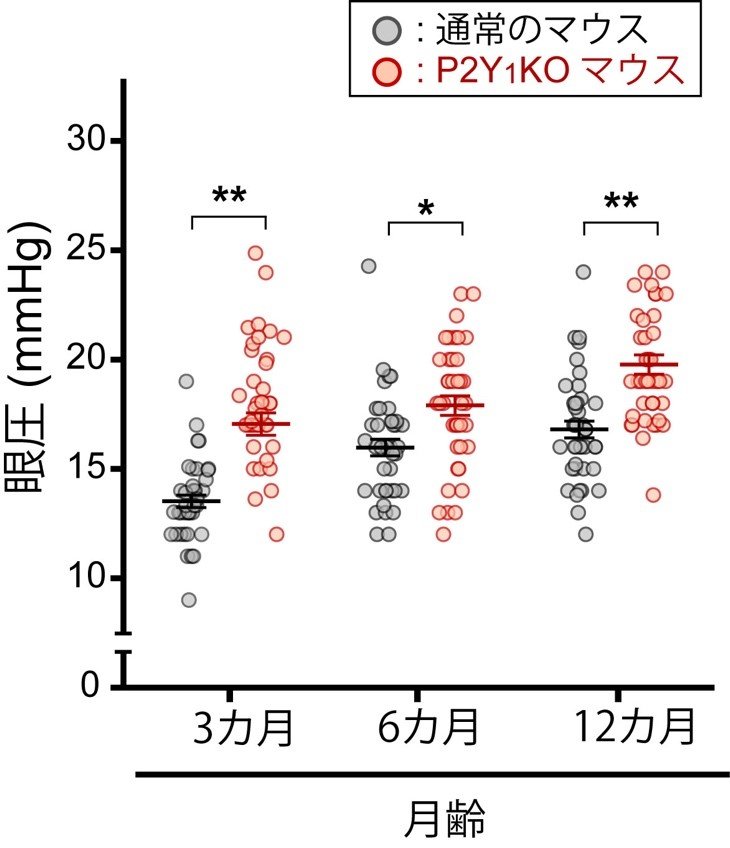
図4. P2Y1KOマウスは慢性的に眼圧が高い。
P2Y1KOマウスは通常のマウスに比べて3, 6, 12カ月齢のいずれの月齢でも眼圧が高い状態にある事が分かりました。
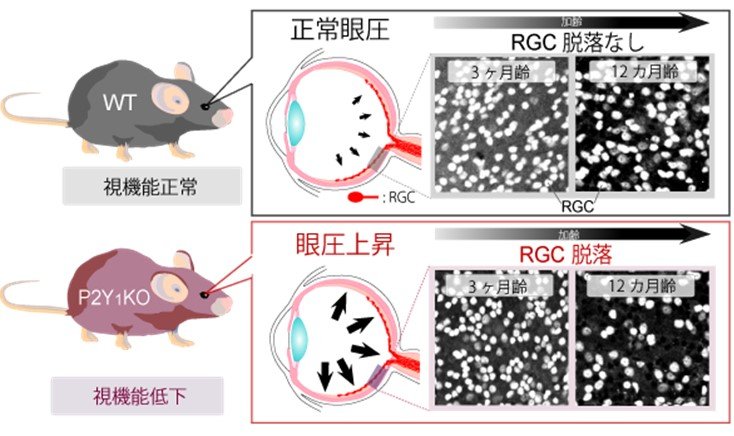
図5. P2Y1KOマウスが示す症状のまとめ。
P2Y1KOマウスは若齢期から高眼圧の症状を示しますが、RGCの脱落は若齢期では示しませんでした。RGCの脱落は中年齢で見られ、この時視覚機能も低下しました。マウスの12カ月齢はヒトの40歳程度に相当するため、本マウスで見られるゆっくりとした変化はヒトの症状をよく反映していると考えられました。
用語説明
[1] 細胞外ATP
アデノシン三リン酸(ATP)は、細胞のエネルギーの元となる分子で、細胞内に高濃度で存在します。このATPは様々な生理的な刺激や傷害などによって細胞外へと放出または漏出し、細胞と細胞のコミュニケーションを担う伝達物質としての役割も果たしています。細胞外ATPはP2受容体と呼ばれる特別な受容体(用語説明[2]参照)に結合する事によって情報を伝えます。P2受容体には幾つもの種類が存在し、P2Y1受容体もその1つです。
[2] 受容体
細胞表面や細胞内部に存在し、細胞内外の特定の物質と結合することによって細胞内に情報を伝えるタンパク質の総称です。
[3] 緑内障
緑内障は、網膜神経節細胞(RGC)と呼ばれる眼の神経細胞の傷害により、視野が次第に欠損していく進行性の病気です。一度失った視野は現在の医学では回復する事は非常に難しいため、早期発見と進行の抑制が主な治療戦略になっています。眼圧上昇が最もよく知られたリスク因子の1つですが、遺伝的要因や環境因子など、様々な要因が複雑に絡み合う多因子疾患であると考えられています。
[4] 有病率は40歳以上で5%
平成12年~13年に行われた日本緑内障学会多治見緑内障疫学調査(通称:多治見スタディ)による調査結果。それまで日本において緑内障の有病率を国際的に認められるレベルで科学的に算出された報告はありませんでした。本調査によって日本における緑内障の各年代における有病率が初めて明らかとなりました。
[5] 眼圧
眼圧は眼房水の産生及び排出のバランスによって眼内に生じる圧力の事です。眼圧が上昇すると網膜の神経細胞への機械的な負荷が増加し、それによって傷害されると考えられます。
[6] 網膜神経節細胞 (RGC)
網膜で受容した視覚情報を脳へ伝達する網膜を構成する主な神経細胞です。緑内障では、RGCが優先的に傷害される事が知られています。
[7] 眼房水
眼房水は眼の中を循環する液体で、眼に栄養分などを送ったり、眼から老廃物を排出するなどの役割を担っています。眼房水の産生や排出は常に起こっていますが、そのバランスが崩れると眼圧に異常が生じます。
[8] アクアポリン4
細胞膜に存在するタンパク質で、水を透過するチャネルと呼ばれる構造形成するアクアポリンの1種。目では、毛様体突起の無色素上皮などに強く発現し、眼房水産生に伴う水の輸送に非常に重要な役割を果たす事が分かっています。
[9] 内皮型一酸化窒素合成酵素(eNOS)
一酸化窒素の合成を行う酵素(NOS)の1つです。NOSには1~3のアイソザイムと呼ばれる似たメンバーが存在し、NOS3が内皮型と呼ばれており、内皮細胞に多く存在する事からこのように呼ばれます。線維柱帯における一酸化窒素産生は細胞の弛緩を引き起こして眼房水を排出しやすくし、これにより眼圧が低下すると考えられています。
本研究は、英国科学雑誌『British Journal of Pharmacology』に掲載されるのに先立ち、7月26日にオンライン版に掲載されました。
(掲載URL:https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bph.15637 )
*研究チーム
山梨大学大学院総合研究部 医学域 基礎医学系 薬理学講座/GLIAセンター チーム
教授 小泉 修一 (責任著者)
准教授 篠崎 陽一 (共同筆頭著者)
学部生 濱田 健太郎 (共同筆頭著者)
(公財)東京都医学総合研究所 視覚病態プロジェクトチーム
参事研究員 原田 高幸
副参事研究員 行方 和彦
生理学研究所 超微形態研究部門/自治医科大学 医学部 組織学部門チーム
教授 大野 伸彦
研究員 松本 真実
山梨大学大学院 総合研究部 医学域 臨床医学系 眼科学講座チーム
教授 柏木 賢治
山梨大学大学院 総合研究部 総合分析実験センターチーム
講師 瀬川 高弘
論文情報
Loss of P2Y1 receptor triggers glaucoma-like pathology in mice
#Kentaro Hamada, #Youichi Shinozaki, Kazuhiko Namekata, Mami Matsumoto, Nobuhiko Ohno, Takahiro Segawa, Kenji Kashiwagi, Takayuki Harada, *Schuichi Koizumi #共同筆頭著者、*責任著者
British Journal of Pharmacology 2021年7月26日にオンラインにて先行掲載
本件に関する問い合わせ先
<研究について>
国立大学法人山梨大学 医学部
薬理学講座 教授 小泉 修一(コイズミ シュウイチ)
公益財団法人東京都医学総合研究所 視覚病態プロジェクトチーム
参事研究員 原田 高幸(ハラダ タカユキ)
大学共同利用機関法人自然科学研究機構 生理学研究所 超微形態部門/
自治医科大学 医学部 組織学部門チーム
教授 大野 伸彦(オオノ ノブヒコ)
<広報に関すること>
国立大学法人山梨大学 総務部総務課広報企画室
公益財団法人東京都医学総合研究所 事務局 研究推進課
大学共同利用機関法人自然科学研究機構 生理学研究所 研究力強化戦略室
学校法人自治医科大学 大学事務部研究支援課