2021-08-20 東海大学,日本医療研究開発機構
概要
ヒト多能性幹細胞(iPS/ES細胞)は体を構成するほぼ全ての細胞に試験管内で分化することが可能で、多様性が報告されています。ヒトの多様性の中でも性差は主たる要因であり、その違いは遺伝子レベルで明らかになりつつあります。性染色体における遺伝子発現量で、性差の影響を少なくするために、ヒトでは、女性の2つあるX染色体の一方を抑制するエピゲノム機構(X染色体不活化)が備わっています。しかし、女性由来多能性幹細胞は通常の培養によって不可逆的なX染色体不活化の破綻が必ず発生することが報告されています。今回、東海大学の福田篤講師と米国ハーバード大学Kevin Eggan教授等の共同研究グループは、De novo DNAメチル化酵素であるDNMT3AおよびDNMT3Bが女性由来多能性幹細胞のX染色体不活化の破綻に必須であることを明らかにしました。本研究成果は、米国科学雑誌「Stem Cell Reports」に2021年8月19日(米国東部時刻:午前11時)に公開されました。
研究背景
ヒト多能性幹細胞は、試験管内で多様性を表現することが可能であり、再生医療だけでなく、創薬スクリーニング、ヒト発生学の研究に最適なツールとして多くの活用法があります。ヒトにおける性差は、多様性を考慮するうえで重要な要因となります。生殖細胞を除く女性の正常細胞では、2つあるX染色体の1つの働きを抑制し、1つしか持たない男性のX染色体との遺伝子量補正を行っています。この女性由来細胞特有の機構は、X染色体不活化と呼ばれ、エピジェネティックに制御(注1)されています。しかし、女性由来多能性幹細胞では、通常の培養条件下においてX染色体不活化の不可逆的な破綻が報告されており、長らくその原因が不明のままでした。
発見の内容
女性由来多能性幹細胞では、Large non-coding RNA XIST遺伝子(注2)の発現からX染色体不活化の破綻が開始されることが示唆されています。そこで、研究グループは、X染色体不活化の開始・維持に必須であるXIST遺伝子の発現制御機構に着目し、以下の事柄を発見しました。
- XIST遺伝子のプロモーター領域(注3)におけるDNAメチル化(注4)状態が、XIST遺伝子の発現状態と負に相関し、DNAメチル化阻害剤によりXIST遺伝子が再活性化する。
- 新規DNAメチル化酵素であるDNMT3A及びDNMT3Bの両遺伝子がXIST遺伝子の抑制に関与する。
- ひとたびXIST遺伝子が抑制された女性由来多能性幹細胞株では、DNMT3A/3Bに非依存的にDNAメチル化と発現抑制が維持される。
- CRISPR activationシステム(注5)によるXIST遺伝子の再活性化は、XIST遺伝子が散在することで、X染色体不活化の再誘導が出来ない。
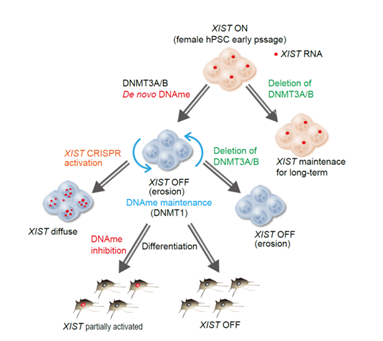
図 研究結果の概略:DNMT3A/3BによるXISTの遺伝子の抑制がX染色体不活化破綻を引き起こす
今後の展望
これまでに女性由来多能性幹細胞は、不可逆的なX染色体不活化の破綻が原因で研究ツールとしての活用性が疑問視されていました。このX染色体不活化の破綻の結果、X連鎖性の女性特異的な疾患に対する病態モデリングは失敗することが多く、その代替として男性由来の細胞株に対しゲノム編集によるisogenic株(注6)の作製が常用されています。つまり、X染色体不活化破綻は、遺伝的背景に基づき表現型を解析することが可能な疾患iPS細胞の活用に著しい不利益を与えることが示されています。本研究結果から、De novo DNAメチル化がXIST遺伝子を制御することが明らかとなりました。今後は、一過性にDe novo DNAメチル化酵素の働きを弱めることやXIST遺伝子の再活性化法などを新たに開発することで女性由来多能性幹細胞株の活用の幅が広がることが期待されます。
本研究への支援
本研究は国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワーク 幹細胞・再生医学イノベーション創出プログラム「ヒト多能性幹細胞を用いた転写/エピゲノム多様性・性差に基づく神経細胞分化能の制御機構解明と予測モデルの構築(代表:福田篤)」などの支援により行われました。
用語解析
- (注1)エピジェネティックな制御
- DNA配列の変化は伴わず、DNAやヒストンの修飾状態を化学的に変化させることで、遺伝子の発現を制御する後天的な機構。
- (注2)非コード長鎖RNA XIST(Large non-coding RNA XIST)
- X染色体に存在するタンパク質をつくらないRNA分子。RNA分子の長さが約22Kbある、巨大なRNA分子である。女性由来細胞のみで発現が確認され、X染色体不活化の開始と維持に必須な役割を担う。
- (注3)プロモーター領域
- 遺伝子の発現制御を行う領域。転写開始点の近傍に位置する。
- (注4)DNAメチル化
- DNAのC(シトシン)塩基がメチル化される。DNAメチル化はエピジェネティック機構の1つであり、遺伝子発現制御に深く関わっている。
- (注5)CRISPR activationシステム
- DNA切断活性を持たないDead Cas9を用いることで、特定の遺伝子を人為的に活性化させる方法。
- (注6)Isogenic株
- 同じ遺伝的背景を持つ細胞株。上記の場合、変異を持つ疾患iPS細胞と同様の変異を別の多能性幹細胞株に導入した株であり、変異箇所における遺伝的背景を同じにする。
掲載誌情報
- 雑誌名
- Stem Cell Reports
- タイトル
- The de novo DNA methyltransferases DNMT3A and DNMT3B are essential for XIST silencing for erosion of dosage compensation in human pluripotent stem cells.
- 著者
- Atsushi Fukuda(共責任著者), Dane Z. Hazelbaker, Nami Motosugi, Jin Hao, Francesco Limone Amanda Beccard, Patrizia Mazzucato, Angelica Messana, Chisa Okada, Irune Guerra San Juan, Menglu Qian, Akihiro Umezawa, Hidenori Akutsu, Lindy E. Barrett, Kevin Eggan(共責任著者)
- DOI
- 10.1016/j.stemcr.2021.07.015
お問い合わせ先
研究に関して
福田 篤(ふくだ あつし)
東海大学医学部医学科基礎医学系分子生命科学
報道等その他に関して
東海大学メディカルサイエンスカレッジオフィス(研究支援担当)
AMED事業に関すること
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課