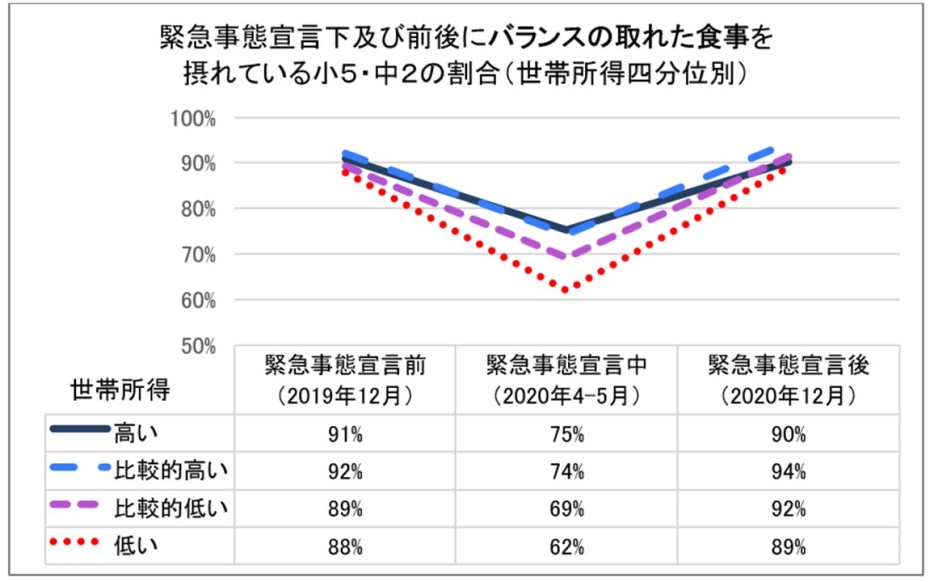
難治性食道がんを克服する新たな治療開発に期待
2021-08-24 国立がん研究センター
放射線治療と抗がん剤投与を同時に行う化学放射線療法は食道がんの有効な治療法のひとつですが、治療後に再発することがあります。がんゲノム(がん細胞のDNAに含まれる遺伝情報)異常が治療抵抗性(注1)の一因と考えられていますが、その詳細は解明されていません。九州大学の三森功士 教授、石神康生 教授、平川雅和 准教授、平田秀成 医員(現・国立がん研究センター東病院)、東京大学医科学研究所ゲノム医科学分野の柴田龍弘 教授(国立がん研究センター兼務)、新井田厚司 講師、国立がん研究センター東病院の秋元哲夫 副院長らの研究グループは、化学放射線療法の効果が低く再発しやすい難治性食道がんのゲノム異常の特徴や、再発に至るがんゲノムの進化(注2)の過程を明らかにしました。
食道がん患者33名より化学放射線療法前に得た腫瘍と、このうち5名の再発腫瘍から次世代シークエンサー(注3)を用いた包括的ゲノムデータを取得し、スーパーコンピュータを用いた数理統計解析を行いました。その結果、治療前にMYC遺伝子のコピー数(注4)が増加している食道がんでは治療効果が低いことがわかりました。公共のがん細胞株データベースにおいても、食道がんのMYCコピー数増加は放射線治療抵抗性と相関していました。さらに再発腫瘍のゲノムを時空間解析した結果、がんの進展に重要な役割を果たすドライバー遺伝子異常(MYCコピー数増加など)を持つがん細胞は治療後も生き残り再発の源になること、再発時に新たに獲得するドライバー遺伝子異常は少数であること、がんゲノムの進化に治療が与える影響も明らかとなりました。
今回の成果は治療抵抗性の理解を深め、がんゲノム情報に基づく化学放射線療法の個別化医療・精密医療の開発や、難治性食道がんの新たな治療開発につながると期待されます。
本研究成果は、2021年8月20日午前10時(日本時間)に米国科学雑誌「Cancer Research」で公開されました。
(参考図)化学放射線療法後に再発する難治性食道がんのゲノム進化
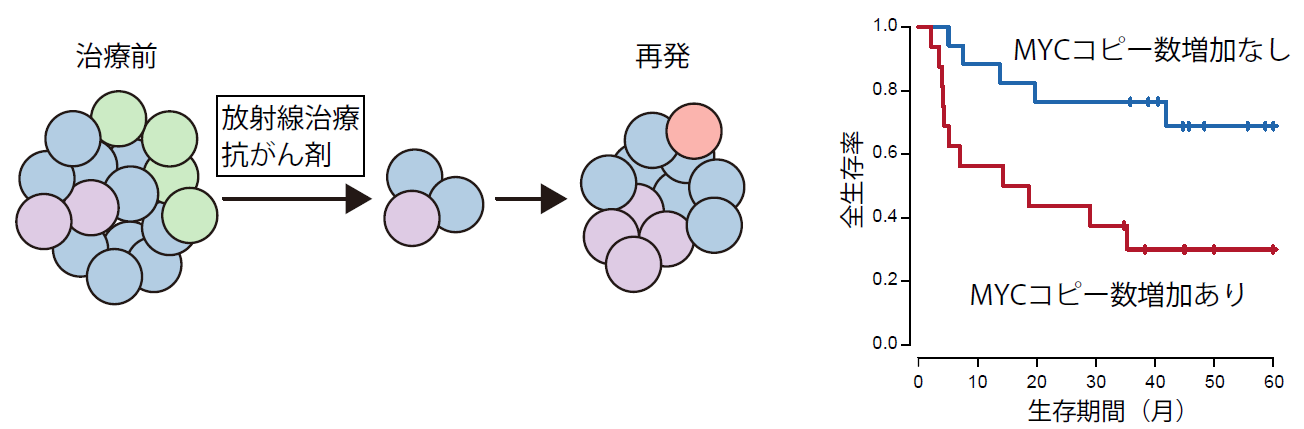
左図:がんは単一の細胞に由来する疾患ですが、進行とともにゲノムの多様性が増加し、不均一な細胞集団となります。このような不均一性を生むがんゲノムの進化は、治療抵抗性の一因とされます。治療後に一旦縮小しても、ドライバー遺伝子異常を持つ細胞が生き残り、再び増殖し、やがて再発します。
右図:ドライバー遺伝子異常のうち、MYC遺伝子のコピー数が増加している食道がんは、化学放射線療法後に再発・増悪しやすく、治療後の生存率が低いことが明らかになりました。
研究者からひとこと
食道がんをはじめ多くのがんで、化学放射線療法後に再発する原因はよくわかっていません。今回、そのメカニズムの一端が明らかになりました。がん細胞はしたたかに治療による過酷な環境に適応しながら進化し、生き残った細胞が再発の原因となります。本研究が難治がんの克服に少しでも役立てば幸いです。
用語解説
(注1)治療抵抗性
がんに対する放射線治療や抗がん剤治療が無効であったり、効果が低下したりする状態。治療が最初から効かない場合や、初めは有効でがんが見つからないほど縮小した後に効かなくなる場合もあります。
(注2)がんゲノムの進化
がんは単一の細胞に由来する疾患であり、進展する時間的変化の中で様々なゲノム異常を蓄積しながら空間的な多様性を獲得し、不均一な細胞集団となります。がんの不均一性が形成される過程で、周囲の環境に適合し増殖・生存に有利なゲノム異常を持つがん細胞が選択されたり(自然選択を受けるダーウィン進化)、がん細胞の増殖・生存に影響を与えないゲノム異常が蓄積したりします(中立進化)。このようながんの不均一性を生む「がんゲノムの進化」は、治療抵抗性を生む一因と考えられています。詳細は九州大学 2018年7月24日プレスリリース「大腸がんの腫瘍内多様性の獲得原理を説明する新たな進化モデルを構築」をご参照ください。Saito et al. Nature Communications 2018. doi:10.1038/s41467-018-05226-0.
(注3)次世代シークエンサー
DNAの塩基配列を短期間で大量に解読する装置であり、生命科学に革新をもたらしました。本研究では食道がんゲノムのうち、機能的に重要なエクソン領域の塩基配列を包括的に解読することにより、がん細胞特有の遺伝子変異(DNA塩基配列の置換・挿入・欠失)やコピー数異常を調べました。
(注4)コピー数異常
私たちの体を形作る細胞のDNAが折り畳まれ格納されている染色体は、父親由来1本・母親由来1本の合計2本ずつ(2コピー)あります。がん細胞では、染色体の特定の領域が3コピー以上に増加したり、抜けて落ちて0~1コピーに減少したりすることがあり、コピー数異常と呼ばれます。がん細胞の増殖や生存に直接的な役割を担うドライバー遺伝子であるMYC遺伝子を含む領域は、食道がんをはじめ多くのがんでコピー数が増加することが知られています。
論文情報
掲載誌
Cancer Research
タイトル
The Evolving Genomic Landscape of Esophageal Squamous Cell Carcinoma Under Chemoradiotherapy
著者名
Hidenari Hirata, Atsushi Niida, Nobuyuki Kakiuchi, Ryutaro Uchi, Keishi Sugimachi,Takaaki Masuda, Tomoko Saito, Shun-Ichiro Kageyama, Yushi Motomura, Shuhei Ito, Tadamasa Yoshitake, Daisuke Tsurumaru, Yusuke Nishimuta, Akira Yokoyama, Takanori Hasegawa, Kenichi Chiba, Yuichi Shiraishi, Junyan Du, Fumihito Miura, Masaru Morita, Yasushi Toh, Masakazu Hirakawa, Yoshiyuki Shioyama, Takashi Ito, Tetsuo Akimoto, Satoru Miyano, Tatsuhiro Shibata, Masaki Mori, Yutaka Suzuki, Seishi Ogawa, Kousei Ishigami, and Koshi Mimori
DOI
10.1158/0008-5472.CAN-21-0653
謝辞
本研究は、JSPS科研費(JP16K10397、JP18K15323、JP19K08123、JP19K17202、JP19H03715、JP19K09220、JP20H05039、JP20K08960、JP26861003)、国立研究開発法人日本医療研究開発機構(JP20cm0106475h0001、JP20ck0106547h0001、JP20ck0106541h0001)、高松宮妃癌研究基金研究助成金、武田科学振興財団特定研究助成、福岡県すこやか健康事業団がん研究助成金の助成を受けて行われました。
お問合せ先
研究に関するお問合せ
九州大学病院 別府病院 教授 三森 功士
報道に関するお問合せ
九州大学広報室
東京大学医科学研究所 国際学術連携室(広報)
国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)