2021-12-10 東京大学
木下 慶美(研究当時:生物科学専攻 特任研究員/ 現:名古屋大学 研究員)
上村 想太郎(生物科学専攻 教授)
発表のポイント
- RNAヘリカーゼ(注1) Vasa(注2) が働く様子を1分子可視化し、切断されたRNAを引きはがす際に、Vasaがオリゴマー化(注3) して機能すること、またその過程は不均一であることを明らかにしました。
- 今までVasaが1分子レベルで働く様子が可視化されたことはなく、ヘリカーゼ活性の仕組みの一端を明らかにしました。
- Vasaの機能の詳細を明らかにしたことで、RNAヘリカーゼ全般の機能解明が進み、RNAサイレンシング(注4) の制御の実現が期待されます。
発表概要
RNAヘリカーゼは、アデノシン三リン酸(ATP)(注5) 加水分解エネルギーを利用して二本鎖RNAを引きはがす酵素であり、主にRNAの代謝、転写、翻訳、mRNAスプライシング(注6) などに関与しています。特定のヘリカーゼのN末端およびC末端には、ゆらぎが大きい領域が含まれていることが知られていますが、この領域が、どのようにRNAの引きはがしや解離に寄与しているのかは、明らかにされてきませんでした。
東京大学大学院理学系研究科の木下慶美特任研究員(研究当時)、上村想太郎教授らのグループは、カイコ由来のpiRNAサイレンシング複合体であるpiRISCから切断されたトランスポゾンRNA(注7) がVasaによって解離する様子を1分子蛍光イメージング法(注8) によって可視化することに成功し、ピンポン経路と呼ばれるpiRNAの増幅過程にVasaがどのように関与しているかを直接調べました。
その結果、Vasaのオリゴマー化が必要であること、また、Vasaが不均一な経路において切断されたRNAの解離を促進していることを見出しました。さらに機能解明が進めば、RNAサイレンシングの仕組みが明らかとなり、将来的にはRNAの発現を制御できるようになることが期待されます。
発表内容
RNAヘリカーゼは、転写、翻訳、mRNAスプライシングなど、RNA代謝のあらゆる過程に関与しています。これらのRNAヘリカーゼは、ATPの加水分解エネルギーを利用して、二本鎖RNAを引きはがす酵素です。一方で、特定のRNAヘリカーゼのN末端には同一のRNAヘリカーゼと静電的に相互作用するためのゆらぎが大きな領域があり、この領域の相互作用によって、細胞質内で液滴が形成されると考えられていました。これらはN末端部分の領域がRNAヘリカーゼのオリゴマー化を引き起こすことを示していますが、実際にこの領域のヘリカーゼ活性への貢献がどのようなものなのかはわかっていませんでした。
本研究では、RNAヘリカーゼであるカイコ由来のVasaのN末端領域の機能に着目しました。Vasaは、piRNAの代謝過程において、piRNAサイレンシング複合体(piRISC)から切断されたトランスポゾンRNAを引きはがす機能を持ちます。この切断反応は、生殖細胞に特異的に生成されたノンコーディングRNAであるpiRNA(PIWI-interacting RNA)と、アルゴノートサブファミリー(AGOおよび PIWI タンパク質)のPIWI(P-element induced wimpy testis)タンパク質の1つであるSiwi(Silkworm Piwi)によってpiRISCが形成されることによって起こります。さらに、生殖細胞は、トランスポゾンRNAを効率的に切断するために、ピンポン経路と呼ばれるユニークなpiRNA増幅機構を持っています。
VasaがpiRISCを介して切断RNAの解離を引き起こすダイナミックな変化は、ピンポン経路に直接影響を及ぼしていますが、VasaがpiRISCと相互作用して切断型RNAの解離を引き起こすメカニズムはわかっていませんでした。
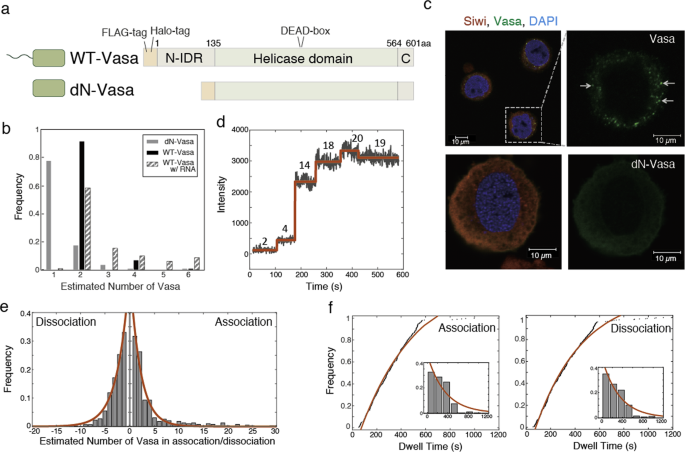
本研究では、1分子蛍光イメージング法を用いて、VasaがpiRISCと相互作用する様子をリアルタイムに可視化し、Vasaのオリゴマー化がピンポン経路にどのように関与しているかを評価しました。まず、TMR(緑)とATTO647N(赤)と呼ばれる蛍光色素でVasaとトランスポゾンRNAをそれぞれ標識し、両者の挙動を同時に測定しました(図1)。

図1:Siwi存在下で、RNA(赤)がオリゴマー化したVasa(緑)と共局在を示す一方 (左図)、N末端領域を欠損したVasaはRNAと局在しない(右図)。
その結果、VasaはN末端領域でオリゴマー化することで、Siwi-piRISC存在下でRNAと共局在することがわかりました。VasaがSiwi-piRISCを介してRNAと複合体を形成する1分子系の構築に初めて成功しました。
次に共局在を示したVasaとRNAが、時間の経過とともにどのように解離するのかを調べました。その結果、VasaとRNAが同じタイミングで解離したパターン、RNAの解離とは別のタイミングでVasaが部分的に解離したパターン、さらにRNAは解離せずVasaが部分的に解離したパターン、の3つの異なる解離パターンが観察されました(図2)。

図2:3パターンの蛍光標識Vasa(緑)と蛍光標識RNA(赤)の1分子同時観察の時間変化。 (左図)VasaとRNAが同じタイミングで解離したパターン。(中央図)RNAの解離とは別のタイミングでVasaが部分的に解離したパターン。(右図)RNAは解離せず、Vasaが部分的に解離したパターン。
これらの実験結果によってVasaがピンポン経路に関与する新しいモデルを考案し(図3)、Vasaは不均一な経路で切断されたRNAの解離を引き起こし、さらにはVasaのオリゴマー化がこれらのプロセスに必要であることを明らかにしました。

図3:新しい不均一経路をもつピンポンサイクル。左上の青色のSiwi-piRISCに緑色のVasaのオリゴマーが結合したのち、以下の3つの解離過程が進行する。(i)オリゴマーVasaが、5‘末端の切断されたRNAと共に解離する (ii)オリゴマーVasaが、3’末端の切断されたRNAと共に解離する (iii)オリゴマーのVasaが、安定した状態で結合する。その後、切断されたRNAはAgo3へ移行し、再びSiwi-piRISCが形成される。
本研究の結果は、オリゴマー化したVasaが解離するタイミングの調整と不均一性が、ピンポン経路全体的での解離をバランスよく制御していることを示唆しています。本研究ではRNAサイレンシングの仕組みの一部を分子レベルで解明することができました。さらなる分子レベルでの機能解析が進めば、将来的には医療、創薬分野に応用されることが期待されます。
本研究は、科学技術振興機構(JST)、CREST(研究代表者:上村想太郎、研究分担者:塩見美喜子)などの支援を受けて行われました。
発表雑誌
- 雑誌名
Communications Biology論文タイトル
Heterogeneous dissociation process of truncated RNAs by oligomerized Vasa helicase著者
Yoshimi Kinoshita, Ryo Murakami, Nao Muto, Shintaroh Kubo, Ryo Iizuka and Sotaro Uemura*DOI番号
10.1038/s42003-021-02918-0
用語解説
注1 RNAヘリカーゼ
RNAの2次構造やRNA二重鎖をほどく活性をもつタンパク質の総称。
注2 Vasa
生殖細胞特異的に発現するRNAヘリカーゼ。昆虫からヒトまで共通の生殖細胞分化メカニズムやトランスポゾンRNAのサイレンシングに関与していると考えられている。
注3 オリゴマー化
比較的少数(数個程度)の単量体が結合した重合体を形成すること。オリゴマーに対してポリマーは非常に多数(数100個以上)の単量体が結合した状態を指す。
注4 RNAサイレンシング
20~30塩基長の小分子RNA(small RNA)を介して,それと相補的な配列領域をもつ遺伝子の発現が抑制される現象。
注5 アデノシン三リン酸(ATP)
アデノシンのリボースに3分子のリン酸が結合し、2個の高エネルギーリン酸結合を持つヌクレオチド。
注6 mRNAスプライシング
タンパク質生合成において、転写で合成された一次転写産物からイントロンが除去されエクソンが結合する過程。
注7 トランスポゾンRNA
ゲノム中を自由に転移する能力をもつ外来由来のDNAが転写されたRNAの総称。トランスポゾンRNAが発現することによって、細胞の重要な機能が破壊されることがある。
注8 1分子蛍光イメージング法
蛍光分子で標識した生体分子を1分子ごとに追跡する技術。生体分子の運動や構造変化、機能の理解に役立つ。