2022-04-07 京都大学 iPS細胞研究所
ポイント
- ヒトiPS細胞から作製した膵島様細胞を糖尿病モデルマウスに移植したところ、半年以上の観察期間中において、血糖値は正常値を維持し、異常な細胞増殖は観察されなかった。
- 単一細胞レベルで比較し、大量の膵島様細胞を移植した際に混入する可能性のある細胞を洗い出した。
- 目的外細胞の混入を簡便かつ高感度に検出することに成功し、新規の機序による除去法を示した。
- 糖尿病の移植治療で想定される膵島様細胞の大量製造において、目的外細胞を除去し、安全性を高めることに役立つと期待される。
1. 要旨
糖尿病の根治的な治療法として、ES細胞やiPS細胞などのヒト多能性幹細胞から作製した膵島様細胞の移植が期待されています。人工的に細胞を作製すると目的外の細胞が混入する可能性があります。特に大量の細胞移植が必要となる臨床応用にむけて、安全性の観点から可能な限り混入を低減することが望まれますが、混入する細胞は非常に稀な細胞集団であるため、解析が困難で不明な点が多いという課題があります。
日吉秀行 主任研究員(武田薬品工業株式会社T-CiRAディスカバリー)、佐久間健介 主任研究員(前職:武田薬品工業株式会社T-CiRAディスカバリー、現職: オリヅルセラピューティクス株式会社)、山添則子 主任研究員(前職:武田薬品工業株式会社T-CiRAディスカバリー、現職: オリヅルセラピューティクス株式会社)および豊田太郎 講師(CiRA増殖分化機構研究部門 現 未来生命科学開拓部門、T-CiRA)らの研究グループは、 ヒトiPS細胞由来の膵島様細胞の遺伝子発現を単一細胞レベルで解析することで、製造過程で混入の可能性がある目的外細胞の特徴を同定し、高感度に検出する方法を見出しました。また、目的外細胞の除去方法として、細胞増殖に関わるPLK分子の阻害や、解糖系の阻害といった新規の方法が有効であることを示しました。これらの知見は、移植治療のためのヒトiPS細胞由来膵島様細胞の大量製造において、既存の方法と組み合わせて目的外細胞を除去し、安全性を高めることに役立つと期待されます。
この研究成果は、2022年3月18日(英国時間)に英国科学誌「Scientific Reports」にオンライン公開されました。
2. 研究の背景
膵島の移植は糖尿病に対する根治療法の一つですが、移植用膵島の不足が問題となっています。そのため、膵島に代わりヒト多能性幹細胞(ES細胞およびiPS細胞)から作製する膵島様細胞を移植することが期待されています。培養皿上で膵島様細胞を作製する研究は近年大きな進捗があり、発生過程を模倣した段階的な分化誘導により幼若期の膵島様細胞を作製することが可能となっています。また、これを移植することで1型糖尿病モデルマウスを治療できることが示されています。しかしながら、各段階の分化誘導の効率は100%ではないため、目的外の細胞が副産物として混入する可能性があり、それらが望まない作用をする懸念があります。人工的に作製された膵島様細胞の性質は多く報告されていますが、安全性の観点で重要となる目的外細胞の性質は、報告が少なく不明な点が多くあります。
そこで本研究グループは、ヒトiPS細胞由来膵島様細胞の臨床応用に向けて、ヒトiPS細胞から膵島様細胞(iPSC-derived pancreatic islet cells, iPIC)を作製し、単一細胞レベルで遺伝子発現解析することで、目的外細胞の特徴について精査し、新規の検出法や除去法の構築を試みました。
3. 研究結果
1) 皮下に移植したiPICは長期間薬効と形態を維持する
他グループから報告された既知の方法でヒトiPS細胞からiPICを作製したところ、膵内分泌細胞の割合が低かったため、独自の改良を加えることで膵内分泌細胞(α細胞およびβ細胞)の割合を高めたiPICを作製しました(図1A)。これをストレプトゾトシン投与によって糖尿病を誘発した免疫不全マウスの皮下に移植したところ、糖尿病状態の指標である高血糖が正常化され、その状態が半年以上維持されました(図1B)。9カ月後に移植部位を観察したところ、移植時とほぼ同じ大きさのiPIC由来組織が観察されました(図1C)。 その内部ではほぼ全てのヒト細胞が膵島様の細胞凝集塊の形状を維持していました。興味深いことに、移植前は少なく散在していたα細胞(図1A中GCG)は移植後に割合が増加し、α細胞が辺縁部(図1D、E中GCG)に、β細胞が内部(図1D、E中INS)にあるという典型的なマウス膵島の構造をしていました(図1E)。これらの結果から、3-4×106個のiPIC中には、目的外の非内分泌細胞がほとんど含まれていないと考えられました。
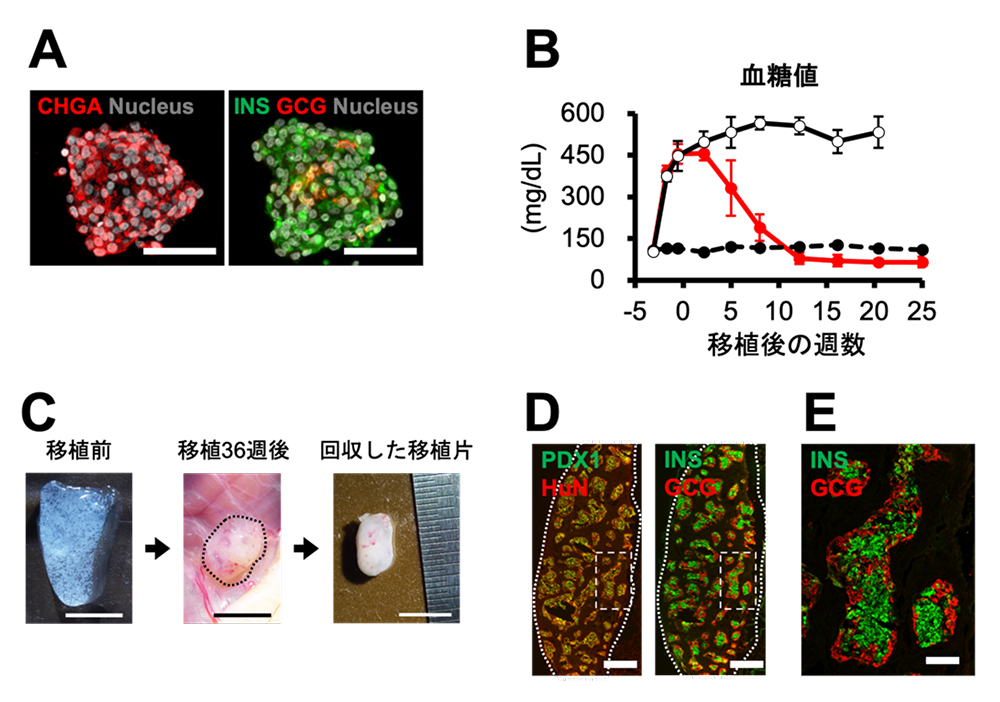
図1 ヒトiPS細胞から作製した膵島様細胞(iPIC)
(A)移植前のiPICの染色像。CHGA、INSおよびGCGは膵内分泌細胞の位置を示す。スケールバー 50 µm。
(B)糖尿病モデルマウスの皮下へ移植した後の飽食時血糖値の推移。赤線はiPICを移植したマウス、黒破線は非糖尿病のマウス、黒実線は糖尿病モデルマウスを示す。
(C、D、E)移植9カ月後の移植部位の外観(C)と染色像(D、E)、Dの拡大図(E)。スケールバー 5 mm(C)、500 µm(D)、100 µm(E)。
2) 非内分泌細胞の解析に基づいて増殖性目的外細胞の混入を定量PCRによって検出可能とした
マウスの糖尿病は3-4×106個の細胞移植で治療できますが、糖尿病患者さんへの膵島移植では1×108個以上の細胞を複数回移植します。臨床で使用される細胞数が非常に多いため、安全性の観点から、どのような目的外細胞種が混入する可能性があるかを把握することは重要です。混入しうる目的外細胞には作製途中の細胞や、別の細胞種になったものなどがあると考えられます。そこで、iPICの作製途中の細胞や、作製に必要な刺激を一部欠けた状態で作製した細胞を比較対照として、混入可能性のある細胞種を洗い出すことにしました。様々な条件でiPICを作製し、それぞれ約3000個について、細胞1つずつの網羅的な遺伝子発現を比較することで、非内分泌細胞の細胞分画4種類を同定することができました(図2A)。そのうち1種類は内分泌細胞への遷移途中の細胞と考えられたため、残りの3種類の集団に注目しました。RCAという解析によってこれらの細胞分画と類似性のある遺伝子発現をする細胞種を調べたところ、2つは肝臓や腸管と性質が近いことがわかりました。残りの1つは、増殖中の細胞で内分泌細胞も含む不均一な集団でした(図2B)。前者2つの特徴的な遺伝子としてFGBやAGR2の発現が高いことが明らかとなりました。そこで、これらの遺伝子を指標に、様々な条件で作製したiPICを比較したところ、フローサイトメトリーでは検出されない差を検出することができました(図2C、D)。
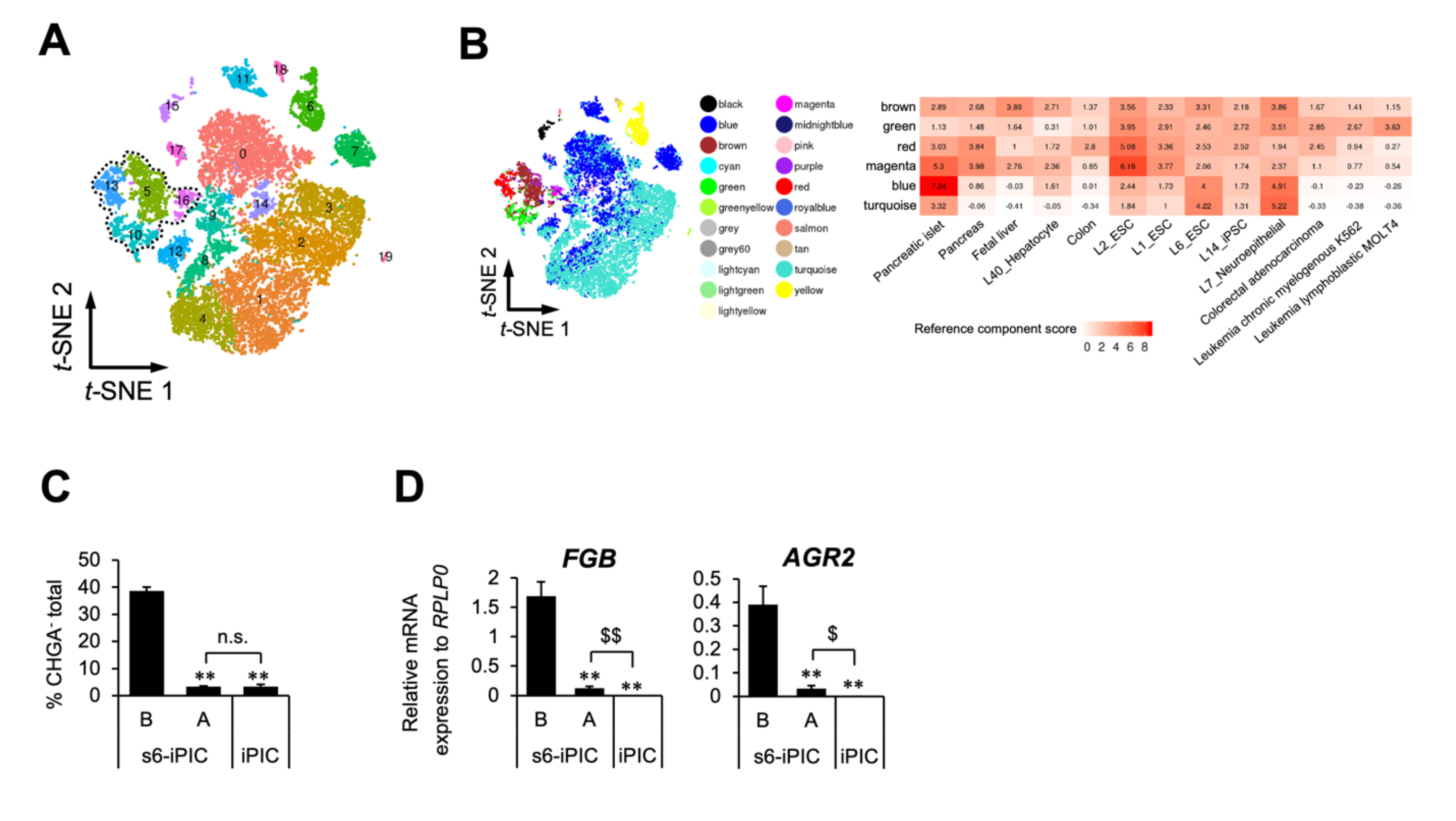
図2 単一細胞ごとの遺伝子発現解析による目的外細胞の同定と検出
(A)3種類のiPICとヒト膵島の単一細胞ごとの遺伝子発現プロファイルをもとにそれぞれの細胞の類似性を2次元的に表現した図。破線で囲われた領域が非内分泌細胞集団。
(B)RCAという解析による類似細胞のスコア。
(C)フローサイトメトリーによって評価した3種類のiPICにおける非内分泌細胞の割合。
(D)目的外細胞の指標FGB、AGR2遺伝子の定量PCRによる3種類のiPIC評価。フローサイトメトリーでは検出されなかった差が示された。** p < 0.01 vs s6-iPIC B、$< 0.05, $$< 0.01、n.s. 有意差無し
3) 新規の目的外細胞の除去方法を見出した
次に、目的外細胞を新しい機序で除去しようと試みました。目的外細胞は増殖性が高いことから、細胞周期に関わるタンパク質、中でも抗がん剤の標的としても開発が進められているPLKに注目しました。目的外細胞を多く含むiPIC集団に対してPLK阻害剤で処理すると、内分泌細胞(CHGA+)の細胞数は維持されたまま、目的外細胞(CHGA-)が優先的に除去されました(図3B)。また、別のアプローチとして目的外細胞のどの群においても発現が高い上位10個の遺伝子に含まれるものとして、解糖系酵素をコードする遺伝子LDHBに着目しました。目的外細胞では解糖系への依存度が高いという仮説を立て、代謝されないグルコースのアナログである2-デオキシグルコース(2-DG)が有効であるか検討しました。目的外細胞が多いiPICに対して2-DGで処理すると、内分泌細胞の細胞数もやや減りましたが、目的外細胞が優先的に除去されました(図3C)。これらの結果から、PLK阻害剤処理や解糖系の阻害は、目的外細胞除去に有効な新しい方法であることが分かりました。
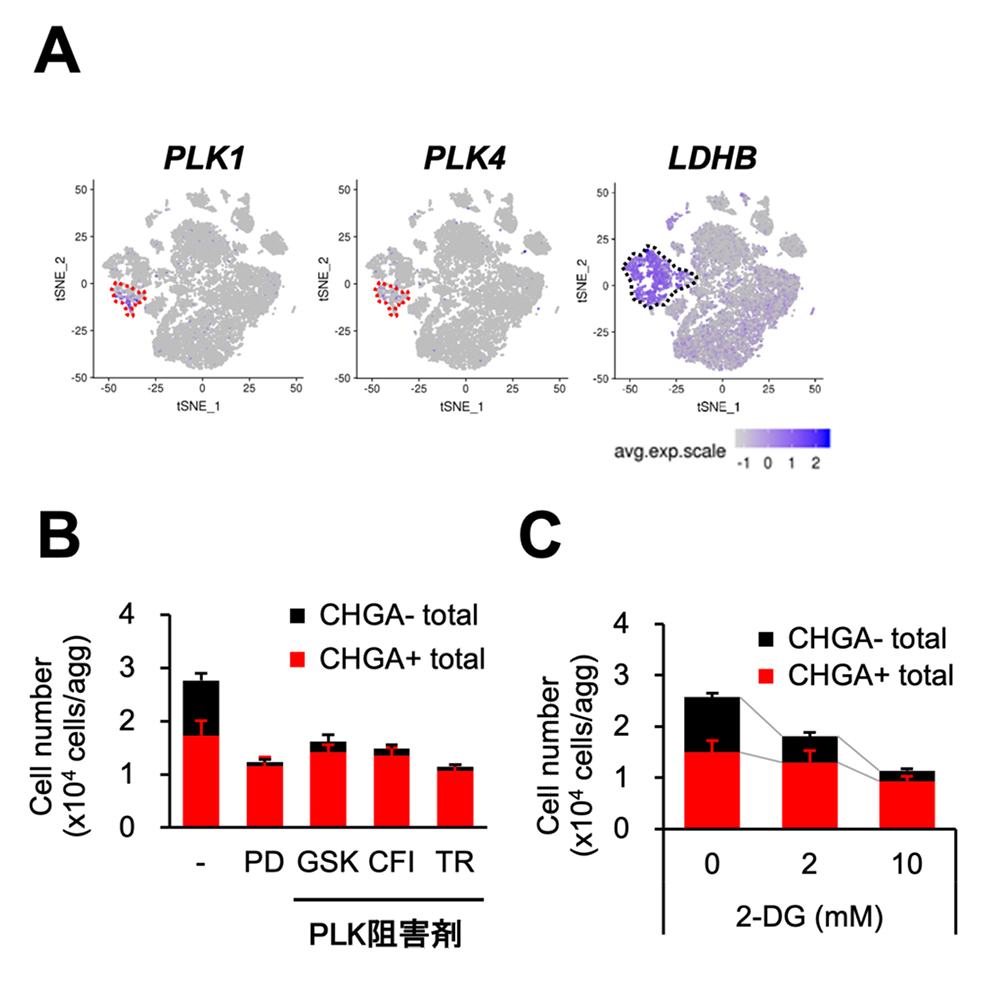
図3 PLKおよび解糖系の阻害は目的外細胞を優先的に除去する
(A)PLK1、PLK4、LDHB遺伝子は増殖中細胞や目的外細胞で高発現する。青色が強いと遺伝子発現が高いことを示す。
(B、C)目的外細胞が多いiPICに対してPLK阻害剤(B)や解糖系阻害剤
(C)フローサイトメトリーによって評価した3種類のiPICにおける非内分泌細胞の割合。
(C)で処理し、非内分泌細胞、内分泌細胞の数を評価した。
4. まとめ
本研究では、ヒトiPS細胞から分化誘導によって膵島様細胞を作製する際に、混入する非内分泌細胞に注目し、単一細胞の遺伝子発現解析から得られた知見を検証しました。その結果、非内分泌細胞はヘテロな増殖中の細胞と膵系譜の細胞を除くと、肝臓や腸の性質を持った遺伝子発現をする細胞であることが分かりました。また、それらはFGBやAGR2遺伝子を指標として検出可能であることを示しました。さらに、目的外細胞を除去する方法として、PLKや解糖系の阻害剤での処理が有効であることを新たに見出しました。 現在の膵島移植では大量の細胞(>1×108細胞)が移植されていることを考慮すると、本研究で得られた知見は、移植治療のためのヒト多能性幹細胞から膵島様細胞を製造する工程において、既存の方法と組み合わせて目的外細胞を除去することで安全性を高めることに役立つと期待されます。
5. 論文名と著者
- 論文名
Characterization and reduction of non-endocrine cells accompanying islet-like endocrine cells differentiated from human iPSC - ジャーナル名
Scientific Reports - 著者
Hideyuki Hiyoshi1,3,#, Kensuke Sakuma1,3,4,#, Noriko Tsubooka-Yamazoe1,3,4,#, Shinya Asano5, Taisuke Mochida1,3, Junji Yamaura3,6, Shuhei Konagaya2,3,4, Ryo Fujii5, Hirokazu Matsumoto1,3, Ryo Ito1,3,4 and Taro Toyoda2,3 - 著者の所属機関
- 武田薬品工業株式会社 T-CiRAディスカバリー
- 京都大学 iPS細胞研究所(CiRA)増殖分化機構研究部門
- タケダ-CiRA 共同研究プログラム(T-CiRA)
- オリヅルセラピューティクス株式会社
- Axcelead Drug Discovery Partners株式会社
- 武田薬品工業株式会社 ファーマシューティカル・サイエンス
6. 本研究への支援
本研究成果は、CiRAと武田薬品工業株式会社との共同研究プログラム「T-CiRA」によるものです。