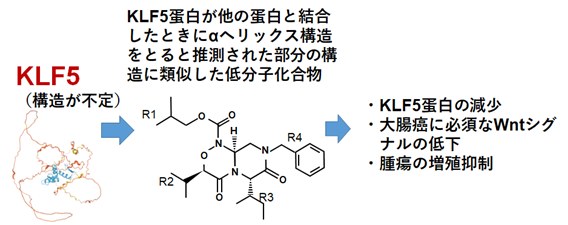
多発性硬化症の新規治療薬開発へ期待
2022-04-06 東京医科歯科大学,日本医療研究開発機構
研究成果のポイント
- 研究グループがこれまでに独自に開発した核酸医薬である「DNA/RNAヘテロ2本鎖核酸 (HDO)」を用い、従来困難であった非侵襲性投与ルート(全身投与)からの活性化ミクログリア・中枢神経浸潤マクロファージの内在性遺伝子制御を達成しました。
- ヘテロ核酸には、従来のアンチセンス核酸※1とは異なる特有の送達機構がある事を示しました。
- 多発性硬化症動物モデルである実験的自己免疫性脳脊髄炎(EAE)マウス※2に、CD40※3遺伝子を標的としたヘテロ核酸を全身投与し、表現型の改善を認めました。
- ヘテロ核酸は多発性硬化症の新規治療法を開拓する医薬技術として期待できます。
概要
東京医科歯科大学大学院 医歯学総合研究科 脳神経病態学分野 (脳神経内科)の横田隆徳教授、永田哲也プロジェクト准教授、大谷木正貴大学院生(当時)、西李依子大学院生は、従来のアンチセンス核酸とは異なる送達機構を有するヘテロ核酸を用い、非侵襲性投与ルート(全身投与)から多発性硬化症動物モデルであるEAEマウスの活性化ミクログリア・中枢神経浸潤マクロファージの内在性遺伝子発現の抑制と表現型の改善に成功しました。この研究は日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業における研究課題「第3世代ヘテロ核酸の開発」、先端的バイオ創薬等基盤技術開発事業における研究課題「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的分子標的治療とブレインイメージング」(いずれも研究代表者:横田 隆徳)などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Molecular Therapy (モレキュラー セラピー)に、2022年2月18日にオンライン版で発表されました。
研究背景
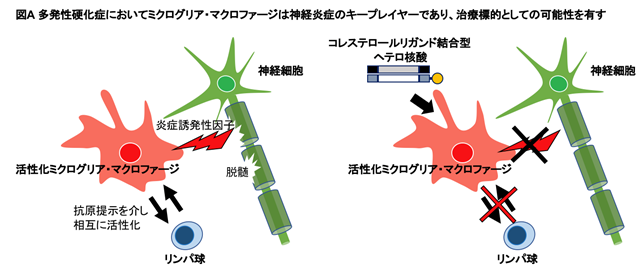
多発性硬化症では、リンパ球だけでなく活性化したミクログリアも、リンパ球やマクロファージなどの免疫細胞の中枢神経系への動員を促し神経炎症に加担します。そして、ミクログリアと中枢神経浸潤マクロファージは、リンパ球への抗原提示、炎症性サイトカイン・フリーラジカルなどの産生を介し、髄鞘の破壊(脱髄)を引き起こします(図A左)。ゲノム解析の進展により、ミクログリア・マクロファージの多発性硬化症における治療標的としての可能性が、徐々に明らかにされています。核酸医薬は内在性遺伝子の発現を制御することが可能であり脊髄性筋萎縮症の治療薬として既に承認され、ハンチントン病、筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病などの中枢神経疾患で臨床試験が進行中ではありますが、血液脳関門を有する中枢神経系への送達が困難である事から、髄腔内投与が必要です。髄腔内投与は静脈内投与や皮下投与などの全身投与と比べ侵襲性が高いという問題があり、より安全に使用できる核酸医薬の開発が望まれます。そこで、より安全な投薬ルートで効率的遺伝子制御効果を可能とする治療薬の開発を目的に、本研究グループは独自に開発したヘテロ核酸を用い、多発性硬化症の動物モデルであるEAEマウスのミクログリア・中枢神経浸潤マクロファージの制御を試みました(図A右)。
研究の概要
DNA/RNAヘテロ2本鎖核酸は、東京医科歯大学脳神経内科の研究グループが独自に開発した、従来の核酸医薬と異なる分子構造(図B)と多様なデリバリー分子(図C)、さらに細胞内作用メカニズムを有する新しい医薬技術であり、中でもコレステロールリガンドを結合させたヘテロ核酸は、全身投与で健常マウスの血液脳関門を通過し脳へ送達されミクログリアにおいて遺伝子発現抑制効果を発揮します。
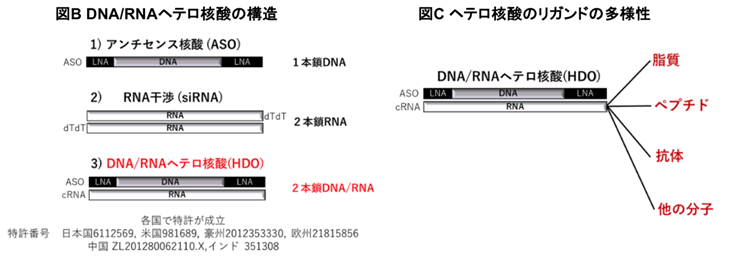 ヘテロ核酸は、1本鎖アンチセンス核酸や、2本鎖RNAであるsiRNAとは全く異なる分子構造を持ち(図B)、ペプチドや抗体を含む任意のドラッグデリバリーシステム分子と結合可能である(図C)。
ヘテロ核酸は、1本鎖アンチセンス核酸や、2本鎖RNAであるsiRNAとは全く異なる分子構造を持ち(図B)、ペプチドや抗体を含む任意のドラッグデリバリーシステム分子と結合可能である(図C)。
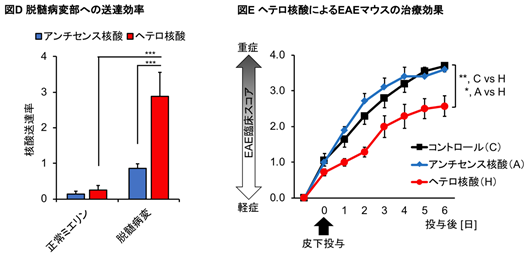
そこで、EAEマウスにコレステロールリガンド結合型ヘテロ核酸を静脈内もしくは皮下投与し、送達・遺伝子発現抑制効果を従来のアンチセンス核酸と比較しました。ヘテロ核酸はアンチセンス核酸に比べ、より効率的に腰髄の脱髄病変部へ送達され(図D)、さらに病変部に群がる特性をもつミクログリア・マクロファージへ多く取り込まれました。そして、これらの細胞においてヘテロ核酸は優れた標的遺伝子発現抑制効果を発揮しました。EAEマウスでは脱髄病変部で血液脊髄関門が破綻するにも関わらず、ヘテロ核酸がアンチセンス核酸より効率的に送達された事から、ヘテロ核酸には血液脊髄関門通過以外の送達機構が存在することを推定しました。多発性硬化症の病変部において、各種受容体の発現が増加することに着目し、ヘテロ核酸のコレステロールリガンドを認識する受容体候補を検索し、マクロファージスカベンジャーレセプター1(MSR1)※4がヘテロ核酸の送達機構に関与している事を特定しました。さらに、多発性硬化症・EAEマウスのミクログリア・マクロファージ上に発現し神経炎症の促進に関与するCD40遺伝子を標的とするヘテロ核酸をEAEマウスに皮下投与すると、ヘテロ核酸を投与されたEAEマウスはミクログリア・マクロファージにおけるCD40の発現が抑制され、臨床スコアが有意に軽症化しました(図E)。
研究成果の意義
ゲノム解析の進展により様々な遺伝子の疾患への関与が明らかにされつつあり、RNAを標的とすることが可能な核酸医薬は有望な医薬技術です。しかし、上述の通り非侵襲投与ルートを介した中枢神経疾患の治療は未だ実現化していません。再発・寛解を繰り返し、慢性の経過をたどる多発性硬化症は長期治療が必要であり、優れた有効性に加えより安全な投与ルートにて、有害事象の少ない治療の開発が望まれ、ヘテロ核酸はこれらを可能とする医薬技術として期待できます。
用語解説
- ※1 アンチセンス核酸(ASO)
- 細胞内に存在する RNA等を標的とする核酸医薬で、1本のDNA鎖を基本構造として様々な化学修飾が施されている。既存の低分子医薬や抗体医薬では標的にできない細胞内のRNAを標的として結合することが可能で、標的RNAから翻訳される疾患に関わるタンパク質を一過性に低下、機能を抑制したり、発現上昇させたりと、これまで治療法のなかった疾患の治療薬の主流となりつつある。主な国内での承認薬としては、脊髄性筋萎縮症に対するヌシネルセン、家族性ポリアミロイドニューロパチーに対するイノテルセン、デュシェンヌ型筋ジストロフィーに対するビルトラルセンなどがあり、現在も複数の臨床試験が進行中である。
- ※2 実験的自己免疫性脳脊髄炎(EAE)マウス
- 多発性硬化症は、リンパ球などの白血球が中枢神経系へ移行して髄鞘が破壊される脱髄により、脳・脊髄といった中枢神経系が障害される炎症性疾患で、その症状は視覚障害、高次機能障害や四肢の麻痺など多彩である。EAEマウスは多発性硬化症の動物モデルで、神経由来のペプチドとフロイントアジュバントを免疫することで神経炎症と脱髄が誘発される。
- ※3 CD40(cluster of differentiation 40)
- 抗原提示細胞表面に発現する共刺激分子の一つであり、多発性硬化症の病変部ではミクログリアやマクロファージに多く発現する。病原性T細胞表面のCD40リガンド(CD40L)と作用し、T細胞の活性化に必要な共刺激分子の発現や炎症誘発性因子の産生を促進する。ミクログリアやマクロファージのCD40を欠損させるとEAEマウスが軽症化することが知られている。
- ※4マクロファージスカベンジャーレセプター1(MSR1)
- スカベンジャー受容体の一つであり、コレステロールを含む様々な分子を認識する。中枢神経系において主にミクログリアとマクロファージに発現し、多発性硬化症の病変部で発現が増加することが報告されている。
論文情報
- 掲載誌
- Molecular Therapy
- 論文タイトル
- Regulation of activated microglia and macrophages by systemically administered DNA/RNA heteroduplex oligonucleotides
研究者プロフィール
西 李依子 (ニシ リエコ) Rieko Nishi
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
研究領域:神経内科学、核酸医薬
大谷木 正貴 (オオヤギ マサキ) Masaki Ohyagi
慶應義塾大学医学部 微生物学免疫学教室
特任助教
研究領域:神経内科学、神経免疫学
永田 哲也 (ナガタ テツヤ) Tetsuya Nagata
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) プロジェクト准教授
研究領域:神経内科学、核酸医薬
横田 隆徳 (ヨコタ タカノリ) Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 教授
研究領域:神経内科学、核酸医薬
お問い合わせ先
研究に関すること
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野
横田 隆徳(ヨコタ タカノリ)
永田 哲也(ナガタ テツヤ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当