治療抵抗性重症急性移植片対宿主病に対する臍帯由来間葉系細胞(IMSUT-CORD)輸注療法の医師主導治験を開始~日本初の臍帯由来再生医療等製品の実用化に向けて大きく前進~
2018-07-17 東京大学医科学研究所附属病院,日本医療研究開発機構
発表者
東條 有伸 (東京大学医科学研究所附属病院 血液内科 教授)
長村 登紀子(東京大学医科学研究所附属病院 セルプロセッシング・輸血部 部長/臍帯血・臍帯バンク 施設長)
大橋 一輝(がん・感染症センター都立駒込病院 血液内科 部長)
山本 久史(虎の門病院 血液内科 医員)
発表のポイント
- 本研究グループは、臍帯から豊富な間葉系細胞が採取でき、その間葉系細胞に抗炎症・免疫抑制能や組織修復能があることを報告している。臍帯から効率的に間葉系細胞を製造できるよう技術開発するとともに、この抗炎症・免疫抑制能を利用して、臍帯由来間葉系細胞を用いた治療抵抗性急性移植片対宿主病に対する医師主導治験を開始する。
- さまざまな組織由来の間葉系細胞がある中で、臍帯由来間葉系細胞を用いた治験は国内初である。
- 臍帯は、採取にあたりドナーへの身体的負担がなく、増殖力が高いことから、製造コストが削減できるとともに、安定的な間葉系細胞ソースが確立できる可能性がある。
発表概要
造血幹細胞移植後の重症急性移植片対宿主病(GVHD、注1)は、造血幹細胞移植ドナーのリンパ球が患者組織抗原に反応して増殖し、患者臓器を攻撃する過剰な免疫反応であり、移植後の予後を左右する重要な因子である。
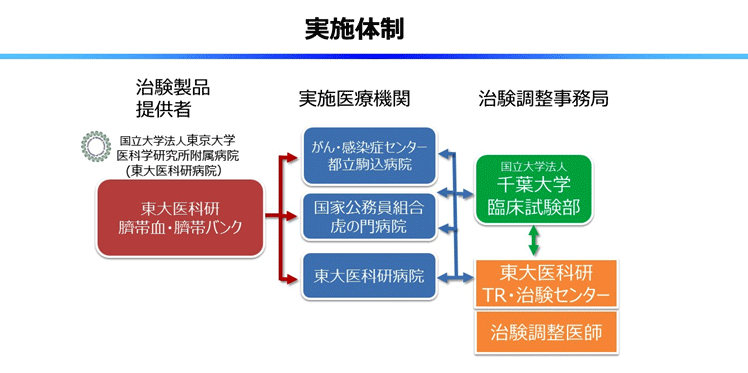
東京大学医科学研究所附属病院(東大医科研病院)セルプロセッシング・輸血部 准教授 長村登紀子らの研究グループは、臍帯から豊富な間葉系細胞(MSC)が採取できることを国内で初めて報告し、臍帯由来MSCがもつ免疫抑制能を利用してGVHDを治療する再生医療等製品として製品化(製品名:IMSUT-CORD)に取り組んできた。このたび、医薬品医療機器総合機構(PMDA)への治験届を経て、重症急性GVHDの患者を対象に、本治療の安全性を検討する医師主導治験(第一相試験)を実施する。本治験は、国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業「同種臍帯由来間葉系細胞を用いた重症急性移植片対宿主病に対する医師主導治験を目指した研究」(研究開発代表者:長村登紀子)の研究支援を受け、東大医科研病院で製造し、東大医科研病院、都立駒込病院及び虎の門病院の3施設で実施する(治験調整医師代表 東條有伸)。
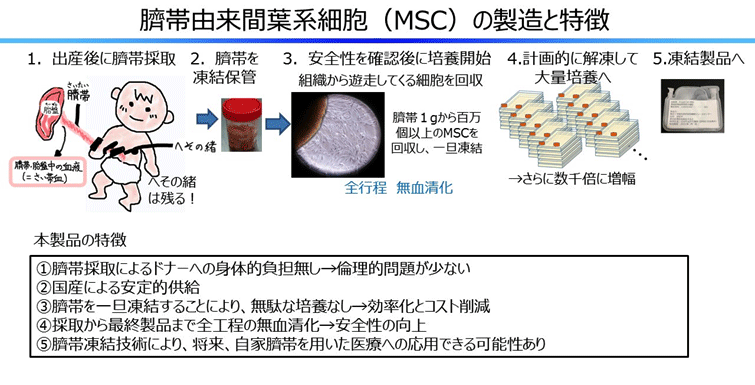
本製品はMSCの基本特性である免疫抑制能と組織修復能を有することに加え、①ドナーへの身体的負担なく採取できること、②国内ドナー由来臍帯としてトレーサビリティが高いこと、③低抗原性であること、④製造工程に牛胎仔血清が含まれておらず感染のリスクが低いこと、⑤増殖能が高いこと、等の利点があり、同種細胞の製品として汎用性が高い。本治験により本邦初の国産臍帯由来再生医療等製品の実用化に向けて大きく前進する。
発表内容
東京大学医科学研究所附属病院 セルプロセッシング・輸血部 准教授 長村登紀子らの研究グループは、臍帯由来間葉系細胞(MSC)を再生医療等製品(製品名:IMSUT-CORD)として製品化に取り組んでおり、このたび、同種(注2)造血幹細胞移植後の治療抵抗性重症急性移植片対宿主病(GVHD)の患者を対象に本治療の安全性を検討する医師主導治験(第一相)を開始する。
背景
造血幹細胞移植は、白血病や再生不良性貧血などさまざまな難治性造血器疾患や代謝疾患、免疫不全症などに対して根治治療の一環として行われる。造血幹細胞移植後の重症急性GVHDは、造血幹細胞移植ドナーT細胞の患者組織の同種抗原に対する過剰な免疫反応であり、皮膚(皮疹)、消化管(大量下痢)や肝障害(黄疸)を主症状とする。血中または組織中のリンパ球の浸潤とインターフェロンγ(IFN-γ)、TNF-α等の炎症性サイトカインの上昇を認め、移植後の予後を左右する重要な因子である。GVHDの発症や重症度は、移植の種類、ドナーの違いや患者とドナー間のHuman Leukocyte antigen (HLA、注3)の違い等に影響される。
国内での造血幹細胞移植は、年間計5,000件程度実施されており、治療が必要とされるグレードⅡ~Ⅳの重症急性GVHDは20から50%である。近年、非血縁者間末梢血幹細胞移植、HLAが合致していないドナーからの移植の増加、ドナーの高齢化などの増加によりGVHDは重症化または増加が予想され、GVHD治療の必要性が増している。
急性GVHDに対する治療は、原則として重症度グレードⅡ度以上が対象となり、一次治療としてステロイド(メチルプレドニゾロンやプレドニゾロン)が標準的に用いられる。ステロイド治療開始3日目以降の増悪、5日目で改善がみられない場合は、治療抵抗性GVHDとして二次治療が行われる。しかし、二次治療としては、ステロイドの増量や他の免疫抑制剤の併用などが行われているが、治療の反応は極めて不良で、1年以内の死亡率は90%に及ぶ。その他の治療として、抗ヒト胸腺細胞ウサギ免疫グロブリン(ATG)においても、長期予後の改善には至らず、ミコフェノール酸モフェチルやアレムツズマブの有効例の報告はあるも、我が国では保険適応外である。またこれらの治療法は、過度の免疫抑制による致命的感染症を合併する危険性を増す結果となっており、より効果的で安全な治療法の開発が望まれている。
一方、MSCは、分化能に加え、炎症部位や組織障害部位へ集積して抗炎症・免疫抑制能、組織修復能を示すことから、重症急性GVHDへの応用が期待されている。Le Blancらが初めて同種骨髄由来MSCを用いたGVHD治療の成功例を報告(Lancet, 2004)して以降、骨髄由来MSCの製品化と臨床応用が進められてきた。本邦では、JCRファーマ社が、Osiris社の技術を導入し、グレードⅡⅣおよびⅢ~Ⅳの急性GVHDに対して骨髄由来MSCの企業治験を実施し、テムセルHS®として世界で初めて成人GVHD用治療細胞製品として保険適応され市販している。
臍帯由来MSCと治験について
研究代表者の長村らは、MSCをソースとして、臍帯に注目してきた。臍帯は、出産に伴って出る赤ちゃん由来の組織であり、臍帯から豊富なMSCが採取できることを国内で初めて報告し、その免疫抑制能、組織修復能について検討してきた。GVHDの試験管内のモデルである同種リンパ球混合反応(MLR、注4)においては、同種細胞抗原に反応してT細胞が活性化され、IFN-γやTNF-α等の炎症性サイトカインが誘導され増殖する。その活性化T細胞の増殖を第3者ドナー(注5)由来の臍帯由来MSCは抑制すること、その抑制には臍帯由来MSCから分泌されるindoleamine 2,3-dioxygenase (IDO)やProstaglandin E2などの液性因子が関与していること、MLR中の炎症性サイトカインを抑制することを報告した。また、MSCには傷んだ細胞へ移動して効果を発揮する能力があることも分かった。これらの結果から、臍帯由来MSCが同種細胞として、重症急性GVHDに応用可能であると判断した。
さらに、長村らは、臍帯由来MSCを再生医療等製品とすべく、製造工程の改良や効率化を進め、いくつかの特許出願を行っている。特に、臍帯を組織ごと凍結する手法や、多くのMSC製品の製造で用いられる牛胎仔血清や、細胞の凍結の際の凍害保護液に用いるヒトアルブミンを用いず、全工程での無血清化を達成することにより、感染のリスクを極力なくし、安全性が飛躍的に向上している。さらに今回用いる無血清培地は、従来の培地よりも高い増殖率を示すことから、一本の臍帯で、医師主導治験用の十分な細胞数が得られ、コスト的にも優位性が高いと考えている。
なお、本製品開発および医師主導治験は、2017年度より国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業「同種臍帯由来間葉系細胞を用いた重症急性移植片対宿主病に対する医師主導治験を目指した研究」(研究開発代表者:長村登紀子)における研究支援や企業との共同研究における支援を受けている。当院での治験審査委員会での承認後、2018年2月に治験届を提出し、その他の種々の手続きや準備を経て2018年7月より、医師主導治験(第1相)を開始する。
臨床試験の概要
本治験の目的は、同種造血幹細胞移植(骨髄移植、末梢血幹細胞移植、臍帯血移植)後のステロイドを含めた標準的一次治療に抵抗性を示すグレード Ⅱ~Ⅳの治療抵抗性重症急性GVHD患者を対象とする。治験製品IMSUT-CORDは、東京大学医科学研究所附属病院 セルプロセッシング・輸血部 細胞リソースセンター 臍帯血・臍帯バンク で製造し、治験実施施設に提供する。試験に参加するにあたっては基準を設けており、基準を満たす方が対象となる。被験者は東京大学医科学研究所附属病院、都立駒込病院及び虎の門病院の参加施設の入院患者を想定している。
今回の治験は第一相試験であり、最適な投与量を確認するために投与量を二段階設定して投与する。投与は静脈から凍結保存しておいた臍帯由来間葉系を注入し、週2回投与を1サイクルとして2サイクル投与し、安全性が確認でき治療効果が不十分な場合では4サイクルまで投与する場合がある。投与量1段階あたり3名~6名の参加となる。治験の主目的は安全性の確認で、副次的な目的として有効性と免疫反応を検討する。治験の期間は2019年度末までを予定している。治験調整医師代表は、東京大学医科学研究所 病院長/血液腫瘍内科 東條有伸、治験責任医師は、東京大学医科学研究所附属病院 長村登紀子、がん・感染症センター都立駒込病院 大橋一輝、虎の門病院 山本久史が各々担当する。
研究開発の将来展望
本医師主導治験において安全性の確認とPOC(Proof of Concept)確立後は、ヒューマンライフコード株式会社(注6)による企業治験を進める計画である。本製品は、新生児脳症などの他の疾患についても非臨床POCを得ており、本治験による安全性・POC獲得後、他疾患への応用を速やかに目指すことができる。
東大医科研病院は、2017年度より院内の臨床研究支援組織の一つとして「東大医科研臍帯血・臍帯バンク」を設置し、研究用検体を含め、企業にも試料を提供する仕組みを構築している。
海外では臍帯由来MSCは、造血幹細胞移植の生着促進とGVHD予防、血液疾患、神経疾患(脳性麻痺や脳挫傷、変性疾患)、糖尿病、心筋梗塞、肝硬変、膠原病など多様な疾患に対して臨床試験が開始されている(注7)。 臍帯は、ドナーへの身体的危険がなく採取でき、増殖力の高い理想的なMSCソースとして、さらなる適応拡大が期待される。
用語解説
- 注1:急性移植片対宿主病(Graft-versus-host disease: GVHD)
- 「同種造血幹細胞移植後早期にみられる関連合併症の一つで、皮疹・黄疸・下痢を特徴とする症候群で、移植片の宿主に対する免疫学的反応によるもの」と定義される。こうした病態を防ぐために、移植前から予め免疫抑制剤を投与するが、免疫抑制剤投与下でも GVHD は発症し、標準治療としてのステロイド療法が効かない難治例では致命的な経過や生活の質(QOL)の低下につながる。
- 注2:同種
- 自分以外のことで、他家ともいう。この対義語は 自家である。
- 注3:HLA(Human Leukocyte Antigen;ヒト白血球抗原)
- 主要組織適合遺伝子複合体(MHC)の産物で、全ての細胞に分布し、自己と非自己の識別に関与する重要な免疫機構として働いている。ヒトは、父母それぞれのハプロタイプ(HLA抗原一対の半分)を受け継いだ一対のHLAからなる。HLAが合致している方がGVHDの発症率重症度は低い。合致していないと、自己と非自己の認識が高まる。
- 注4:リンパ球混合反応
- レスポンダーリンパ球(ドナーリンパ球の代わり)と刺激側リンパ球(患者組織の代わりで、予め増殖しないように処理してある)を混合すると、レスポンダーリンパ球が刺激側リンパ球の同種HLA抗原を認識して活性化・増殖する反応を試験管の中で見る試験である。
- 注5:第3者
- ドナーでも患者リンパ球でもない双方から見た他人のこと。第3者ドナー由来MSCでも効果があることは、汎用できるという裏付けになる。
- 注6:ヒューマンライフコード(株)
- 企業主導治験及び製造販売承認を担当する方向。
- 注7:
- Nagamura-Inoue T, Mukai T. Umbilical Cord is a Rich Source of Mesenchymal Stromal Cells for Cell Therapy. Current Stem Cell Research & Therapy, 11, 634-642,2016
添付資料
問い合わせ先
治験等に関するお問合せ先
東京大学医科学研究所附属病院 TR・治験センター
取材に関するお問合せ先
東京大学医科学研究所事務部管理課 総務チーム
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課