2022-06-23 ミシガン大学
研究者たちは、TMEM175が変異していると、リソソーム内の環境の酸性度を適切に調節できないことを発見した。その環境の酸性度が適切でないと、リソソーム内の酵素が効果的に働かなくなり、小器官が正しくその役割を果たすことができなくなる。
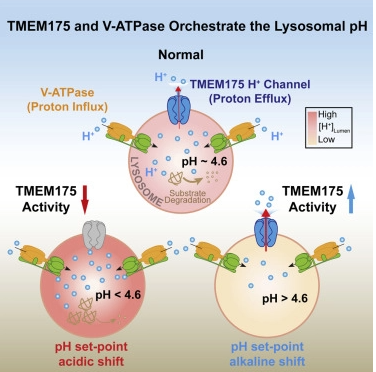
リソソームの酵素は、およそ4.6の最適なpHを必要とします。pH4.6以外のものは、代謝機能障害を引き起こす可能性があり、その結果、細胞のゴミが蓄積され、最終的に神経変性や代謝性疾患を引き起こすことになる。
細胞はαシヌクレイン凝集体を含む細胞のガラクタを分解する酵素活性の低下を示し、TMEM175が細胞の酸性度と分解を調節する役割を担っていることが示された。
<関連情報>
- https://news.umich.edu/u-m-researchers-reveal-new-molecular-mechanism-for-parkinsons-disease-risk/
- https://www.cell.com/cell/fulltext/S0092-8674(22)00652-3
パーキンソン病リスクタンパク質TMEM175はリソソームでプロトン活性化されるプロトンチャネルである Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes
Meiqin Hu ,Ping Li ,Ce Wang ,Xinghua Feng,Qi Geng,Wei Chen,Matangi Marthi,Wenlong Zhang,Chenlang Gao,Whitney Reid,Joel Swanson,Wanlu Du,Richard I. Hume,Haoxing Xu
Cell Published:JUNE 23, 2022
DOI:https://doi.org/10.1016/j.cell.2022.05.021
Summary
Lysosomes require an acidic lumen between pH 4.5 and 5.0 for effective digestion of macromolecules. This pH optimum is maintained by proton influx produced by the V-ATPase and efflux through an unidentified “H+ leak” pathway. Here we show that TMEM175, a genetic risk factor for Parkinson’s disease (PD), mediates the lysosomal H+ leak by acting as a proton-activated, proton-selective channel on the lysosomal membrane (LyPAP). Acidification beyond the normal range potently activated LyPAP to terminate further acidification of lysosomes. An endogenous polyunsaturated fatty acid and synthetic agonists also activated TMEM175 to trigger lysosomal proton release. TMEM175 deficiency caused lysosomal over-acidification, impaired proteolytic activity, and facilitated α-synuclein aggregation in vivo. Mutational and pH normalization analyses indicated that the channel’s H+ conductance is essential for normal lysosome function. Thus, modulation of LyPAP by cellular cues may dynamically tune the pH optima of endosomes and lysosomes to regulate lysosomal degradation and PD pathology.

