 医療・健康
医療・健康 脳細胞はどのように競争して私たちの精神を形成するのか: 発達から老化まで (How Brain Cells Compete to Shape Our Minds: From Development to Aging)
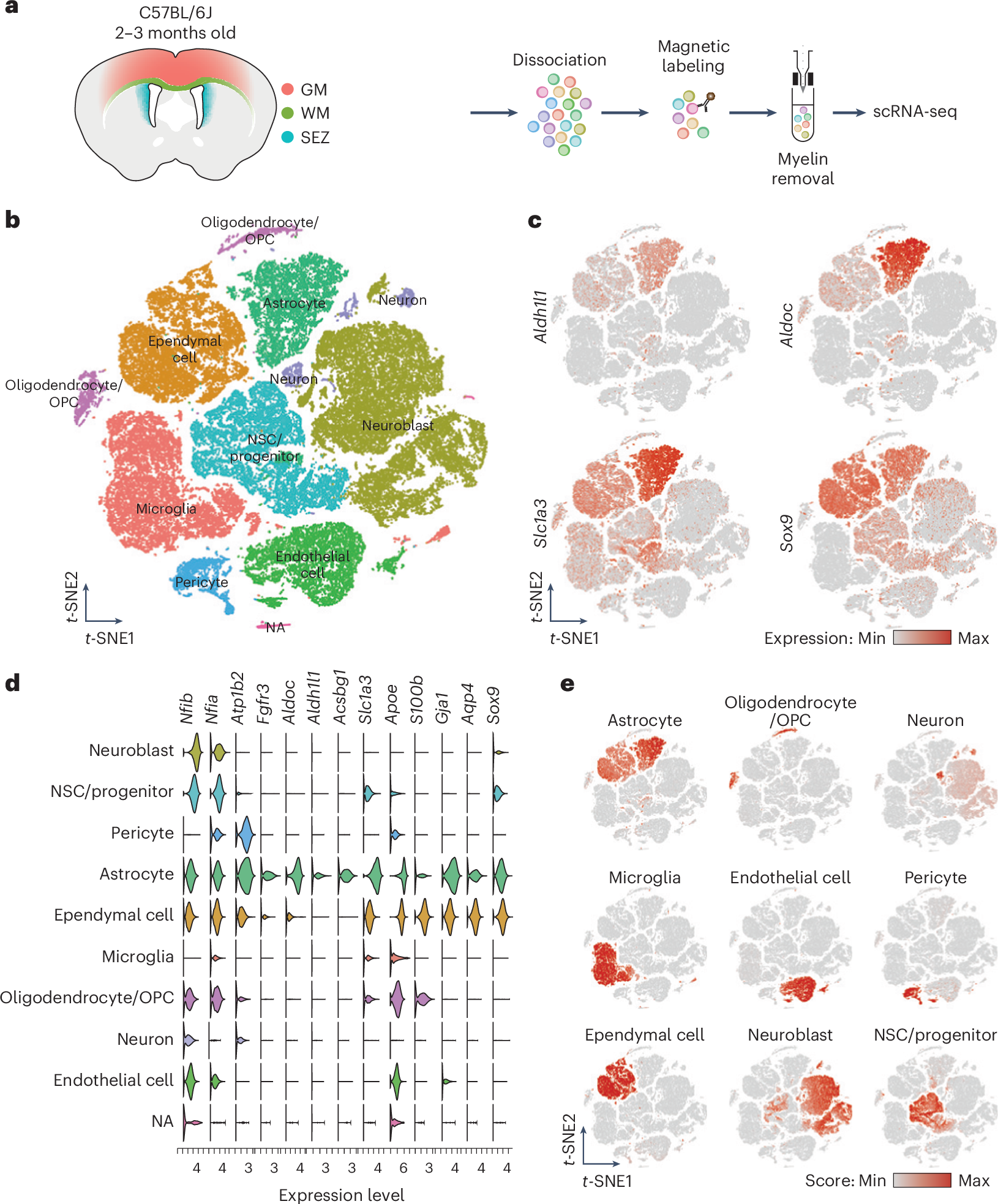
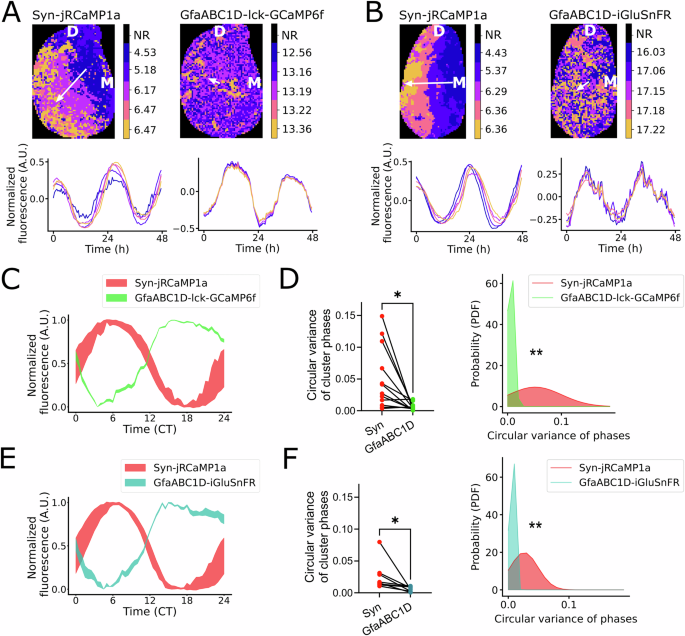
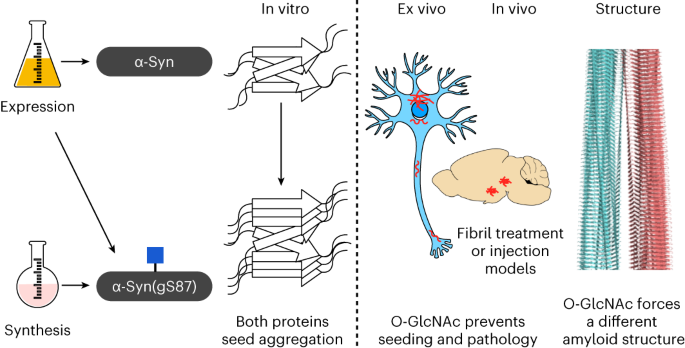
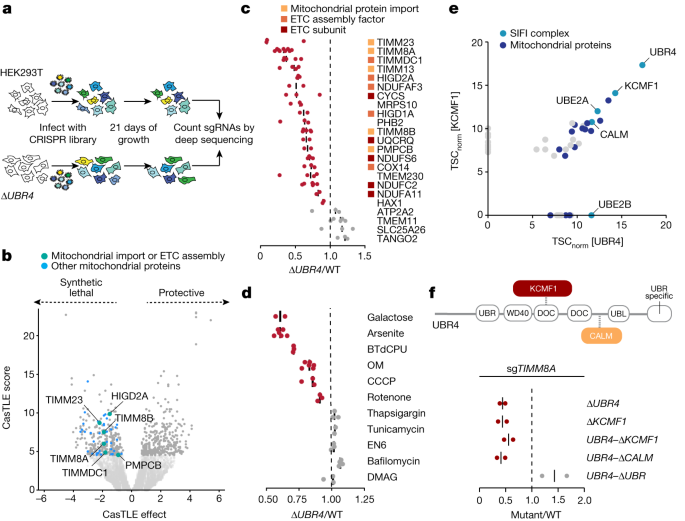
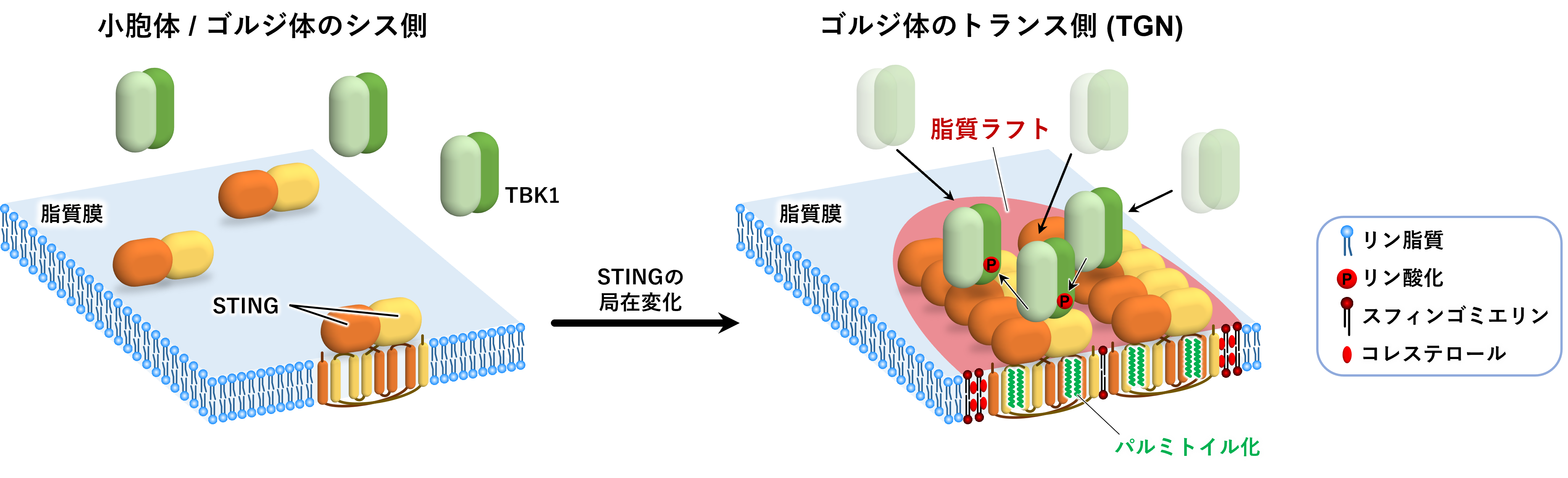
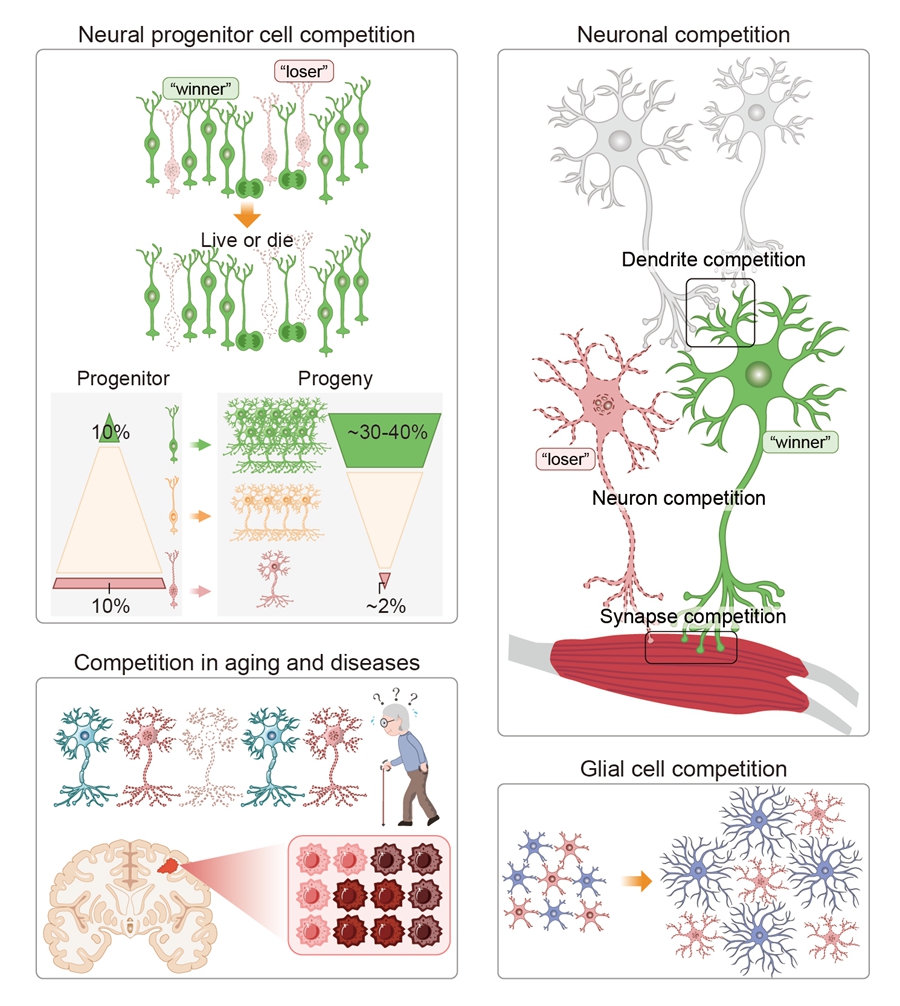
2025-03-01 中国科学院(CAS)Neural cell competition in development, homeostasis and disease. (Image by GAO Lisen)中国科学院の研究チームは、神...