2022-08-10 国立循環器病研究センター
国立循環器病研究センター(大阪府吹田市、理事長:大津欣也、略称:国循)の豊田一則副院長が国内研究代表者を務める、急性期脳出血治療に関する世界6か国共同の医師主導臨床試験「rFVIIa for Acute Hemorrhagic Stroke Administered at Earliest Time (FASTEST)」の患者登録が始まり、2022年7月20日に国内1例目の患者が登録されました。
■急性期脳出血診療の問題点
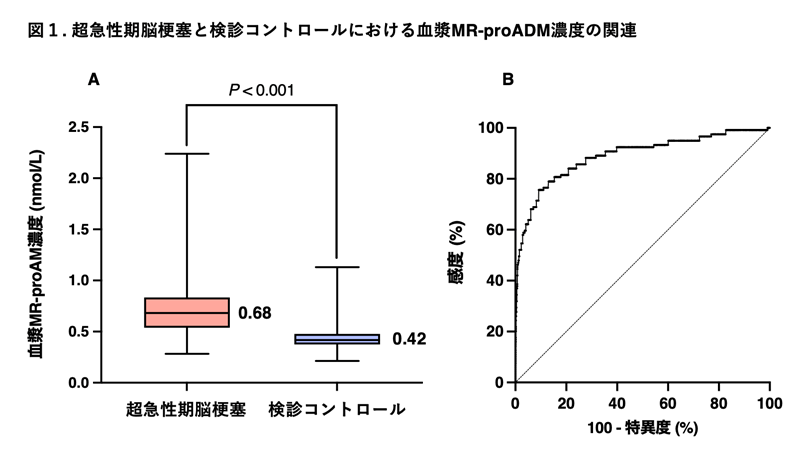
脳出血は、日本を含めた東アジアでとくに発症率が高く、国内における新規発症の脳卒中の約2割を占め、年間4-5万人程度に発症すると推測されます。脳梗塞が近年の急性期再灌流療法の進歩などで目立った後遺症を残さない患者が増える一方で、急性期脳出血への治療開発は遅れています。このため脳出血は死亡や高度脳機能障害に繋がり易く、征圧が切望される国民病です(図1)。
症状の大幅な改善が期待される急性期脳出血への治療法に、(1)外科治療、(2)降圧治療、(3)血栓止血学的治療(緊急止血治療)が挙げられます。外科治療(開頭血腫除去術)は生命を救うために重要ですが、明らかな後遺症の改善効果は証明されていません。急性期降圧治療について、国循では今回と同じ米国国立衛生研究所(NIH)の助成による国際医師主導試験ATACH-2の国内代表施設となって臨床試験を実施しましたが、降圧に伴う後遺症の改善効果はあまり大きくありません。このような状況下で、緊急止血治療への期待が高まっています。
(図1)脳梗塞と脳出血の患者重症度、転帰の違い: 日本脳卒中データバンクより
(Toyoda K, Koga M: Hypertens Res. 2022;45:583-590 より改変引用)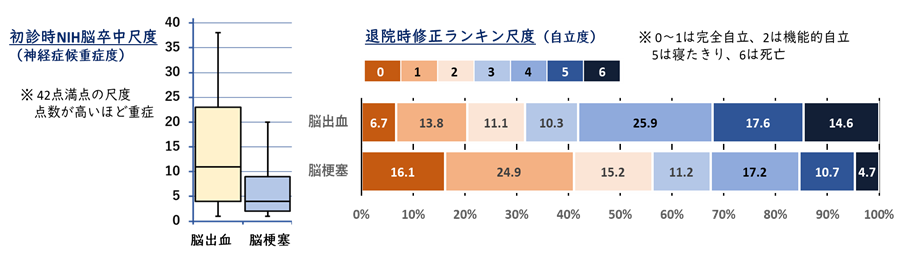
■FASTEST試験とは
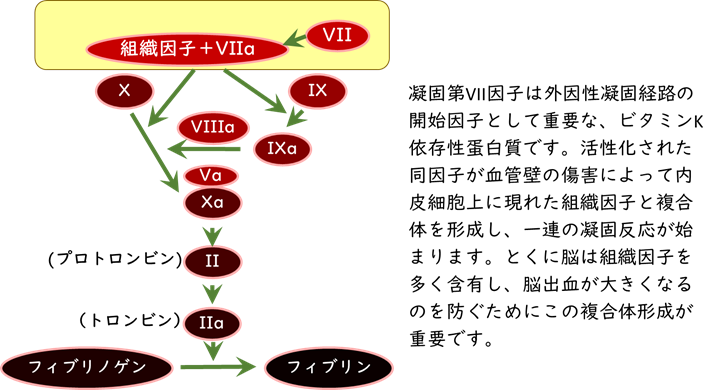
脳出血への緊急止血治療として、抗凝固薬服用中に発症した患者さんに対する抗凝固薬の特異的中和薬を用いた治療が推奨されていますが、脳出血患者全体に広く用いられる治療法はありません。このような中で、外因性凝固経路の開始因子として重要な凝固第VII因子に注目し、遺伝子組換え活性型第VII因子(recombinant factor VIIa: rFVIIa)を用いた脳出血治療開発が、以前から行われてきました(図2)。rFVIIaは血友病などの治療薬ノボセブンとして、既に国内で承認されています。2000年代半ばに日本を含めて世界で行われた企業主導の臨床試験FASTで、発症後4時間以内の脳出血患者への治療効果を証明できず、いったん開発が頓挫しました。しかし、出血拡大の勢いがより強い発症後2時間以内の患者などに限定して解析し直すと、rFVIIaが有望なことが分かりました。
そこで米国シンシナティ大学脳神経内科のJoseph Broderick教授を中心とする世界の著名な臨床脳出血研究者が連携し、発症後2時間以内の脳出血患者における rFVIIaの有効性と安全性を偽薬と比較して検証する、医師主導の国際多施設共同臨床試験を企画しました。FAST試験を超える結果を得られるようにとの願いを込めて、FASTESTと名付けました。FASTESTには日本、米国、カナダ、ドイツ、スペイン、英国の6か国が参加し、860例の登録対象者を2群に分けてrFVIIa ないし偽薬(プラセボ)を無作為に投与して、6か月間の追跡調査を行います。米国NIHの助成を受けて試験を行いますが、特に国内施設に対しては、日本医療研究開発機構(AMED)からも研究基盤整備のための研究助成を受けています(2019~2022年度)。プロトコール論文も公表されています。(Naidech AM, et al: Int J Stroke. 2021 Sep 5: Online ahead of print doi: 10.1177/17474930211042700)
(図2)凝固カスケード
■患者登録に至るまでの経緯と今後の展望
2018年初めに現在の研究計画書にほぼ近い内容の計画書を研究チーム内で作成し、それを基に急性期脳卒中診療施設に参加を呼び掛けて、国内14施設が参加しています(表1)。国内外で準備を進め、2020年には先進医療(注1)の医療技術として承認され、早期の患者登録開始が期待されました。しかし同年からの世界的COVID-19の蔓延などに伴い、臨床情報入力や試験開始に必要な各種書類の管理、試験参加医師の技能トレーニングなどを一括して行う世界共通の電子入力システムの作成が大幅に遅れるなど、その後の世界での試験準備が上手く進まなくなりました。NIHからの助言に合わせて何度も試験デザインの細部を修正する必要も生じ、ジリジリと試験開始を待つ日が続きました。今春以降に国内施設が一つずつ米国中央施設の最終承認を受けて患者登録が可能になり、7月20日に新潟市民病院が待望の国内患者1例目を登録しました。
FASTEST試験への患者登録の最大の問題点は、発症して2時間以内の脳出血患者さんを正しく診断し試験への説明同意を得て試験薬を投与する、タイトな時間制約です。現在国内外で、次々と参加施設が最終承認を受けており、COVID-19等の事情によるこれまでの遅れを一気に取り返そうとしています。
国民病である脳出血の治療開発のために、ぜひこの臨床試験を成功させたいと願っています。
(注1 先進医療B: 国民の安全性を確保し、患者負担の増大を防止するといった観点を踏まえつつ、国民の選択肢を広げ、利便性を向上するという観点から、医薬品の適応外使用について、安全性、有効性等を確保するために一定の施設基準を設定し、当該施設基準に該当する保険医療機関の届出により、又は安全性、有効性等を確保するために対象となる医療技術ごとに実施医療機関の要件を設定し当該要件に適合する保険医療機関の承認により、保険診療との併用を認めるものです。)
(表1) FASTEST 試験 国内参加施設

■謝辞
FASTEST試験は、AMED臨床研究・治験推進研究事業助成(JP22lk0201094) 、米国NIH(U01 NS110772)の研究助成や、ノボノルディスク海外本社からの試験薬無償提供を受けて、遂行されます。
国循は本試験の中央調整施設として、脳血管内科・脳神経内科、脳神経外科、薬剤部、臨床研究推進センターなどが国内試験運営を支えます。
報道関係の方からのお問い合わせ
国立循環器病研究センター企画経営部広報企画室