- ミトコンドリアの欠損が、テロメアの短縮やその他の老化のバイオマーカーによって示されるように、老化を加速させることを明らかにした新しい論文。
New papers reveal how mitochondrial defects lead to accelerated aging as demonstrated by shorter telomeres and other biomarkers of aging
- Polgミューテーターマウスにおける早老は、8-オキソグアニンレベルの上昇とDNA損傷の増加と関連している Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
- ミトコンドリア-リゾソーム間の光遺伝学的制御による光活性化ミトコンドリア分裂の実現 Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
ミトコンドリアの欠損が、テロメアの短縮やその他の老化のバイオマーカーによって示されるように、老化を加速させることを明らかにした新しい論文。 New papers reveal how mitochondrial defects lead to accelerated aging as demonstrated by shorter telomeres and other biomarkers of aging
2022-08-22 バッファロー大学(UB)
『Aging Cell』誌に掲載された論文で、ミトコンドリアの欠損と老化プロセスにおける重要なシグナルとの関連が初めて明らかにされました。また、Nature Communications誌の別の論文では、光遺伝学に基づいて開発した新しい技術により、異常なミトコンドリアの相互作用に正常な機能を回復させることができることを説明しています。
Aging Cellの論文は、ミトコンドリアの機能障害と、早期老化の主要なバイオマーカーであるテロメアの短縮を初めて関連付けた。
テロメアの短縮は、一般に老化の重要なバイオマーカーとみなされていますが、長い間、誰もそのメカニズムを知りませんでした。今回、ミトコンドリアの機能障害とテロメアの短縮を直接結びつけることができた。
ミトコンドリアの機能低下に特に関連し、小児ミトコンドリア障害を引き起こすミトコンドリアDNAの一塩基の変化が、老化を促進することを、ヒトで示すこともできた。
ミトコンドリアの機能低下による活性酸素が、経時的にDNA損傷の増加をもたらすことを発見した。
この論文は、このモデルのミトコンドリアDNA変異が、DNA内の特定の化学マーカーに従って個人の生物学的年齢を推定するDNAクロックによって示されるように、より急速な老化をもたらすことを示した最初の論文です。
7月25日に発表されたNature Communications誌の論文は、光を使って細胞活動を操作するオプトジェネティクスが、研究だけでなく、細胞小器官の相互作用をリアルタイムで指揮するツールとして採用できることを明らかにしている。
ミトコンドリアは、1つのミトコンドリアが2つに分裂する「分裂」と、2つが融合して1つになる「融合」を繰り返しています。細胞内でこの2種類のプロセスのバランスが崩れると、ミトコンドリア病につながる可能性がある。
光遺伝学を利用して、ミトコンドリアともう一つの細胞構成要素であるリソゾームとの物理的相互作用を強制することで、ミトコンドリアをより正常なサイズに復元しつつ、エネルギー生産機能を向上させることができた。
<関連情報>
- https://www.buffalo.edu/news/releases/2022/08/011.html
- https://onlinelibrary.wiley.com/doi/10.1111/acel.13669
- https://www.nature.com/articles/s41467-022-31970-5
Polgミューテーターマウスにおける早老は、8-オキソグアニンレベルの上昇とDNA損傷の増加と関連している Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
Tenghui Yu,Jesse Slone,Wensheng Liu,Ryan Barnes,Patricia L. Opresko,Landon Wark,Sabine Mai,Steve Horvath,Taosheng Huang
Aging Cell Published: 22 August 2022
DOI:https://doi.org/10.1111/acel.13669

Abstract
Mitochondrial dysfunction plays an important role in the aging process. However, the mechanism by which this dysfunction causes aging is not fully understood. The accumulation of mutations in the mitochondrial genome (or “mtDNA”) has been proposed as a contributor. One compelling piece of evidence in support of this hypothesis comes from the PolgD257A/D257A mutator mouse (Polgmut/mut). These mice express an error-prone mitochondrial DNA polymerase that results in the accumulation of mtDNA mutations, accelerated aging, and premature death. In this paper, we have used the Polgmut/mut model to investigate whether the age-related biological effects observed in these mice are triggered by oxidative damage to the DNA that compromises the integrity of the genome. Our results show that mutator mouse has significantly higher levels of 8-oxoguanine (8-oxoGua) that are correlated with increased nuclear DNA (nDNA) strand breakage and oxidative nDNA damage, shorter average telomere length, and reduced mtDNA integrity. Based on these results, we propose a model whereby the increased level of reactive oxygen species (ROS) associated with the accumulation of mtDNA mutations in Polgmut/mut mice results in higher levels of 8-oxoGua, which in turn lead to compromised DNA integrity and accelerated aging via increased DNA fragmentation and telomere shortening. These results suggest that mitochondrial play a central role in aging and may guide future research to develop potential therapeutics for mitigating aging process.
ミトコンドリア-リゾソーム間の光遺伝学的制御による光活性化ミトコンドリア分裂の実現 Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
Kangqiang Qiu,Weiwei Zou,Hongbao Fang,Mingang Hao,Kritika Mehta,Zhiqi Tian,Jun-Lin Guan,Kai Zhang,Taosheng Huang & Jiajie Diao
Nature Communications Published:25 July 2022
DOI:https://doi.org/10.1038/s41467-022-31970-5
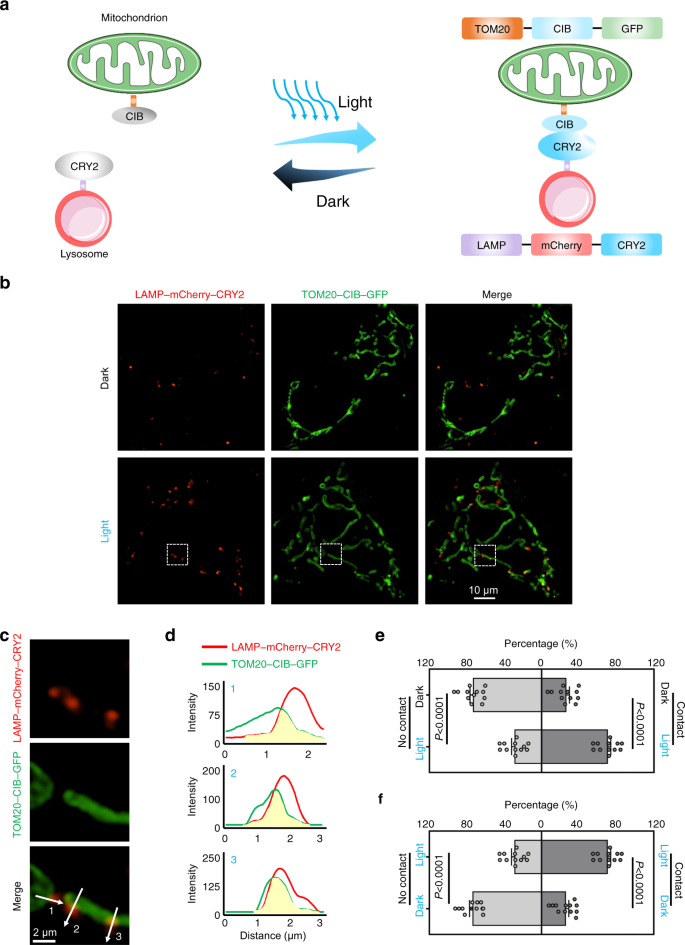
Abstract
Mitochondria are highly dynamic organelles whose fragmentation by fission is critical to their functional integrity and cellular homeostasis. Here, we develop a method via optogenetic control of mitochondria–lysosome contacts (MLCs) to induce mitochondrial fission with spatiotemporal accuracy. MLCs can be achieved by blue-light-induced association of mitochondria and lysosomes through various photoactivatable dimerizers. Real-time optogenetic induction of mitochondrial fission is tracked in living cells to measure the fission rate. The optogenetic method partially restores the mitochondrial functions of SLC25A46-/- cells, which display defects in mitochondrial fission and hyperfused mitochondria. The optogenetic MLCs system thus provides a platform for studying mitochondrial fission and treating mitochondrial diseases.