2020-11-18 大阪大学
研究成果のポイント
・小さなタグをつけた低分子薬剤(小分子)を、金ナノ粒子を用いて生きた細胞中でリアルタイムに観察。
・小分子の動態を細胞内で分析することは効率的な創薬を実現する上で重要であるが、これまで、小分子本来の性質を失わずに生きた細胞内への取り込みを観察することは難しかった。
・様々な細胞・小分子モデルへの応用が期待され、小分子の生きた細胞中での動態分析に貢献。
概要
大阪大学大学院工学研究科の大学院生の小池康太さん(博士後期課程)、畔堂一樹特任助教(常勤)、藤田克昌教授らの研究グループは、同大学免疫学フロンティア研究センターのスミスニコラス准教授、理化学研究所の闐闐孝介専任研究員、袖岡幹子主任研究員らのグループとともに、ラマン散乱※1の一種である表面増強ラマン散乱(SERS)※2を用いることで、小さなアルキンタグ※3をつけた低分子薬剤(小分子)が生きた細胞内へ取り込まれる様子をリアルタイムで観察することに世界で初めて成功しました。
ラマン散乱顕微鏡※4は、分子の化学結合を直接検出することで、分子の空間分布を観察できる光学計測技術です。さらに、生体分子に含まれないアルキン(炭素間三重結合をもつ構造)を観察対象の小分子のタグ(標識)として付加することで、細胞内の複雑な環境下においても対象分子を選択的に観察できます。しかし、ラマン散乱は非常に微弱であるため、観察時間が数十分程度かかることから、細胞内への小分子の取り込みをリアルタイムに観察することはできませんでした。
今回、本研究グループは、金ナノ粒子による表面増強ラマン散乱(SERS)を利用することで、小分子を高感度検出し、時間分解能の向上に成功しました。SERSを用いれば、粒子表面の分子のラマン散乱の効率を数桁以上増強できるため、高感度かつ高速なラマン分子計測が可能になります。本研究では、金ナノ粒子を導入した細胞に薬剤を投与し、ラマン散乱顕微鏡で4次元計測(3次元スキャン+経時観察(タイムラプス))することで、薬剤の細胞内濃度が徐々に増加する様子をリアルタイムに観察することに成功しました。本技術は、様々な細胞種や薬剤分子への応用が可能であり、効率的な創薬への貢献が期待されます。
本研究成果は、2020年10月20日付(米国時間)米国科学誌「ACS Nano」のオンライン速報版で公開されました。
研究の背景
医薬品開発においては、効能や、毒性、副作用を研究する上で対象となる個体、臓器、組織などを、様々な観点から観察する必要があります。ひいては細胞レベル、細胞内小器官をターゲットにすることもあり、それぞれの場合において薬剤との相互作用を観察することが求められています。細胞と薬剤の相互作用に関しては、取り込みや挙動を可視化する技術が求められています。これまで、細胞内分子の動的な振る舞いを観察する場合は、標的とする小分子に蛍光分子を結合させ蛍光顕微鏡※5で観察する手法が広く用いられてきました。しかし、蛍光分子は小分子よりも大きく、蛍光標識が元の医薬品の性質を変化させるため、蛍光分子による標識はタンパク質などの大きな分子の観察にだけ利用されてきました。そこで、近年、原子の結合状態(分子の振動)を直接検出して観察可能なラマン顕微鏡が、蛍光分子に頼らない観察手法として注目されています。一方で、様々な生体分子が混然と存在する細胞内部で目的とする小分子をラマン分光で見分けるのは容易ではありません。そこで、2個の炭素原子が三重結合でつながった小さな構造を有するアルキンを薬剤に結合することにしました。細胞内にはもともとアルキン構造を有する分子が存在しないので、アルキン特有のラマン信号を検出することで小分子の空間分布を選択的に観察することができます。これまでアルキンを用いることで、核酸分子や低分子薬剤など様々な小分子が観察されてきました。しかし、ラマン散乱の発生する効率は非常に低く微弱なため、画像を取得するのに数十分を要します。そのため、生きた細胞内で小分子のダイナミクスをリアルタイムに観察することは困難でした。
研究の成果
本研究グループでは、金ナノ粒子による表面増強ラマン散乱(surface-enhanced Raman scattering, SERS)を用いることで、アルキンを有する小分子が生きた細胞内へ取り込まれる様子をリアルタイムに観察しました。SERSでは、粒子にレーザーを照射し、粒子表面の分子のラマン散乱を増強することができ、粒子周り数ナノメートル領域の局所的な化学状態を高感度に計測できます。細胞のエンドサイトーシス※6を利用して金ナノ粒子を細胞内に導入することで、金ナノ粒子が表面近くの分子のラマン散乱を伝えるSERSプローブとして機能します。実験では、粒子を取り込んだ状態の細胞に小分子を投与し、独自に開発した高速ラマン散乱顕微鏡で計測しました。細胞に取り込まれた小分子が粒子表面に到達するとアルキンの分子構造に由来する非常に強いSERSが発生し、細胞内における小分子の分布を高感度に検出することができました(図1)。さらに、3次元空間の経時観察中に小分子を投与することで、小分子が生きた細胞内に取り込まれる様子を捉えることに成功しました(図2)。薬剤取り込み速度の定量評価のため、単一細胞レベルでアルキンのSERS信号数を計数する新しい解析法も開発しました(図3左)。この手法に基づいて、異なる小分子投与濃度において細胞の取り込み速度が変化することを定量的に示しました(図3右)。
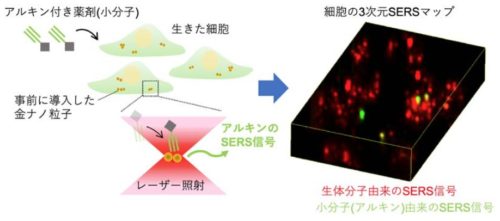
図1 金ナノ粒子の表面増強ラマン散乱(SERS)を用いた、低分子薬剤(小分子)の細胞内検出方法


図2 タイムラプス3次元SERS計測による小分子の細胞内取り込み観察。明視野像と同じ領域を3次元観察した結果を示す。濃度20μMにおいて、投与後10~15分から小分子(アルキン)のSERS信号が検出され始め、時間とともに徐々にその数が増えていく様子を捉えることに成功した。

 図3 単一細胞レベルでアルキンのSERS信号数を計数する手法(左)各投与濃度における、一細胞あたりに検出されたSERS信号数の時間推移(右)
図3 単一細胞レベルでアルキンのSERS信号数を計数する手法(左)各投与濃度における、一細胞あたりに検出されたSERS信号数の時間推移(右)
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、金ナノ粒子による表面増強ラマン散乱(SERS)を用いることで、アルキンのラマン散乱を数桁以上増強させ、細胞内に取り込まれた小分子を高感度に検出することが可能となりました。3次元観察と経時観察を組み合わせた計測によって小分子が細胞内に取り込まれる様子を観察することに成功し、投与濃度などの異なる化学的・物理的環境下によって取り込み速度が変化することを定量的に示しました。ラマン顕微観察において金ナノ粒子とアルキンを用いた本技術は、様々な種類の細胞や薬剤分子への応用が可能であり、細胞内への取り込みの時間的ダイナミクスを調査するための新たな技術になることが期待されます。
特記事項
本研究成果は、2020年10月20日(火)(米国時間)に米国科学誌「ACS Nano」(オンライン)に掲載されました。
タイトル:”Quantitative Drug Dynamics Visualized by Alkyne-Tagged Plasmonic-Enhanced RamanMicroscopy”
著者名:Kota Koike, Kazuki Bando, Jun Ando, Hiroyuki Yamakoshi, Naoki Terayama, Kosuke Dodo,Nicholas Isaac Smith, Mikiko Sodeoka, and Katsumasa Fujita
DOI: 10.1021/acsnano.0c05010
本研究は、日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST, JP18gm071000)と日本学術振興会の科学研究費助成事業特別推進研究(JSPS KAKENHI, 26000011)の助成を受けて行われました。
用語説明
※1 ラマン散乱
入射光と分子振動の相互作用によって、入射光とは異なる振動数の光が散乱される現象。入射光とラマン散乱の振動数差は分子の化学結合状態によって変化する。ラマン散乱を振動数ごとに分光してその強度をプロットしたラマンスペクトルを測定する(ラマン分光法)ことでその物質の性質を調べることができる。
※2 表面増強ラマン散乱(SERS)
金属ナノ粒子などのナノ構造体に光を入射させ、構造体表面近傍に存在する分子から強いラマン散乱を起こす現象。通常のラマン散乱よりも非常に高感度に構造体表面の分子や化学環境を測定できる。
※3 アルキンタグ
アルキンは2つの炭素原子が三重結合で繋がった構造をしている。この構造体は、もともと細胞内には存在していないため、アルキンのラマン散乱の振動数は生体分子のそれと重ならない。ラマン散乱を利用して小分子を選択的に検出する際に、アルキンが小さなタグとして広く利用されている。
※4 ラマン散乱顕微鏡
ラマン分光法と顕微鏡法を組み合わせた計測装置。励起光を試料上に集光し、ラマン散乱光分光して検出する。励起光あるいは、試料を走査しながら逐次的にラマン散乱を取得することで、試料に含まれる分子振動情報の空間分布を観察できる。
※5 蛍光顕微鏡
構造体に光を当てて、蛍光分子から放たれる蛍光の空間分布を観察する顕微鏡。特定の波長を吸収し、異なる波長の蛍光を放つ蛍光分子を、事前に観察したい構造体に標識する必要がある。
※6 エンドサイトーシス
細胞膜を変形させることで細胞外の物質や溶液を取り込む機能のひとつ。取り込んだ物質は細胞内部の小器官に届けられ、残留物は細胞内部のリソソームに届けられる。細胞と金ナノ粒子と一緒に培養することで、粒子を細胞内部に導入することができる。
研究者のコメント
小池康太(大阪大学大学院工学研究科博士後期課程2年)
私たちは、金ナノ粒子による表面増強ラマン散乱を用いることで従来のラマン散乱顕微鏡の感度の限界を突破し、非常に小さな分子が生きた細胞内への取り込まれる様子を高速に観察することを可能にしました。本研究で用いたアイデアは、様々な細胞モデルや薬剤分子への適用が可能です。本研究成果を土台に、将来的に私たち含め世界中の研究者が協力し合うことで小分子イメージングのためのラマン顕微鏡技術がさらに発展することを期待しています。