新技術ラッソ・グラフト法による新しいバイオ医薬創成
2021-03-17 大阪大学,日本医療研究開発機構
研究成果のポイント
- 標的分子への結合活性を担う環状ペプチド配列がそのままタンパク質上に提示できることを証明
- これまで多大な時間がかかっていた「多重特異性抗体」の作製が迅速に可能に
- 全く新しいバイオ医薬のモダリティとして応用に期待
概要
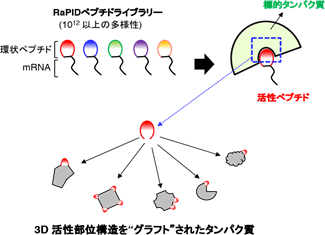
大阪大学蛋白質研究所の高木淳一教授の研究グループは、東京大学理学部の菅裕明教授のグループと共同で、受容体などの医薬標的に結合する活性を環状ペプチドからタンパク質に移植するラッソ・グラフト法(LassoGraft Technology®)を開発し、その広汎な応用例を世界で初めて報告しました。この技術は菅教授が開発したRaPID(Random non-standard Peptides Integrated Discovery)法※1で得られる環状ペプチドのわずか十数アミノ酸の内部配列を、ラッソ(lasso=投げ縄)状にタンパク質の表面のループ構造のなかに埋め込む(グラフト)ことにより、元の環状ペプチドが持っていた医薬標的タンパク質に対する極めて高い特異性と親和性をそっくり土台となるタンパク質に賦与するものです(図1)。これまでそのような単純な活性配列の移植は不可能だと考えられてきましたが、RaPID法で得られる環状ペプチド配列が標的結合構造を取るように高度に最適化されていることを踏まえ、高木教授らのグループは環状ペプチドの立体構造を勘案して土台タンパク質へ埋め込むことが可能と予測し、実際に多くのタンパク質で設計したとおりの人工タンパク質を創成することに成功しました。
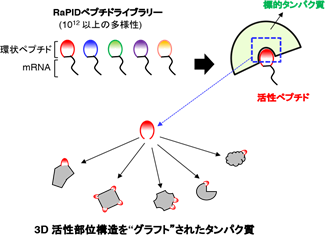
図1 ラッソ・グラフト法の原理
この技術により、ある医薬標的に対する結合活性をもつ十数アミノ酸のペプチド配列を、望みのタンパク質の望みの部位に、しかも複数同時に移植できるようになり、これまでは多大な労力を要していた多重特異性抗体※2の開発がいとも簡単に短時間でできるようになりました。さらにこの技術をウイルスに応用することにより、特定の受容体を発現する細胞のみに遺伝子導入できるウイルスベクターを創成することにも成功しました。
本研究成果は、米国科学誌「Nature Communications」に、2021年3月9日(火)19時(日本時間)に公開されました。
研究の背景
菅教授らはすでにRaPID(Random non-standard Peptides Integrated Discovery)法という環状ペプチド探索システムを考案し、医薬標的タンパク質に対して極めて高い特異性と親和性をもつわずか十数残基のアミノ酸から成る環状ペプチドを同定する技術を確立していました。こうして得られる環状ペプチドは中分子医薬というカテゴリーで極めて有望視されています。これに対して生体適合性や安定性において優れた抗体などのバイオ医薬※3はまったく異なる医薬モダリティ※4として認識されており、これまで両者には接点はないと考えられてきました。
動物の免疫システムを利用する古典的な抗体医薬で始まったバイオ医薬品開発は、試験管内で創り出す膨大な数のバリエーションから目的の活性をもつものを選択する、人工分子の創製にシフトしていますが、そのようにして得られた人工タンパク質(例えば抗体)の活性部位の情報を他のタンパク質(たとえば血清アルブミン)に移植することは実質的には不可能でした。それは、抗体などのタンパク質分子の活性部位は一次配列上で離れた場所に散在するアミノ酸残基が寄せ集まって三次元的に構成されるという特徴があるためです。
研究の内容
ところがRaPID法で得られる環状ペプチドは、10の12~13乗という膨大な多様性をもつライブラリーのなかから選択されるために、その十数残基のひと続きの領域に標的結合を達成するのに十分な三次元的構造がすべて内包されているため、高木教授らの研究グループはこれを単純にタンパク質表面のループに挿入して提示するという方法を考案しました。これにより、RaPIDペプチドの持つ高い特異性と親和性を、生体内で安定なタンパク質(たとえば抗体分子)に簡単に賦与することが可能になり、ペプチド化学とタンパク質工学が融合した新しいモダリティの誕生を見ました。抗体に代表されるバイオ医薬品は、現在市販される薬のなかで年々その重要度を増しており、とくに一つの抗体が2つ以上の標的に結合する「多重特異性抗体」は世界中で開発が進行中ですが、天然の抗体分子を大きく改変する技術であるため、実用化までに大変長い道のりを通らざるを得ません。ところがラッソ・グラフト法を用いると、ひとたび標的結合性のペプチド配列が得られれば、それを望みのタンパク質に自由な組み合わせで「コピー&ペースト」することができ、2重どころか4重特異性抗体(一つの分子が4つの異なる標的に対して結合)も瞬時に可能になりました。
さらに、この方法をつかって高木教授らは、アデノ随伴ウイルス(AAV)※5の表面に標的結合性ペプチドを提示し、特定の受容体を発現する細胞だけに感染して遺伝子を導入することにも成功しました(図2)。遺伝子治療ベクターとして最も有望視されているAAVですが、幅広い細胞に感染できる性質をもつため、逆に特定の臓器や組織だけに遺伝子を導入することは困難で、このことが遺伝子治療の普及のための一つのネックとなっています。今回の結果は、ラッソ・グラフト法で改変したAAVベクターが、遺伝子治療における副作用の低減につながり得ることを示唆します。
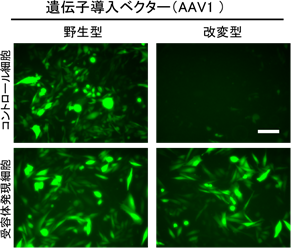
図2 ラッソ・グラフト法のAAVへの応用
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、複雑なタンパク質工学的改変を経ずに様々な標的に対して結合する人工タンパク質を迅速に開発することが可能になり、いろいろな疾患に対するバイオ医薬の創成につながることが期待されます。さらに、どんなタンパク質やウイルスにも標的結合能を後から賦与できるという性質は、遺伝子治療、細胞治療などの最新の医療技術と組み合わせてそれらのより広い応用を促進出来る可能性があります。
特記事項
本研究成果は、2021年3月9日(火)19時(日本時間)に米国科学誌「Nature Communications」(オンライン)に掲載されました。
- タイトル
- “Lasso-grafting of macrocyclic peptide pharmacophores yields multi-functional proteins”
- 著者名
- Emiko Mihara, Satoshi Watanabe, Nasir K. Bashiruddin, Nozomi Nakamura, Kyoko Matoba, Yumi Sano, Rumit Maini, Yizhen Yin, Katsuya Sakai, Takao Arimori, Kunio Matsumoto, Hiroaki Suga, and Junichi Takagi
- DOI
- 10.1038/s41467-021-21875-0
なお、本研究は、AMED創薬等ライフサイエンス研究支援基盤事業(BINDS)の一環として行われました。
用語説明
- ※1 RaPID(Random non-standard Peptides Integrated Discovery)法
- 東京大学の菅裕明教授が開発した方法で、遺伝子コードの再プログラミングとmRNAディスプレイを組み合わせて、1012以上からなるランダム配列から、標的に対して絶妙な結合特異性と高い親和性を示す大環状ペプチドを提供する技術。
- ※2 多重特異性抗体
- 通常、抗体というのはたった一つの標的分子(抗原という)のみを特異的に認識するように出来ているが、タンパク質工学的に2つの抗体を合体させることで異なる2つの抗原を結合できるようにしたものが2重特異性抗体である。これによって一つの抗体が異なる細胞(たとえばリンパ球とがん細胞のように)を引き寄せられるようにしたり、細胞上で二つの受容体分子を架橋したりすることで特定の治療効果を発揮する。3つ以上の抗原に結合できる多重特異性抗体も開発されているが、医薬品として実用化されているものはまだ存在しない。
- ※3 バイオ医薬
- 伝統的な医薬品(たとえばアスピリン)は分子量が500以下の低分子有機化合物であるのに対し、抗体(分子量15万)のような巨大で複雑なタンパク質を医薬品として用いるとき、これを特に生物医薬あるいはバイオ医薬とよぶ。その名前の由来は、生物(細胞、ウイルス、バクテリアなど)によって産生される医薬品ということにある。バイオ医薬品は人体が自然に産生する分子に近いため、多くの病気に対して高い治療効果があるが、一方でその製造工程が複雑であるために、高額医薬品となってしまうという問題がある。
- ※4 医薬モダリティ
- 上記のように伝統的な低分子有機化合物に加えてバイオ医薬のほか、核酸医薬、細胞医薬などさまざまな形態の物質が医薬品として登場するようになっている。これら医薬品を大きく分子形態で分けたときにそれぞれをモダリティと呼ぶことが一般的になりつつある。
- ※5 アデノ随伴ウイルス(AAV)
- アデノ随伴ウイルス(adeno-associated virus;AAV)は、ヒトや霊長目の動物に感染する小型でエンベロープを持たないウイルスであり、キャプシドと呼ばれる蛋白質の「殻」の中に一本鎖DNAのゲノムを収納している。病原性を持たず、ヒトの細胞に外来性遺伝子を導入する活性をもつことから遺伝子治療のベクターとして多用されている。
本件に関するお問い合わせ先
大阪大学 蛋白質研究所 教授 高木淳一(たかぎじゅんいち)
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)